- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Щелочноземельные металлы. Кальций
Содержание
- 1. Презентация Щелочноземельные металлы. Кальций
- 2. Химический элементКальций(от латинского Calcium)
- 3. СодержаниеХарактеристика элементаСтроение атомаНахождение в природеВажнейшие природные соединения
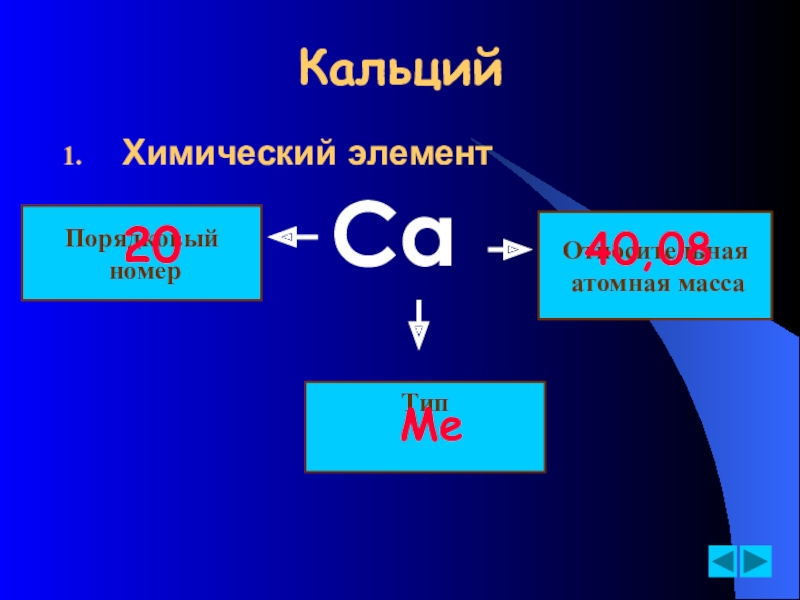
- 4. КальцийХимический элементСаПорядковый номерОтносительная атомная масса20 40,08ТипMe
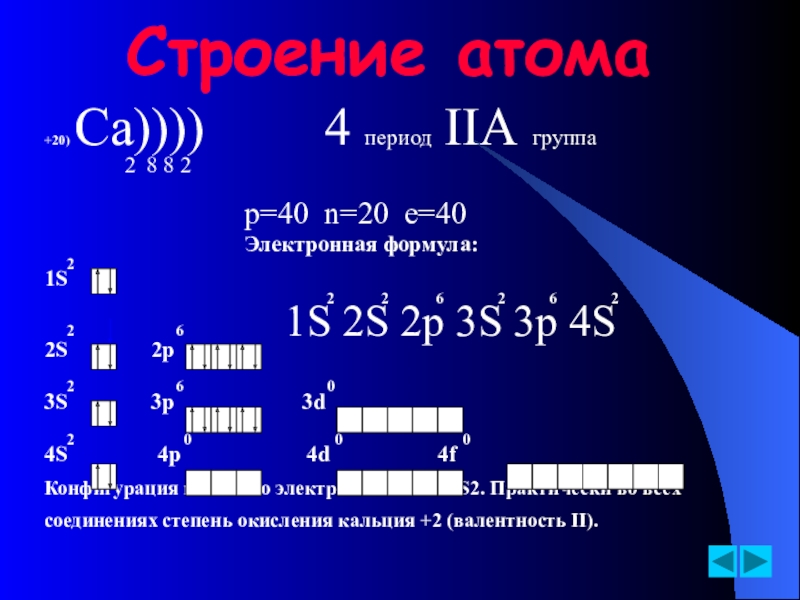
- 5. Строение атома+20) Ca))))
- 6. Кальций Нахождение в природеФизические свойстваХимические свойстваСоединенияБиологическая рольПрименение
- 7. Нахождение в природе Кальций относится к числу наиболее
- 8. Важнейшие природные соединения кальция
- 9. Физические свойстваКальций – простое вещество.Представляет собой лёгкий
- 10. Химические свойства В химическом отношении кальций очень активен.
- 11. Cоединения кальция3. Карбонат кальция Карбонат кальция Карбонат
- 12. Оксид кальция СаО или негашёная известь, в
- 13. Гидроксид кальция Ca(OH)2 или известковая вода. Относится к
- 14. Карбонат кальция СаСО3 Самое распространённое соединение кальция. Нерастворим
- 15. Биологическая роль кальция Ионы кальция вместе с ионами
- 16. Применение Вяжущие соединения кальция широко применяются в
- 17. Применение Металлический кальций применяют для металлотермического получения урана,
- 18. Широко применяется и сульфат кальция, существующий как
- 19. Известь Связывающее действие гашеной извести основано на том,
- 20. Гипс Гипс широко используют в строительстве, в скульптуре,
- 21. Кальций в организме Важный компонент минерального обмена животных
- 22. Кальций в организме Кальций необходим организму,
Слайд 1Щелочноземельные металлы
«Кальций»
Учитель химии и биологии
Соромотина И.А.
ГКСУВУПКЗТ «Очерская спецшкола»
Слайд 2Химический элемент
Кальций
(от латинского Calcium)
40
20 Ca
впервые получен английским химиком Г.Дэви в 1808 году
Слайд 3Содержание
Характеристика элемента
Строение атома
Нахождение в природе
Важнейшие природные соединения кальция
Физические свойства
Химические свойства
Соединения кальция
Оксид
Гидроксид кальция
Карбонат кальция
Биологическая роль кальция
Применение
Слайд 5Строение атома
+20) Ca)))) 4 период IIА группа
2
p=40 n=20 e=40
Электронная формула:
2
1S
2 2 6 2 6 2
2 6 1S 2S 2p 3S 3p 4S
2S 2p
2 6 0
3S 3p 3d
2 0 0 0
4S 4p 4d 4f
Конфигурация внешнего электронного слоя 4S2. Практически во всех
соединениях степень окисления кальция +2 (валентность II).
Слайд 6Кальций
Нахождение
в природе
Физические
свойства
Химические
свойства
Соединения
Биологическая
роль
Применение
Слайд 7Нахождение в природе
Кальций относится к числу наиболее распрастранённых элементов. В земной
2,96 % по массе. Он обладает большой химической активностью, поэтому встречается в природе только в виде соединений.
Большая его часть содержится в виде силикатов и алюмосиликатов в изверженных горных породах (граниты, гнейсы и др.) Из других пород наиболее распространены известняк и мел, состоящие в основном из минерала кальцита СаСО3.
Из солей кальция образованы горные массивы глинистые породы; кальций содержится в морской и речной воде, обусловливая её жёсткость, входит в состав растительных и животных организмов.
Значительно реже встречается окристаллизованная форма кальцита – мрамор. Широко распространены ангидрит СаSO4 и гипс CaSO4*2H2O.
Слайд 9Физические свойства
Кальций – простое вещество.
Представляет собой лёгкий твёрдый металл (p=1,55 г/куб.см).
Кальций можно вытягивать в проволоку, ковать, прессовать.
Температура плавления кальция равна 851 градус.
При обычных условиях кальций энергично взаимодействует с активными неметаллами.
При нагревании кальций реагирует с менее активными (азот, водород, углерод, кремний и др.)
Реакции сопровождаются выделением большого количества теплоты.
Слайд 10Химические свойства
В химическом отношении кальций очень активен. Уже на воздухе он
Слайд 11Cоединения кальция
3. Карбонат кальция Карбонат кальция Карбонат кальция СО Карбонат кальция
1. Оксид кальция СаО
2. Гидроксид кальция Са(ОН)Гидроксид кальция Са(ОН)2
Слайд 12Оксид кальция СаО
или негашёная известь, в промышленности получают терми-
ческим
Оксид кальция реагирует с водой, образуя гашёную известь
Са(ОН)2:
CaO+HOH=Ca(HO)2+63,5kДж (реакция соединения)
Оксид кальция хорошо взаимодействует с кислотами и
кислотными оксидами:
CaO+2HCl=CaCl2+H2O (реакция обмена)
CaO+CO2=CaCO3 (реакция соединения)
При высоких температурах оксид кальция реагирует с коксом,
образуя карбид кальция и оксид углерода:
CaO+3C=CaC2+CO (реакция обмена)
Оксид кальция относится к основным.
Слайд 13Гидроксид кальция Ca(OH)2
или известковая вода. Относится к числу сильных оснований имеет
При непродолжительном пропускании через неё СО2 образуется осадок:
Ca(OH)2 + CO2 = CaCO3 +H2O (реакция обмена)
Слайд 14Карбонат кальция СаСО3
Самое распространённое соединение
кальция. Нерастворим в воде, поэтому
известковая
Са(ОН)+СО2=СаСО3 +Н2О (реакция обмена)
Слайд 15Биологическая роль кальция
Ионы кальция вместе с ионами магния и натрия –
Функции кальция в организме разнообразны. Кроме участия в образовании костной ткани, кальций снижает возбудимость отдельных участков нервной системы, температуру тела, ослабляет действие на организм токсинов, повышает устойчивость организма к инфекциям, необходим как активатор ферментов, влияющих на свёртывание крови.
Слайд 16Применение
Вяжущие соединения кальция широко применяются в производстве вяжущих материалов (цемент,
Мел используют для побелки и
также для рисования.
Слайд 17Применение
Металлический кальций применяют для металлотермического получения урана, тория, титана, циркония, цезия и
Большие количества известняка расходуются при производстве чугуна, так как позволяют перевести тугоплавкие примеси железной руды (например, кварц SiO2) в сравнительно легкоплавкие шлаки.
В качестве дезинфицирующего средства очень эффективна хлорная известь — «хлорка» Ca(OCl)Cl — смешанный хлорид и гипохлорид кальция, обладающий высокой окислительной способностью.
Слайд 18 Широко применяется и сульфат кальция, существующий как в виде безводного соединения,
Хлорид кальция CaCl2 используют наряду с поваренной солью для борьбы с оледенением дорожных покрытий.
Фторид кальция СаF2 — прекрасный оптический материал.
Карбид кальция применяется для получения ацетилена.
Применение
Слайд 19Известь
Связывающее действие гашеной извести основано на том, что с течением времени
Слайд 20Гипс
Гипс широко используют в строительстве, в скульптуре, для изготовления лепнины и
Слайд 21Кальций в организме
Важный компонент минерального обмена животных и человека и минерального
Кальций участвует в работе ионных каналов, осуществляющих транспорт веществ через биологические мембраны, в передаче нервного импульса, в процессах свёртывания крови и оплодотворения. Регулируют обмен кальция в организме кальциферолы (витамин D). Недостаток или избыток кальция приводит к различным заболеваниям — рахиту, кальцинозу и др.
Кальций — биогенный элемент, постоянно присутствующий в тканях растений и животных.
Слайд 22Кальций в организме
Кальций необходим организму, поэтому пища человека должна
Препараты кальция широко используются в медицине.