- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Исходная презентация Подгруппа серы для подготовки урока химии на повышенном уровне
Содержание
- 1. Исходная презентация Подгруппа серы для подготовки урока химии на повышенном уровне
- 2. Элементы 16 группыO – кислород, S –
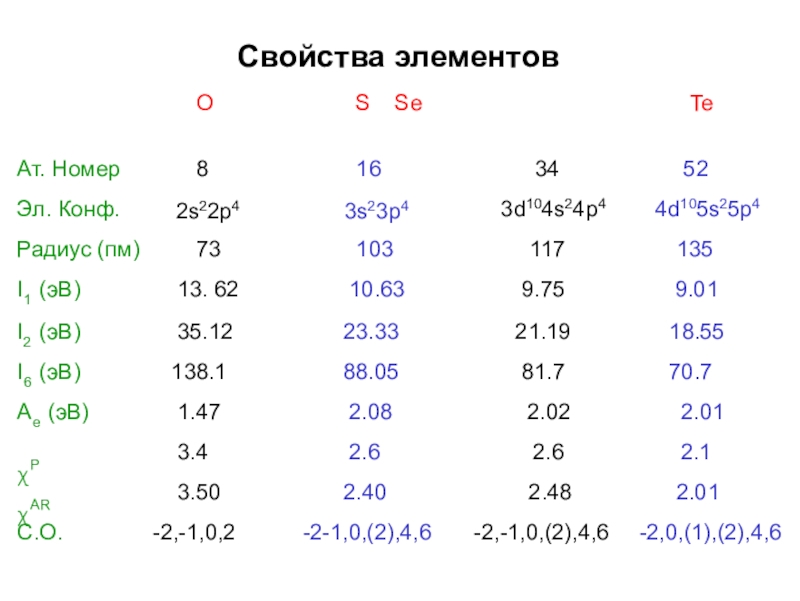
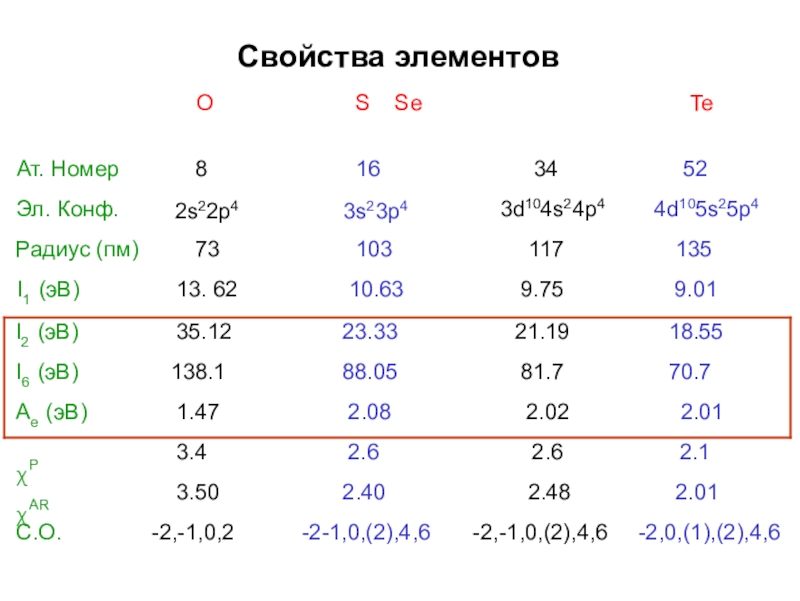
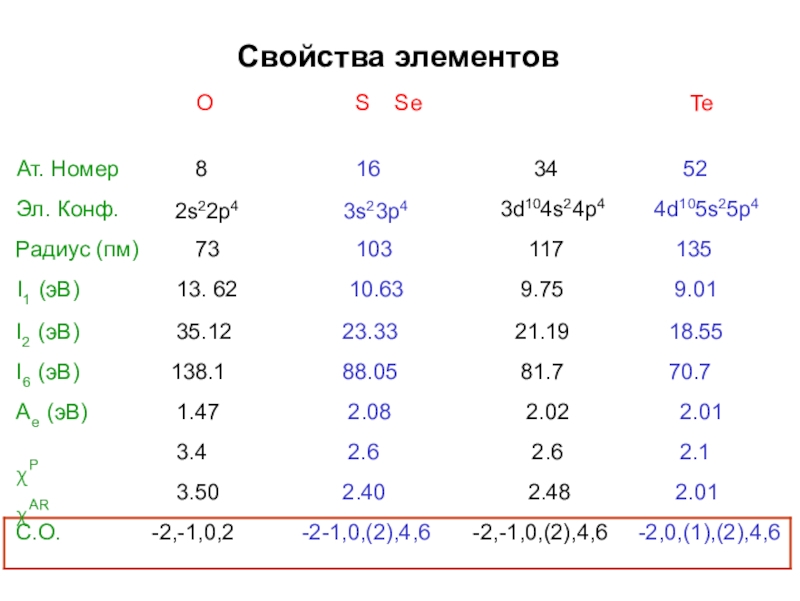
- 3. Свойства элементовOS SeTe
- 4. Свойства элементовOS SeTeАт. Номер Эл. Конф.82s22p4163s23p434 3d104s24p452 4d105s25p4Радиус
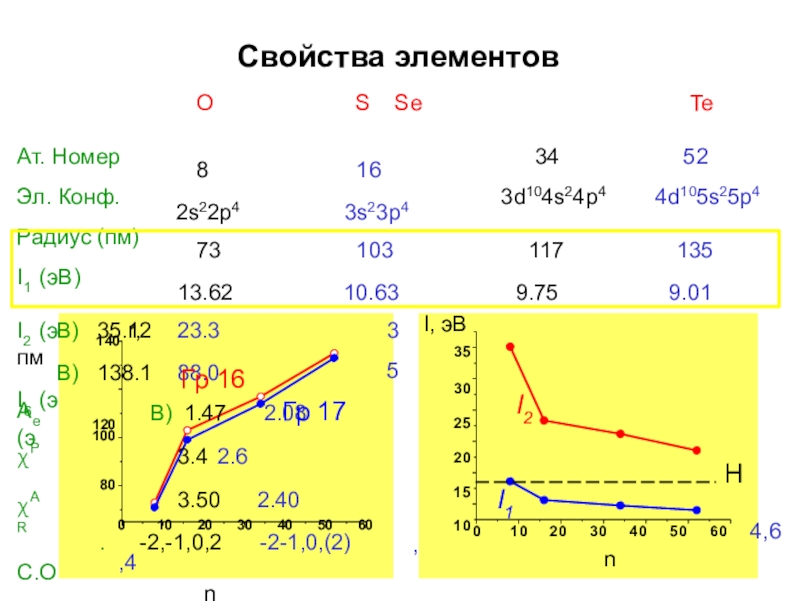
- 5. Свойства элементовOS SeTe
- 6. Свойства элементовO S Se8 16 34 22p4 3s23p4 3d104s24p4 3 103 1173. 62 10.63 9.755.12 23.33 21.198.1 88.05 81.7TeАт. Номер
- 7. Свойства элементовOS SeTe
- 8. Свойства простых веществO S SeTeПри н.у.бесцв. газжелтое тв. в-восерое тв. в-восерое тв. в-воТ.пл., оС-219120220450Т.кип., оС-183446 685ромбическая кристалл.моноклин. аморфн.990АллотропияО2, О3―Строениемолекулымолекулы, полимерыполимер, молекулыполимерΔHoдисс(298), 498266192~120кДж/моль
- 9. Нахождение в природе и получениеКислород~21% атмосферы. Минералы
- 10. Нахождение в природе и получениеСера0.05 мас.% в
- 11. Нахождение в природе и получениеСелен, теллурСопутствуют сере
- 12. Нахождение в природе и получениеСелен, теллурСопутствуют сере
- 13. Нахождение в природе и получениеСе(хален, теллурСопутствуют сере
- 14. ПрименениеOподдержание горенияподдержание дыханияпроизводство сталиSпроизводство серной кислотывулканизация натуральной
- 15. Свойства кислорода1. О2 – бесцветный газ, конденсируется
- 16. Свойства кислорода3. Окисляет металлы и неметаллыP4 +
- 17. Молекулярный кислород2σu 1πg 1πu2σg1σu 1σgO2 O2*O2*Нормальноесостояние, триплетВозбужденныесостояния, синглетыЕΔЕ
- 18. Озон1. Озон (О3)газ голубого цвета при н.у.,
- 19. Озон3. Сильнейший окислительO3 + 2H+ + 2e-
- 20. ОксидыТипы бинарных кислородных соединений:1. ОксидыО2-все элементы, кроме
- 21. Типы оксидов:Оксиды активных металловМ2О (ЩМ), МО (ЩЗМ),
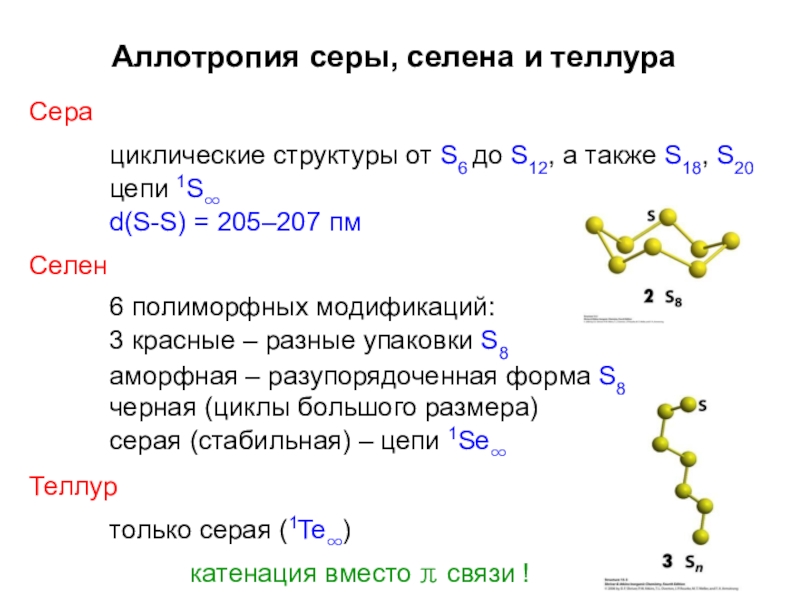
- 22. Аллотропия серы, селена и теллураСерациклические структуры от
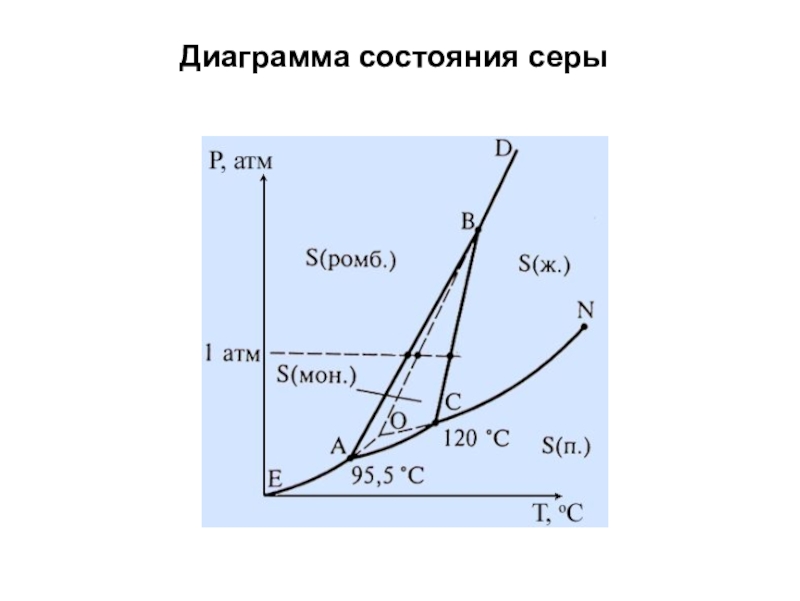
- 23. Диаграмма состояния серы
- 24. Свойства серы, селена и теллураS Se TeОтношение к Н2ОРастворимость
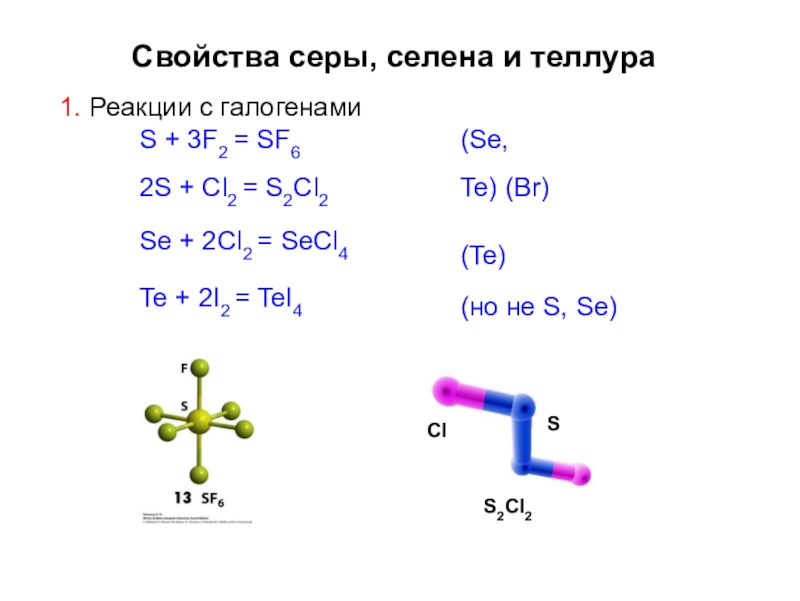
- 25. Свойства серы, селена и теллура1. Реакции с
- 26. 2. Образование поликатионов и полианионовS8 + 3AsF5
- 27. Свойства серы, селена и теллураГорениеS + O2
- 28. Диспропорционирование3Se + 6KOH = K2SeO3 + 2K2Se
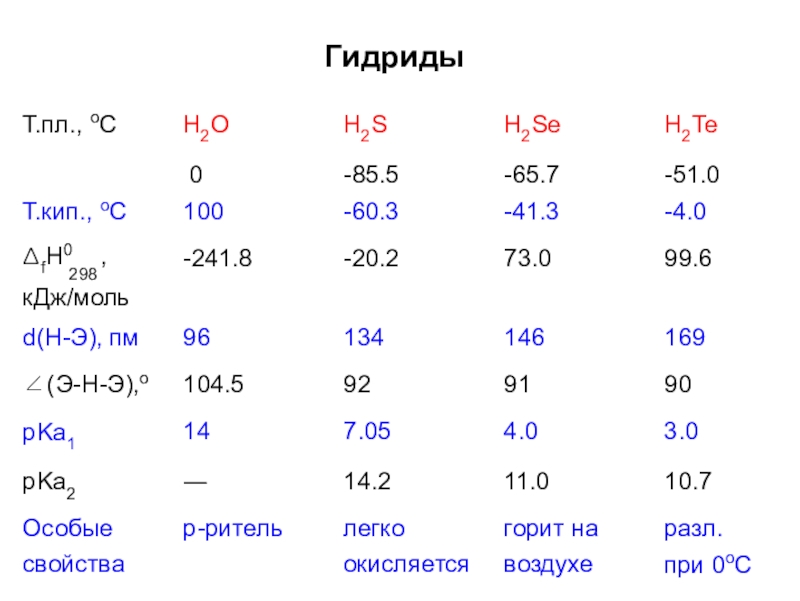
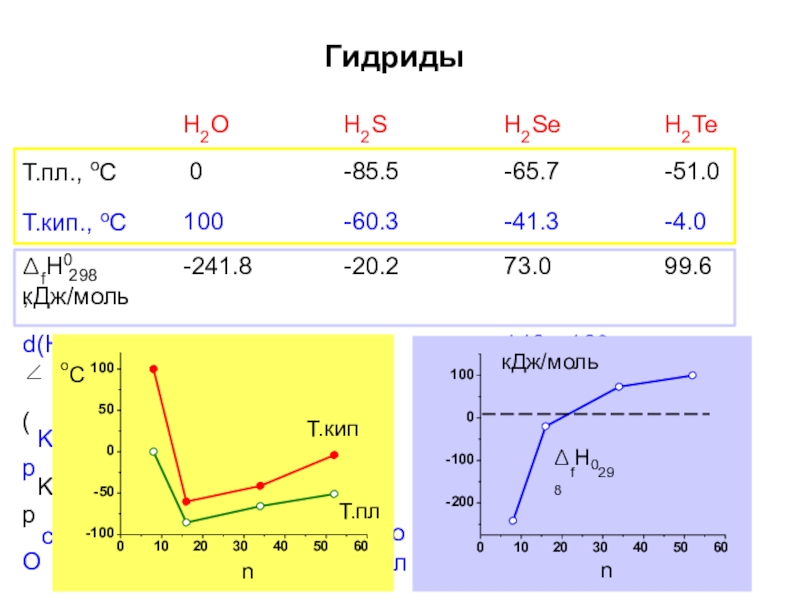
- 29. Гидриды
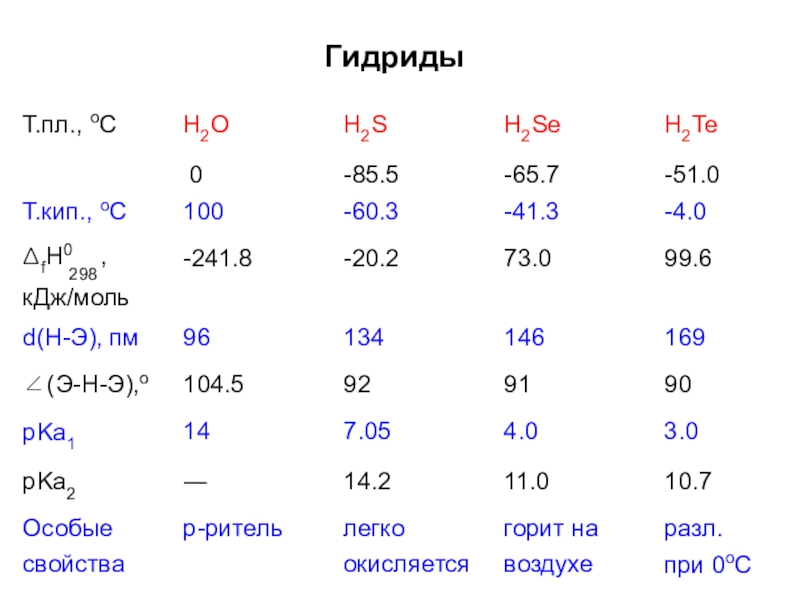
- 30. ГидридыH2OH2SH2SeH2TeТ.пл., оСТ.кип., оС0100-85.5-60.3-65.7-41.3-51.0-4.0ΔfH0 ,298-241.8-20.273.099.6кДж/мольd(∠( p p ОсвН-Э), пм 96 134Э-Н-Э),о 104.5 92Ka1 14 7.05Ka2 ― 14.2собые р-ритель легк ойства окис146 16991 904.0 3.011.0 10.7горит на разл. яется воздухе при 0оСол010 20 30 40 50 60n-100-50050100оСТ.кипТ.пл010 20 30 40 50 60n-200-1000100кДж/мольΔfH0298
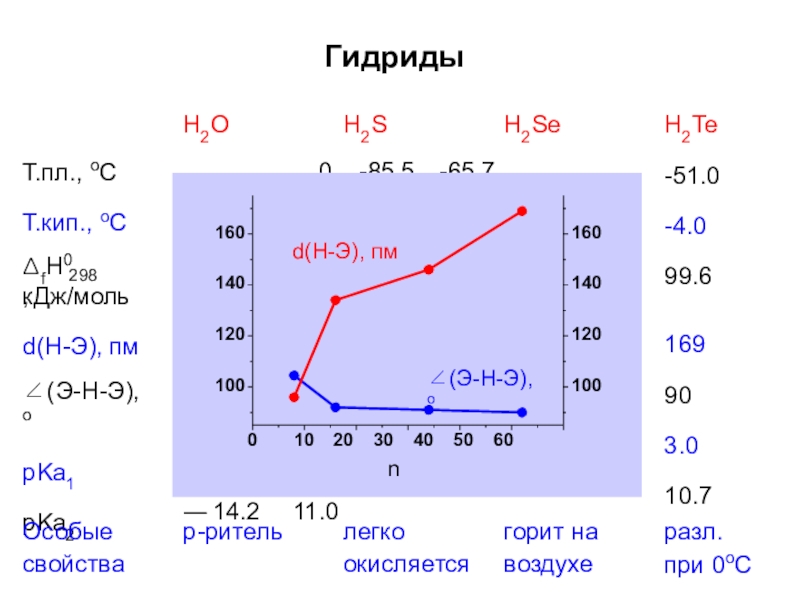
- 31. H2OH2SH2SeH2Te-51.0-4.099.6Т.пл., оСТ.кип., оС0 -85.5 -65.7100 -60.3 -41.3-241.8 -20.2 73.096 134 146104.5 92 9114 7.05 4.0― 14.2 11.0ΔfH0 ,298кДж/мольd(Н-Э), пм169903.010.7∠(Э-Н-Э),оpKa1pKa2Гидриды010 20 30 40 50 60n100120140160100120140160d(H-Э), пм∠(Э-Н-Э),о
- 32. Гидриды
- 33. Гидриды1. ПолучениеAl2S3 + 6H2O = 2Al(OH)3 +
- 34. Гидриды3. Окисление2H2Se + O2 = 2H2O +
- 35. Галогениды серы, селена и теллура
- 36. Галогениды серы, селена и теллура1. Галогениды S,
- 37. Оксиды серы, селена и теллураS, Se, Te
- 38. Диоксиды серы, селена и теллураSO2, SeO2, TeO2
- 39. Свойства SO21. Получение в промышленности:S + 1/2O2
- 40. NH3ClRuNH3NH38. Лиганд в комплексных соединенияхSO2NH3Свойства SO26. Растворитель2SO2
- 41. Триоксиды серы, селена и теллураSO3sp2-гибридизацияПолучение2SO2 + O2
- 42. Кислородные кислоты S, Se, Te
- 43. Кислородные кислоты S, Se, Te (IV)1. ПолучениеSeO2
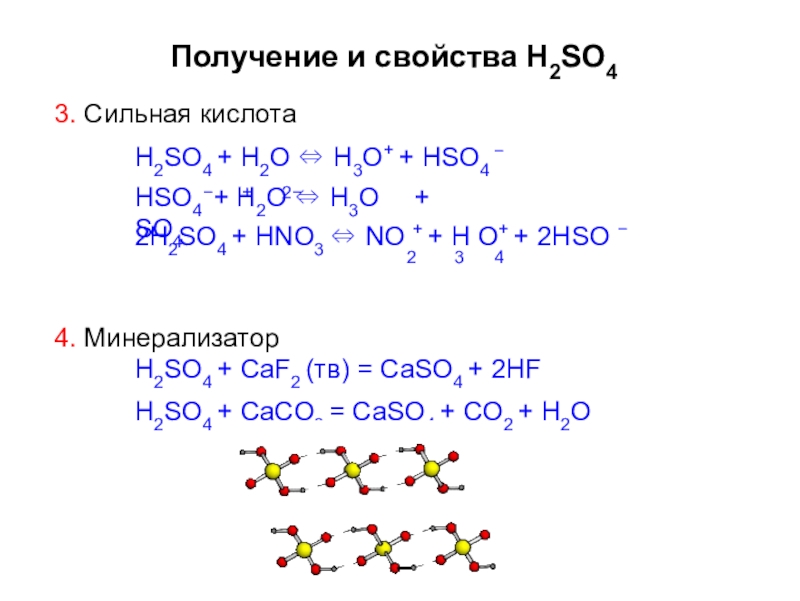
- 44. Получение и свойства H2SO41. Контактный процессSO2 + 1/2O2
- 45. Получение и свойства H2SO43. Сильная кислотаH2SO4 +
- 46. Получение и свойства H2SO44. Окислитель при с
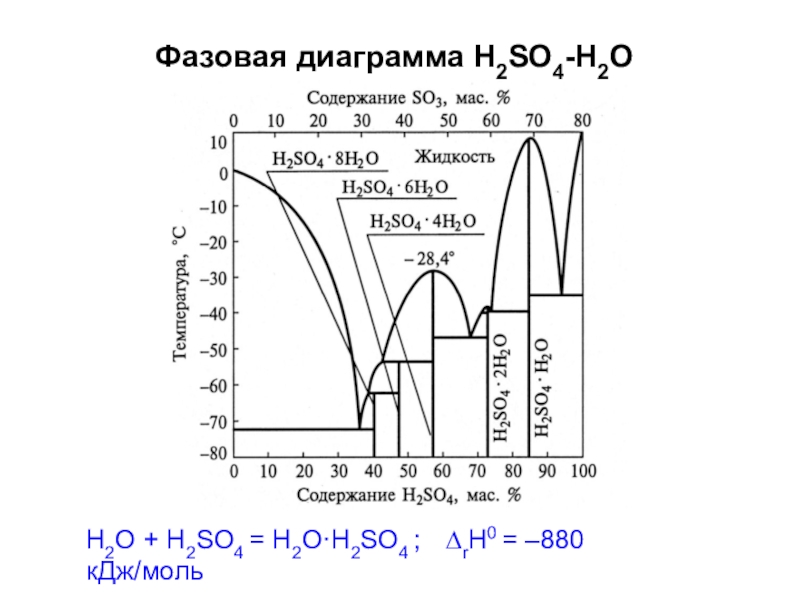
- 47. Фазовая диаграмма H2SO4-H2OH2O + H2SO4 = H2O·H2SO4 ; ∆rH0 = –880 кДж/моль
- 48. 1. ДиссоциацияH2SeO4 ⇔ H+ + HSeO4-HSeO4 ⇔ H +
- 49. Сравнение силы кислотH2SO3 H2SeO3 (H2TeO3)Ослабление π-связи Э-О Уменьшение силы кислотУвеличение числа связей Э=ОУвеличение силы кислотH2SO3H2SO4
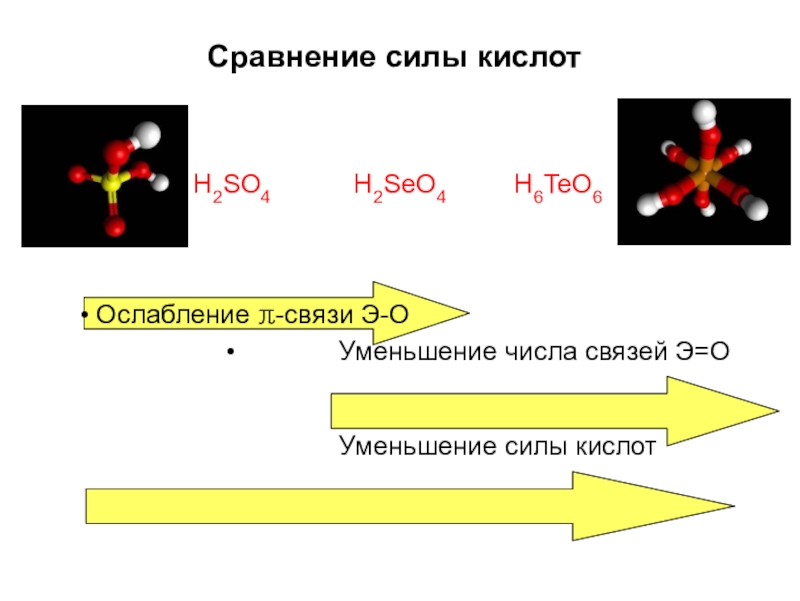
- 50. Сравнение силы кислотH2SO4H2SeO4H6TeO6Ослабление π-связи Э-ОУменьшение числа связей Э=О Уменьшение силы кислот
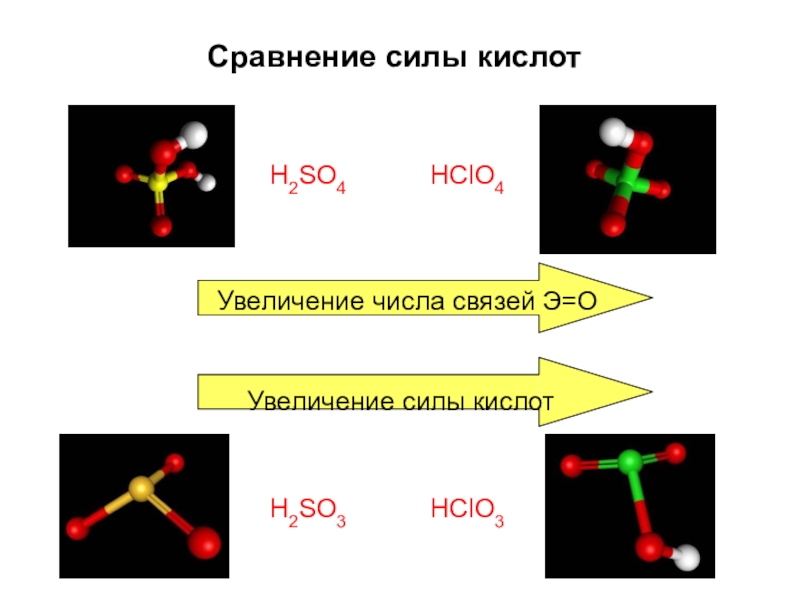
- 51. Сравнение силы кислотH2SO4HClO4Увеличение числа связей Э=ОУвеличение силы кислотH2SO3HClO3
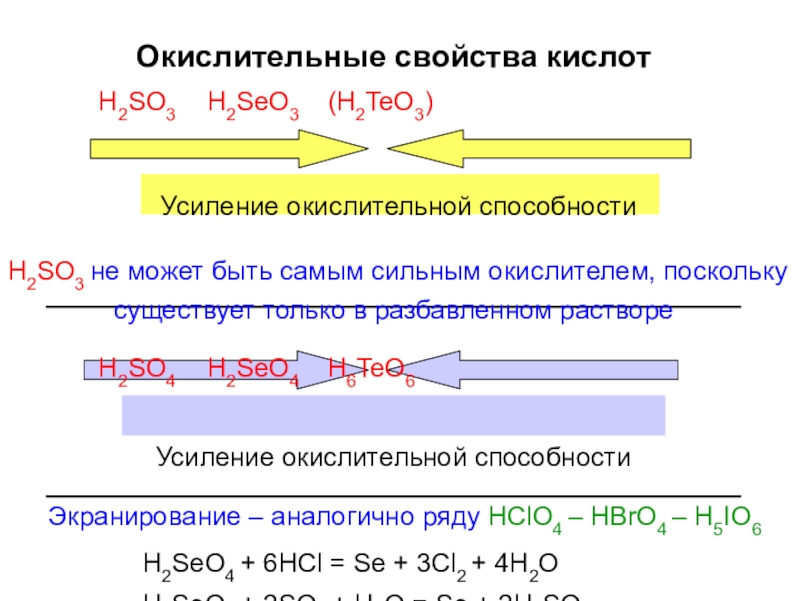
- 52. Окислительные свойства кислотH2SO3 H2SeO3 (H2TeO3)Усиление окислительной способностиH2SO3 не может
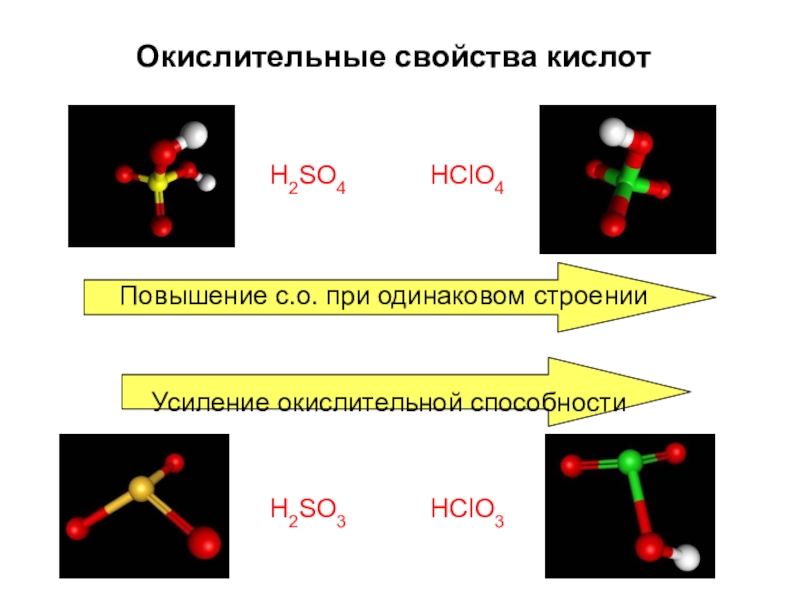
- 53. Окислительные свойства кислотH2SO4HClO4Повышение с.о. при одинаковом строенииУсиление окислительной способностиH2SO3HClO3
- 54. Кислородные кислоты со связью S-SH2S2O3H2S2O4H2S2O6H2S3O6H2S4O6H2SxO6тиосерная дитионистая дитионовая
- 55. Получение и свойства тиокислот1. HSO3Cl + H2S
- 56. Пероксокислоты серыH2SO5H2S2O8кислота Каро (пероксомоносерная)окислительпероксодисерная сильный окислитель2H2SO4 H2S2O8 + H2H2S2O8
- 57. Галогенокислоты серыSO3 + HF = HSO3F(Cl)2HSO3F +
- 58. Соединения серы с азотом6S2Cl2 + 16NH3 S4N4 +
- 59. Общие закономерностиУсиливаются «металлические» свойства элементов, уменьшается кислотность
Слайд 4Свойства элементов
O
S Se
Te
Ат. Номер Эл. Конф.
8
2s22p4
16
3s23p4
34 3d104s24p4
52 4d105s25p4
Радиус (пм) I1 (эВ)
73
13.62
103
10.63
117
9.75
135
9.01
21.19 18.55
81.7 70.7
2.02 2.01
2.6 2.1
2.48 2.01
,6 -2,-1,0,(2),4,6 -2,0,(1),(2),
I2 (э 140
I6 (э
120
В) 35.12 23.3
В) 138.1 88.0
В) 1.47 2.08
3.4 2.6
3.50 2.40
. -2,-1,0,2 -2-1,0,(2)
3
5
Ae (э
χP χAR
С.О
0 10 20 30 40 50 60 ,4
n
4,6
80
100
0
10 20 30 40 50 60
n
I, эВ
35
30
25
20
15
10
I2
I1
Гр 16
Гр 17
H
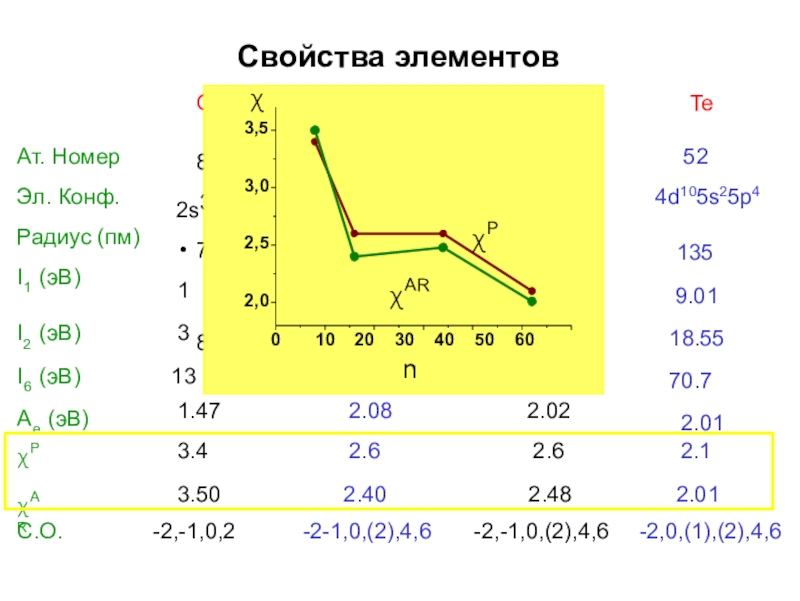
Слайд 6Свойства элементов
O S Se
8 16 34 22p4 3s23p4 3d104s24p4 3 103 117
3. 62 10.63 9.75
5.12 23.33 21.19
8.1 88.05 81.7
Te
Ат. Номер Эл. Конф. Радиус (пм)
I2 (эВ)
I6 (эВ)
Ae (эВ)
52 4d105s25p4
135
9.01
18.55
70.7
2.01
2s
7
1
3
13
1.47
2.08
2.02
χP χAR
3.4
3.50
2.6
2.40
2.6
2.48
2.1
2.01
С.О.
-2,-1,0,2
-2-1,0,(2),4,6
-2,-1,0,(2),4,6
-2,0,(1),(2),4,6
0
10 20 30 40 50 60
n
2,0
2,5
3,0
χ
3,5
χP
χAR
Слайд 8Свойства простых веществ
O S Se
Te
При н.у.
бесцв. газ
желтое тв. в-во
серое тв. в-во
серое тв. в-во
Т.пл.,
-219
120
220
450
Т.кип., оС
-183
446 685
ромбическая кристалл.
моноклин. аморфн.
990
Аллотропия
О2, О3
―
Строение
молекулы
молекулы, полимеры
полимер, молекулы
полимер
ΔHo
дисс
(298), 498
266
192
~120
кДж/моль
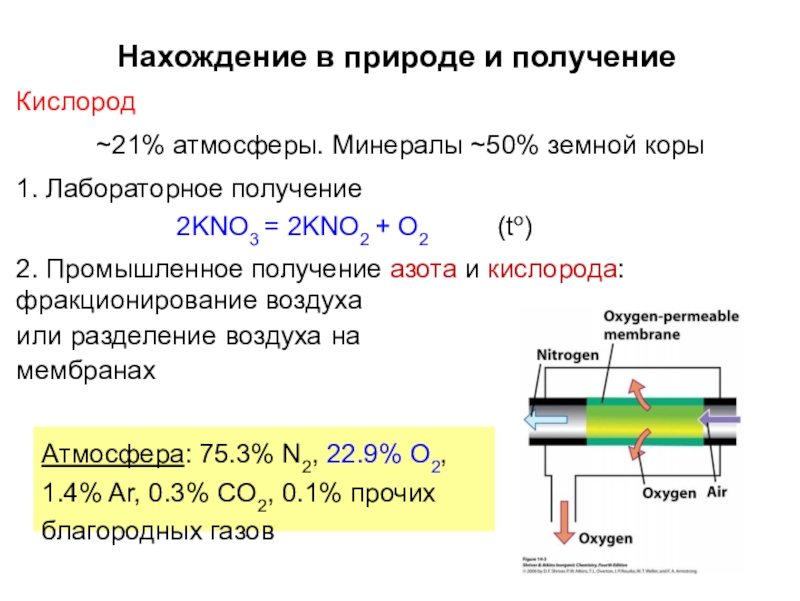
Слайд 9Нахождение в природе и получение
Кислород
~21% атмосферы. Минералы ~50% земной коры
1. Лабораторное
2KNO3 = 2KNO2 + O2
(to)
2. Промышленное получение азота и кислорода:
фракционирование воздуха или разделение воздуха на мембранах
Атмосфера: 75.3% N2, 22.9% O2,
1.4% Ar, 0.3% CO2, 0.1% прочих
благородных газов
Слайд 10Нахождение в природе и получение
Сера
0.05 мас.% в земной коре Самородная. Сульфиды
(сфалерит, вюртцит), HgS (киноварь). Сульфаты
Na2SO4·10H2O (мирабилит), CaSO4·2H2O (гипс)
Получают нагреванием самородной S с H2O при
160оС и 20 атм
или 2H2S + O2 = 2S + 2H2O
кат.: C/Al
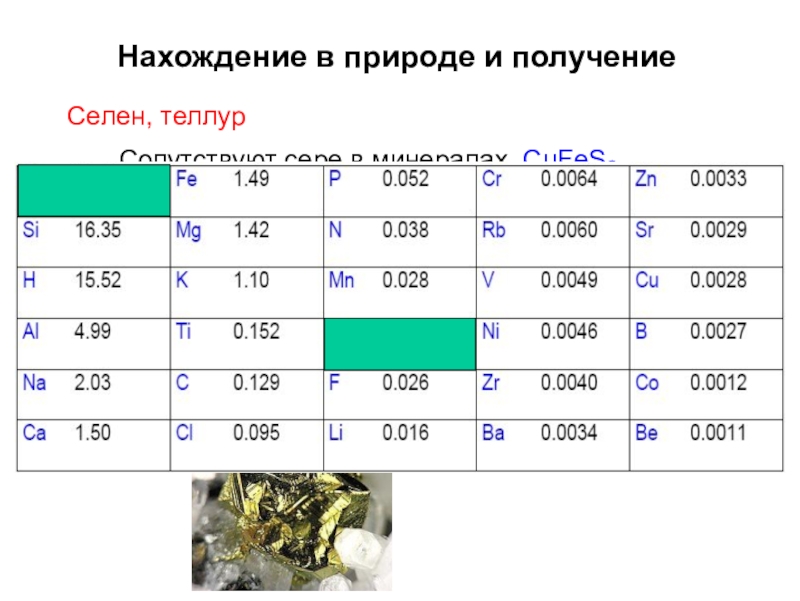
Слайд 11Нахождение в природе и получение
Селен, теллур
Сопутствуют сере в минералах. CuFeS2
(халькопирит).
Получают из
SeO2 + 2SO2 = Se + 2SO3
TeO2 + 2NaOH = Na2TeO3 + H2O,
далее электролиз раствора
Слайд 12Нахождение в природе и получение
Селен, теллур
Сопутствуют сере в минералах. CuFeS
2
(халькопирит).
Получают из
SeO2 + 2SO2 = Se + 2SO3
TeO2 + 2NaOH = Na2TeO3 + H2O,
далее электролиз раствора
Слайд 13Нахождение в природе и получение
Се
(ха
лен, теллур
Сопутствуют сере в минералах. CuFeS2
лькопирит).
Получают из
SeO2 + 2SO2 = Se + 2SO3
TeO2 + 2NaOH = Na2TeO3 + H2O,
лее электролиз раствора
а
да
Слайд 14Применение
O
поддержание горения
поддержание дыхания
производство стали
S
производство серной кислоты
вулканизация натуральной резины
производство пороха
Se - в копировальных
- производство фотоэлементов
Te
в полупроводниках
в термоэлектрических элементах
Слайд 15Свойства кислорода
1. О2 – бесцветный газ, конденсируется в жидкость голубого цвета
Парамагнитен в любом агрегатном состоянии
О2 тяжелее воздуха, d = 1.43 г/л
Плохо растворим в полярных растворителях
(3.15 мл О2 в 100 мл Н2О при 20оС)
Хорошо растворим в неполярных растворителях
2. Кислород вступает в реакции со всеми веществами, кроме легких галогенов и благородных газов
Слайд 16Свойства кислорода
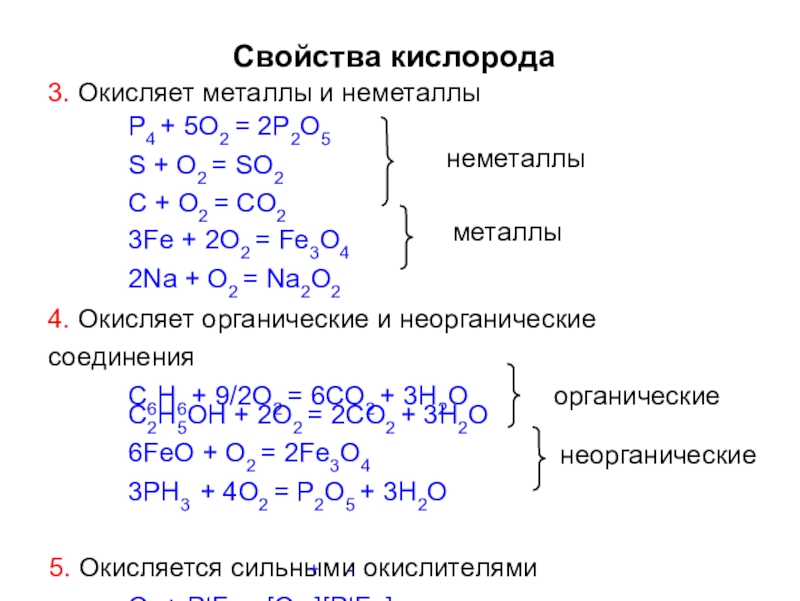
3. Окисляет металлы и неметаллы
P4 + 5O2 = 2P2O5 S
C + O2 = CO2
3Fe + 2O2 = Fe3O4
2Na + O2 = Na2O2
4. Окисляет органические и неорганические соединения
C6H6 + 9/2O2 = 6CO2 + 3H2O
C2H5OH + 2O2 = 2CO2 + 3H2O 6FeO + O2 = 2Fe3O4
3PH3 + 4O2 = P2O5 + 3H2O
5. Окисляется сильными окислителями
O2 + PtF6 = [O2 ][PtF6 ]
+ -
неметаллы
металлы
органические
неорганические
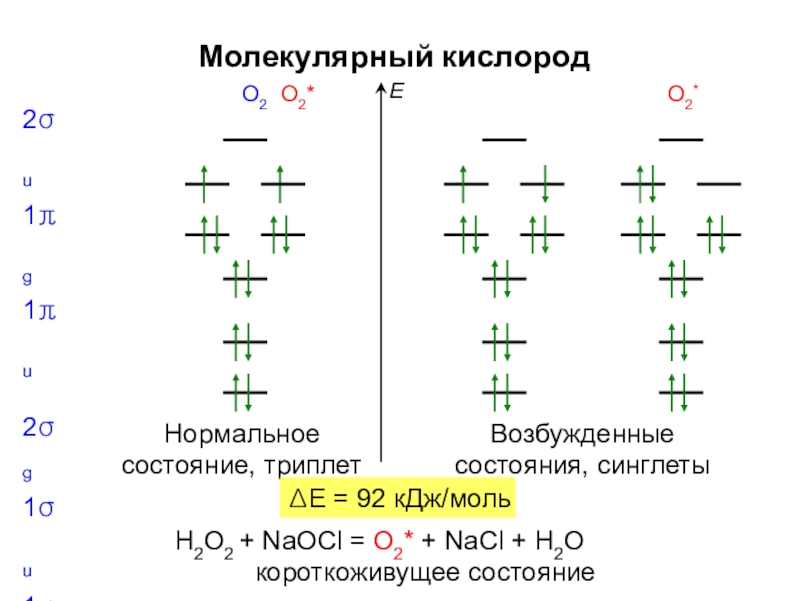
Слайд 17Молекулярный кислород
2σu 1πg 1πu
2σg
1σu 1σg
O2 O2*
O2
*
Нормальное
состояние, триплет
Возбужденные
состояния, синглеты
Е
ΔЕ = 92 кДж/моль
H2O2 +
короткоживущее состояние
Слайд 18Озон
1. Озон (О3)
газ голубого цвета при н.у., с сильным запахом диамагнитен
т.пл.
d = 128 пм, α = 116.5о
2. Получают при действии тихого электрического разряда на О2
3O2 ⇔ 2O3
выход ~10%
ΔfH0
298
= +142.7 кДж/моль
α
d
Слайд 19Озон
3. Сильнейший окислитель
O3 + 2H+ + 2e- = O2 + H2O
O3 + S + H2O = H2SO4
O3 + 2KI + H2O = 2KOH + O2 + I2 5O3 + 2KOH = 2KO3 + 5O2 + H2O
E0 = +2.07 B E0 = +1.24 B
в кислой среде
в щелочной среде
озониды !
Слайд 20Оксиды
Типы бинарных кислородных соединений:
1. Оксиды
О2-
все элементы, кроме Ng и F
2-
2. Пероксиды
О2 О2
только самые активные металлы
О3
только K, Rb, Cs
-
3. Озониды
-
Все металлы образуют оксиды
Слайд 21Типы оксидов:
Оксиды активных металлов
М2О (ЩМ), МО (ЩЗМ), М2О3 (РЗМ)
высокие к.ч., ионная
Оксиды p- и d-элементов в низких с.о. (от +1 до +3, иногда +4)
ковалентные оксиды с полимерными структурами, не реагируют с водой, не растворяются в воде
Оксиды p- и d-элементов в высоких с.о. молекулярные структуры, часто повышенная кратность связи, растворимы в воде с образованием кислот
Оксиды
TiO2
Слайд 22Аллотропия серы, селена и теллура
Сера
циклические структуры от S6 до S12, а
цепи 1S∞
d(S-S) = 205–207 пм
Селен
6 полиморфных модификаций: 3 красные – разные упаковки S8
аморфная – разупорядоченная форма S8
черная (циклы большого размера) серая (стабильная) – цепи 1Se∞
Теллур
только серая (1Te∞)
катенация вместо π связи !
Слайд 24Свойства серы, селена и теллура
S Se Te
Отношение к Н2О
Растворимость в
не растворяются и не
в С6Н6
CS2
не растворяются
Взаимодействие с металлами
Е0(Э0/Э2-), В
реагируют с большинством металлов
-0.48
-0.92
-1.14
Слайд 25Свойства серы, селена и теллура
1. Реакции с галогенами
S + 3F2 =
Se + 2Cl2 = SeCl4 Te + 2I2 = TeI4
(Se, Te) (Br)
(Te)
(но не S, Se)
S2Cl2
Cl
S
Слайд 262. Образование поликатионов и полианионов
S8 + 3AsF5 = [S8 ][AsF6 ]2 +
2+ -
6Te + 6AsF5 = [Te6 ][AsF6 ]4 + 2AsF3
4+ -
4Te + 3H2SO4 (конц) = [Te4 ](HSO4)2 + SO2 + 2H2O
2+
4Se + K2Se = K2[Se5 ]
2-
в ДМФ в ДМФ
7Te + K2Te = K2[Te8 ]
2-
Свойства серы, селена и теллура
Слайд 27Свойства серы, селена и теллура
Горение
S + O2 = SO2 Se +
Окисление
голубое пламя красное пламя голубое пламя
S + HClO3 + H2O = H2SO4 + HCl Te + 2H2O(газ) = TeO2 + 2H2
Te + 3H2O2 = H6TeO6
Se + KBrO3 + 2KOH = K2SeO4 + KBr + H2O
(to)
Слайд 28Диспропорционирование
3Se + 6KOH = K2SeO3 + 2K2Se + 3H2O S +
Восстановление
Cu + S = CuS
S, Se, Te образуют халькогениды
(Te)
(to)
Халькогениды ЩМ и ЩЗМ – ионные соединения, Остальные – ковалентные или металлические
Свойства серы, селена и теллура
Слайд 30Гидриды
H2O
H2S
H2Se
H2Te
Т.пл., оС
Т.кип., оС
0
100
-85.5
-60.3
-65.7
-41.3
-51.0
-4.0
ΔfH0 ,
298
-241.8
-20.2
73.0
99.6
кДж/моль
d(
∠( p p О
св
Н-Э), пм 96 134
Э-Н-Э),о 104.5 92
Ka1 14 7.05
Ka2 ― 14.2
собые р-ритель легк
146 169
91 90
4.0 3.0
11.0 10.7
горит на разл. яется воздухе при 0оС
о
л
0
10 20 30 40 50 60
n
-100
-50
0
50
100
оС
Т.кип
Т.пл
0
10 20 30 40 50 60
n
-200
-100
0
100
кДж/моль
ΔfH0298
Слайд 31H2O
H2S
H2Se
H2Te
-51.0
-4.0
99.6
Т.пл., оС
Т.кип., оС
0 -85.5 -65.7
100 -60.3 -41.3
-241.8 -20.2 73.0
96 134 146
104.5 92 91
14 7.05 4.0
― 14.2 11.0
ΔfH0 ,
298
кДж/моль
d(Н-Э), пм
169
90
3.0
10.7
∠(Э-Н-Э),о
pKa1
pKa2
Гидриды
0
10 20 30 40 50 60
n
100
120
140
160
100
120
140
160
d(H-Э), пм
∠(Э-Н-Э),о
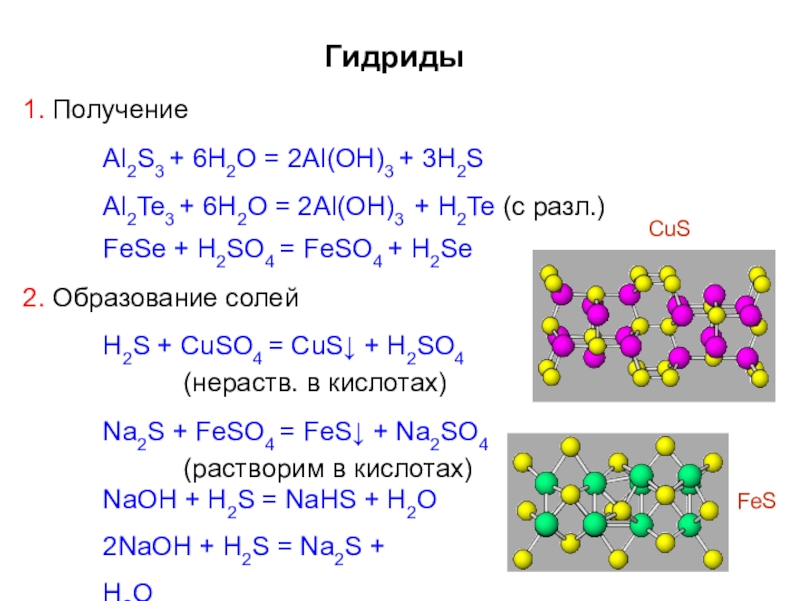
Слайд 33Гидриды
1. Получение
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Al2Te3 + 6H2O =
FeSe + H2SO4 = FeSO4 + H2Se
2. Образование солей
H2S + CuSO4 = CuS↓ + H2SO4
(нераств. в кислотах)
Na2S + FeSO4 = FeS↓ + Na2SO4
(растворим в кислотах)
NaOH + H2S = NaHS + H2O 2NaOH + H2S = Na2S + H2O
FeS
CuS
Слайд 34Гидриды
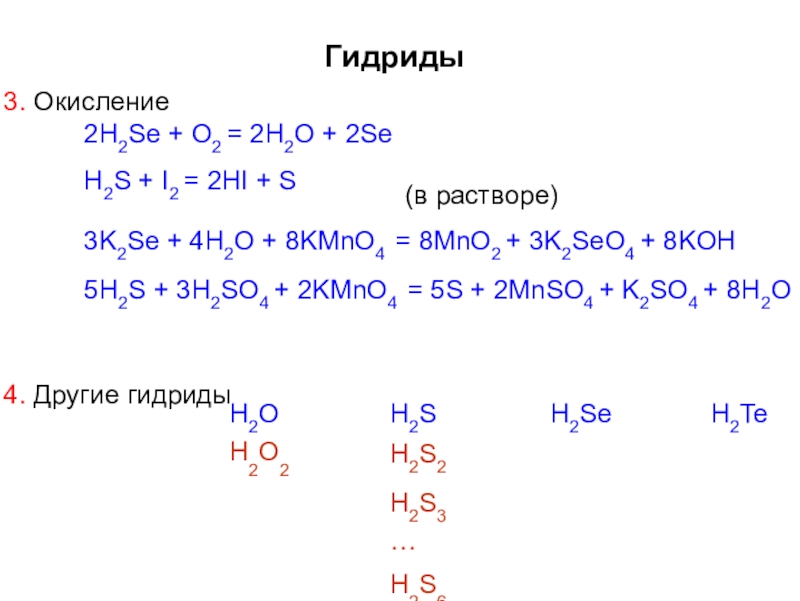
3. Окисление
2H2Se + O2 = 2H2O + 2Se H2S + I2
(в растворе)
3K2Se + 4H2O + 8KMnO4 = 8MnO2 + 3K2SeO4 + 8KOH
5H2S + 3H2SO4 + 2KMnO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
4. Другие гидриды
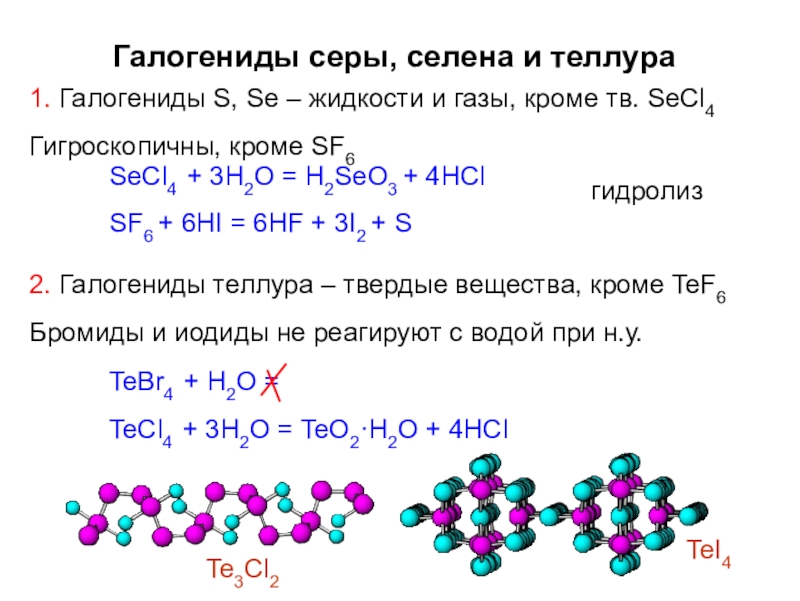
Слайд 36Галогениды серы, селена и теллура
1. Галогениды S, Se – жидкости и
Гигроскопичны, кроме SF6
SeCl4 + 3H2O = H2SeO3 + 4HCl SF6 + 6HI = 6HF + 3I2 + S
гидролиз
2. Галогениды теллура – твердые вещества, кроме TeF6
Бромиды и иодиды не реагируют с водой при н.у.
TeBr4 + H2O =
TeCl4 + 3H2O = TeO2·H2O + 4HCl
Te3Cl2
TeI4
Слайд 37Оксиды серы, селена и теллура
S, Se, Te образуют оксиды ЭО2 и
Также известны S8O, S2O, SO, S2O3, Se2O5
SO2
т.пл. = -75.5 оС т.кип. = -10.0 оС растворим в воде
⇔ H2SO3
SO3
т.пл. = 16.9 оС т.кип. = 44.8 оС реагирует с водой
→ H2SO4
SeO2
т.субл. = 315 оС хорошо растворим
→ H2SeO3
TeO2
т.субл. = 450 оС плохо растворим
→ TeO2·H2O
SeO3
т.пл. = 118.5 оС
TeO3
разлагается в твердой фазе не растворим
реагирует с водой
→ H2SeO4
S O
8
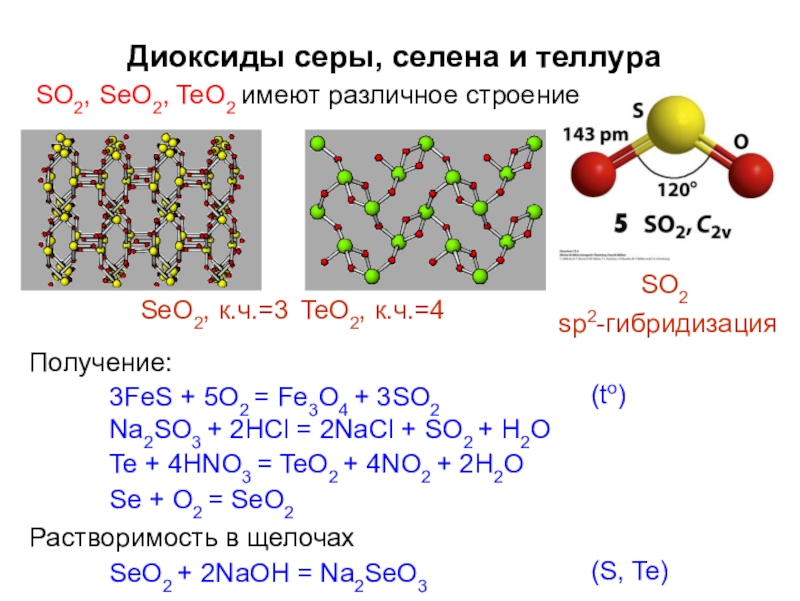
Слайд 38Диоксиды серы, селена и теллура
SO2, SeO2, TeO2 имеют различное строение
SO2
sp2-гибридизация
(to)
(S, Te)
SeO2,
Получение:
3FeS + 5O2 = Fe3O4 + 3SO2
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O Te + 4HNO3 = TeO2 + 4NO2 + 2H2O Se + O2 = SeO2
Растворимость в щелочах
SeO2 + 2NaOH = Na2SeO3
Слайд 39Свойства SO2
1. Получение в промышленности:
S + 1/2O2 = SO2
горение
Растворимость: 40 л
Восстановитель в кислой среде:
SO2 + I2 + 2H2O = 2HI + H2SO4
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4
Восстановитель в щелочной среде:
2K2CrO4 + 3SO2 + 2KOH + 2H2O = 2Cr(OH)3 + 3K2SO4
Слабый окислитель в кислой среде:
SO2 + 4HCl + 4FeCl2 = S + 4FeCl3 + 2H2O
Слайд 40NH3
Cl
Ru
NH3
NH3
8. Лиганд в комплексных соединениях
SO2
NH3
Свойства SO2
6. Растворитель
2SO2 ⇔ SO2+ + SO3
2−
двухзарядные
3AsF5 + 5I2
2I5[AsF6] + AsF3
7. Окислитель в газовой фазе
SO2 + 2CO = 2CO2 + S
(750 K)
SO2 (ж)
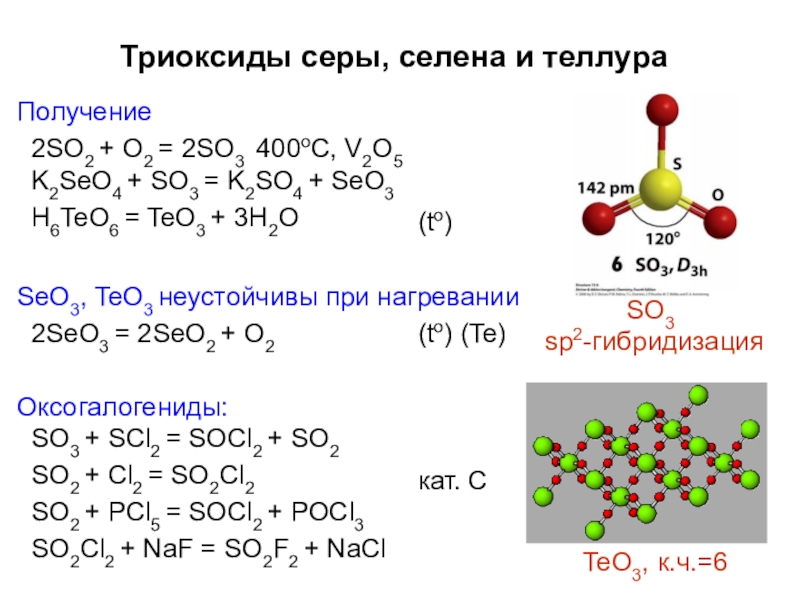
Слайд 41Триоксиды серы, селена и теллура
SO3
sp2-гибридизация
Получение
2SO2 + O2 = 2SO3 400oC, V2O5
K2SeO4 +
(to)
SeO3, TeO3 неустойчивы при нагревании
2SeO3 = 2SeO2 + О2
(to) (Te)
Оксогалогениды:
SO3 + SCl2 = SOCl2 + SO2 SO2 + Cl2 = SO2Cl2
SO2 + PCl5 = SOCl2 + POCl3 SO2Cl2 + NaF = SO2F2 + NaCl
кат. С
TeO3, к.ч.=6
Слайд 43Кислородные кислоты S, Se, Te (IV)
1. Получение
SeO2 + H2O = H2SeO3
(S)
3Te
2. Диссоциация
H2SO3 ⇔ H+ + HSO3
-
(Se, Te)
(Se, Te)
HSO - ⇔ H+ + SO 2- 3 3
3. Red/Ox свойства
H2SeO3 + 2K2SO3 = Se + 2K2SO4 + H2O
Слайд 44Получение и свойства H2SO4
1. Контактный процесс
SO2 + 1/2O2 ⇔ SO3 ΔrH0 = -96
При низких Т мала скорость реакции
При высоких Т равновесие сдвигается влево
Катализатор V2O5/SiO2/K2SO4 V2O5 + SO2 = 2VO2 + SO3 4VO2 + O2 = 2V2O5
Слайд 45Получение и свойства H2SO4
3. Сильная кислота
H2SO4 + H2O ⇔ H3O+ +
−
HSO4 + H2O ⇔ H3O + SO4
− + 2−
2H2SO4 + HNO3 ⇔ NO + + H O+ + 2HSO −
2 3 4
4. Минерализатор
H2SO4 + CaF2 (тв) = CaSO4 + 2HF H2SO4 + CaCO3 = CaSO4 + CO2 + H2O
Слайд 46Получение и свойства H2SO4
4. Окислитель при с > 70%
H2SO4 (р) +
2H2SO4 (к) + Zn = ZnSO4 + SO2 + 2H2O
E(HSO4 /SO2) = 0.16 В
−
5. Образует соли – сульфаты Растворимы в воде, кроме MIISO4 BaCl2 + FeSO4 = FeCl2 + BaSO4↓
K2SO4 т.пл. = 1342 K, т.кип. = 1962 K
CdSO4 = CdO + SO3 Ag2SO4 = Ag + SO2 + O2
≈ 1400 K
≈ 1050 K
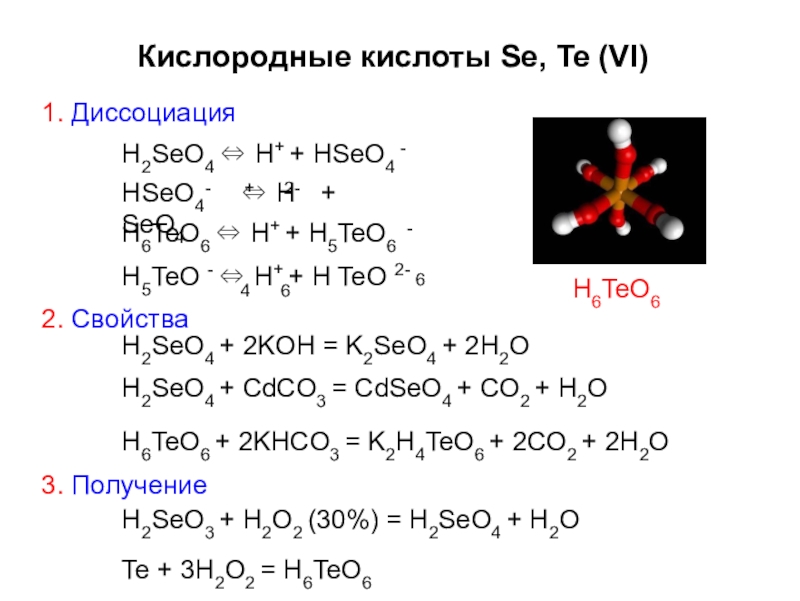
Слайд 481. Диссоциация
H2SeO4 ⇔ H+ + HSeO4
-
HSeO4 ⇔ H + SeO4
- + 2-
H6TeO6 ⇔ H+ +
-
H5TeO - ⇔ H+ + H TeO 2- 6 4 6
2. Свойства
H2SeO4 + 2KOH = K2SeO4 + 2H2O H2SeO4 + CdCO3 = CdSeO4 + CO2 + H2O
H6TeO6 + 2KHCO3 = K2H4TeO6 + 2CO2 + 2H2O
3. Получение
H2SeO3 + H2O2 (30%) = H2SeO4 + H2O Te + 3H2O2 = H6TeO6
Кислородные кислоты Se, Te (VI)
H6TeO6
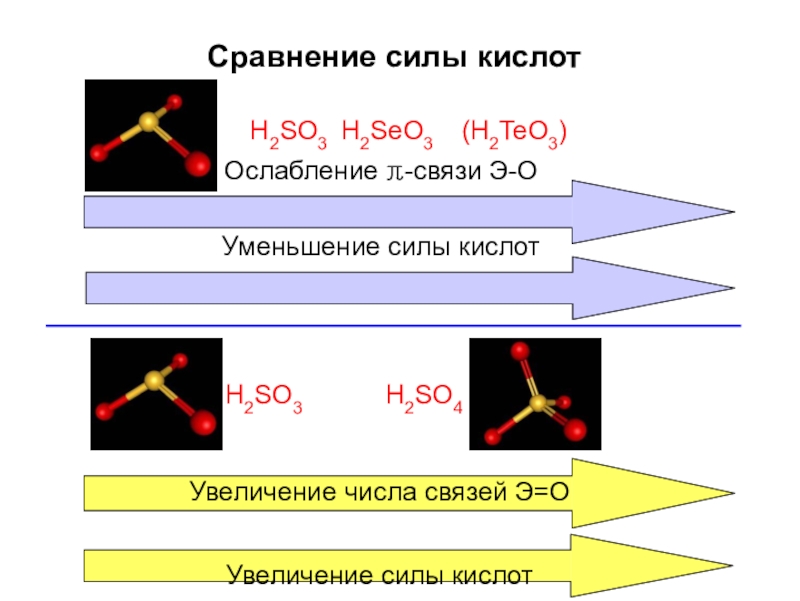
Слайд 49Сравнение силы кислот
H2SO3 H2SeO3 (H2TeO3)
Ослабление π-связи Э-О Уменьшение силы кислот
Увеличение числа связей Э=О
Увеличение
H2SO3
H2SO4
Слайд 50Сравнение силы кислот
H2SO4
H2SeO4
H6TeO6
Ослабление π-связи Э-О
Уменьшение числа связей Э=О Уменьшение силы кислот
Слайд 52Окислительные свойства кислот
H2SO3 H2SeO3 (H2TeO3)
Усиление окислительной способности
H2SO3 не может быть самым сильным окислителем,
H2SO4 H2SeO4 H6TeO6
Усиление окислительной способности
Экранирование – аналогично ряду HClO4 – HBrO4 – H5IO6
H2SeO4 + 6HCl = Se + 3Cl2 + 4H2O H2SeO3 + 2SO2 + H2O = Se + 2H2SO4
Слайд 53Окислительные свойства кислот
H2SO4
HClO4
Повышение с.о. при одинаковом строении
Усиление окислительной способности
H2SO3
HClO3
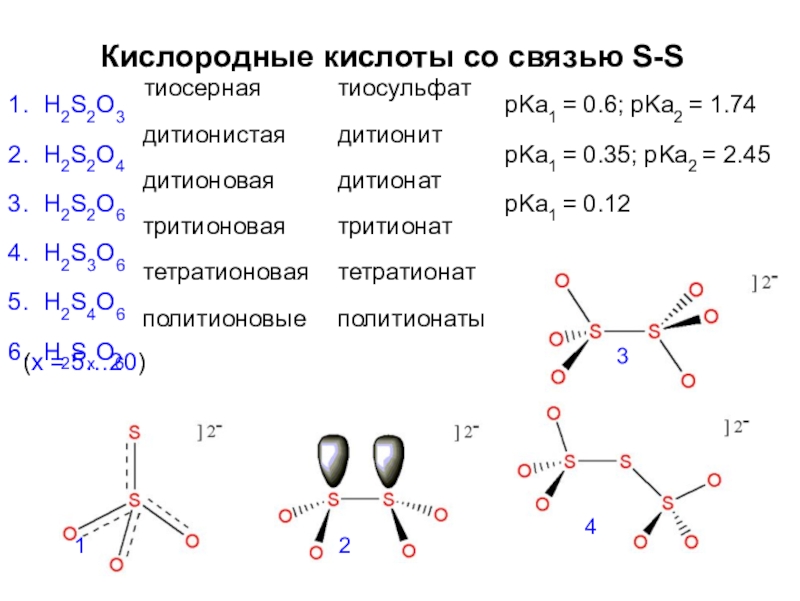
Слайд 54Кислородные кислоты со связью S-S
H2S2O3
H2S2O4
H2S2O6
H2S3O6
H2S4O6
H2SxO6
тиосерная дитионистая дитионовая тритионовая тетратионовая политионовые
тиосульфат дитионит
pKa1 = 0.6; pKa2 = 1.74
pKa1 = 0.35; pKa2 = 2.45
pKa1 = 0.12
(x = 5…20)
1
2
4
3
Слайд 55Получение и свойства тиокислот
1. HSO3Cl + H2S = H2S2O3 + HCl
0oC
4SO2
3Na2S2O3 + AgBr↓ = Na3[Ag(S2O3)3] + NaBr
комплекс
2. Zn + 2SO2 = ZnS2O4
(в водной среде)
BaS2O4 + H2SO4 = BaSO4 + H2S2O4(р-р)
Na2S2O4 + 3Fe2(SO4)3 + 4H2O = 6FeSO4 + Na2SO4 + 4H2SO4
3. MnO2 + SO2 = MnS2O6
BaO2 + SO2 = BaS2O6
BaS2O6 + H2SO4 = BaSO4↓ + H2S2O6 (конц)
нет red/ox свойств
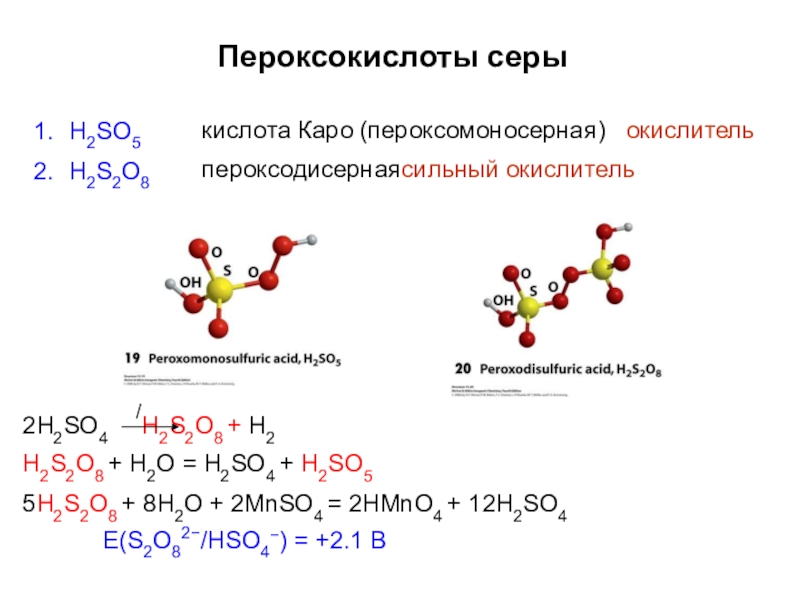
Слайд 56Пероксокислоты серы
H2SO5
H2S2O8
кислота Каро (пероксомоносерная)
окислитель
пероксодисерная сильный окислитель
2H2SO4 H2S2O8 + H2
H2S2O8 + H2O = H2SO4
5H2S2O8 + 8H2O + 2MnSO4 = 2HMnO4 + 12H2SO4
E(S2O82−/HSO4 ) = +2.1 В
−
/
Слайд 57Галогенокислоты серы
SO3 + HF = HSO3F
(Cl)
2HSO3F + SbF5 = [H2SO3F]+ +
2HSO3Cl + H2O2 = H2S2O8 + 2HCl
«волшебная кислота»
SO3Cl−
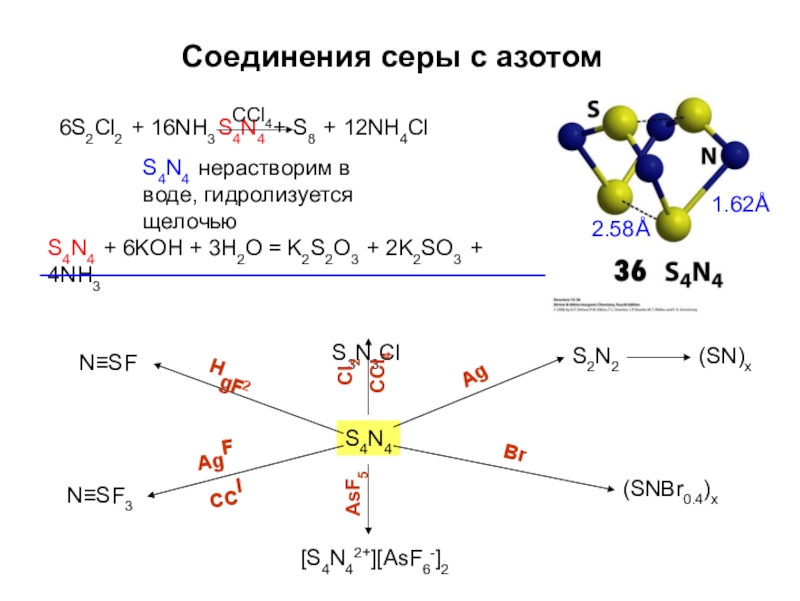
Слайд 58Соединения серы с азотом
6S2Cl2 + 16NH3 S4N4 + S8 + 12NH4Cl
CCl4
S4N4 нерастворим
S4N4 + 6KOH + 3H2O = K2S2O3 + 2K2SO3 + 4NH3
S3N3Cl
1.62Å
2.58Å
S4N4
(SN)x
S2N2
(SNBr0.4)x
N≡SF
[S4N42+][AsF6-]2
N≡SF3
Cl2 CCl4
Ag
AgF
CCl
Br
HgF
2
AsF5
Слайд 59Общие закономерности
Усиливаются «металлические» свойства элементов, уменьшается кислотность оксидов, увеличивается ионность галогенидов;
Все элементы, кроме теллура, полиморфны. Кислород образует молекулы с кратными связями, для других элементов характерна катенация, максимально проявляемая серой.
Кислород – окислитель; для других элементов более типичны восстановительные свойства.
Для кислорода наиболее характерна с.о. -2, другие элементы стабильны в положительных с.о.
Термическая стабильность Н2Э падает вниз по группе, сила соответствующих кислот увеличивается. Особые свойства Н2О определяются наличием прочных водородных связей.
Сила кислородных кислот уменьшается вниз по группе и увеличивается с увеличением числа связей Э=О.
Окислительная способность кислот в с.о. +4 и +6 изменяется по ряду Se>Te≈S.











![Исходная презентация Подгруппа серы для подготовки урока химии на повышенном уровне 2. Образование поликатионов и полианионовS8 + 3AsF5 = [S8 ][AsF6 ]2 + 2. Образование поликатионов и полианионовS8 + 3AsF5 = [S8 ][AsF6 ]2 + AsF3 в жидком SO22+ -6Te + 6AsF5 =](/img/tmb/7/677774/d898de4fa0d753fe41dad114427118d4-800x.jpg)





![Исходная презентация Подгруппа серы для подготовки урока химии на повышенном уровне NH3ClRuNH3NH38. Лиганд в комплексных соединенияхSO2NH3Свойства SO26. Растворитель2SO2 ⇔ SO2+ + SO32−двухзарядные NH3ClRuNH3NH38. Лиганд в комплексных соединенияхSO2NH3Свойства SO26. Растворитель2SO2 ⇔ SO2+ + SO32−двухзарядные ионы!3AsF5 + 5I22I5[AsF6] + AsF37. Окислитель](/img/thumbs/b73d39c26a9d1ecd2159d3cc45b68438-800x.jpg)





![Исходная презентация Подгруппа серы для подготовки урока химии на повышенном уровне Галогенокислоты серыSO3 + HF = HSO3F(Cl)2HSO3F + SbF5 = [H2SO3F]+ + Галогенокислоты серыSO3 + HF = HSO3F(Cl)2HSO3F + SbF5 = [H2SO3F]+ + [F5SbOSO2F]-2HSO3Cl + H2O2 = H2S2O8 +](/img/tmb/7/677774/5bfe6fa8c75bb0d94452b105f01c1abb-800x.jpg)