- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по неорганической химии на тему Окислительно-восстановительные реакции (9 класс)
Содержание
- 1. Презентация по неорганической химии на тему Окислительно-восстановительные реакции (9 класс)
- 2. Горение
- 3. Сгорание топлива
- 4. Получение металлов и сплавов
- 5. Коррозия металлов и сплавов
- 6. БрожениеГниение
- 7. единственно важный первичный источник энергии для всего живогоФотосинтез6CO2 + 6H2O = C6H12O6 + 6O2
- 8. Слайд 8
- 9. I. Определение степени окисленияв бинарной формуле на
- 10. I. Определение степени окисленияв простых веществах степень
- 11. I. Определение степени окисленияв) в формулах из 3-х элементовHNO3,H3PO4,H2SO4,-2+4-2-2+1H2CO3+1-2+1+5+5+6+1Fe2(SO4)3+3-2+6кислотысоли8866IIIвалентность железа
- 12. II. Электронные уравнения-2+6SSв - ся, ок - ль+5+4+3+2+10-1-2-3+6окислениевосстановление
- 13. II. Электронные уравнения+2+4+3-3+2+1NNCCFeFeок - ся, в -
- 14. III. Расстановка коэффициентов методом электронного баланса0-2+3Al +
- 15. NH3 + O2
- 16. Расставьте коэффициенты методом электронного баланса в схеме:
- 17. NH3 + O2
- 18. H2S + O2
Слайд 1Работу выполнила учитель школы № 1226
Григорьева Г. В.
Окислительно - восстановительные
Слайд 7единственно важный первичный источник энергии для всего живого
Фотосинтез
6CO2 + 6H2O =
Слайд 9I. Определение степени окисления
в бинарной формуле на втором месте стоит более
а) в бинарных формулах
NH3,
(искл. NH3, CH4)
Правило:
CuCl2,
SO2,
CS2,
Fe2O3,
SO3,
Fe3N2,
-1
+2
-2
+4
+4
-2
-2
+3
-2
+6
-3
+2
-3
+1
CH4
-4
+1
Слайд 10I. Определение степени окисления
в простых веществах степень окисления (С О) химического
б) в простых веществах
N2,
H2,
S,
O2,
Mg,
Cl2,
Fe,
0
0
C
0
0
0
0
0
0
Слайд 11I. Определение степени окисления
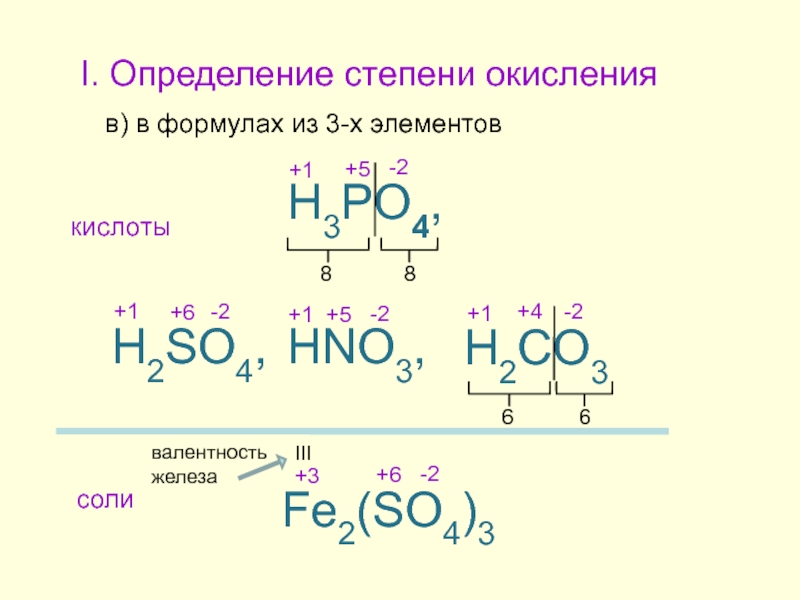
в) в формулах из 3-х элементов
HNO3,
H3PO4,
H2SO4,
-2
+4
-2
-2
+1
H2CO3
+1
-2
+1
+5
+5
+6
+1
Fe2(SO4)3
+3
-2
+6
кислоты
соли
8
8
6
6
III
валентность железа
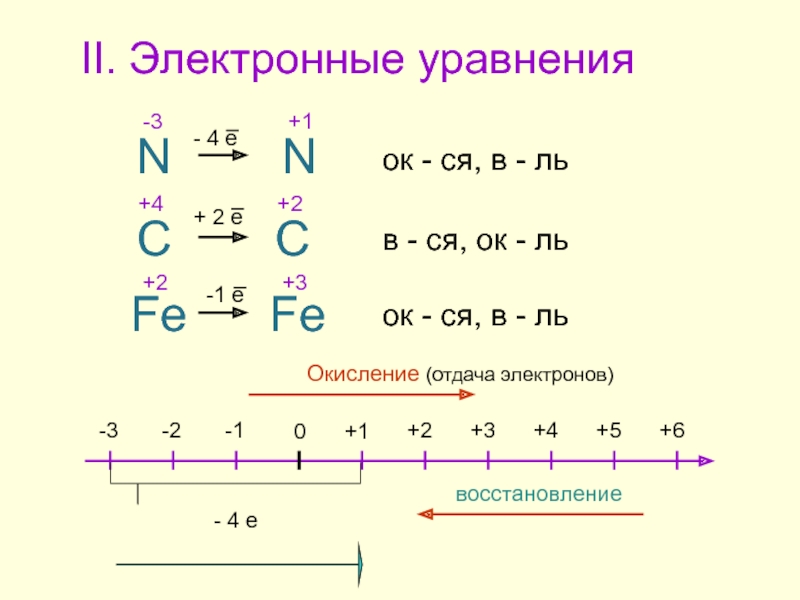
Слайд 13II. Электронные уравнения
+2
+4
+3
-3
+2
+1
N
N
C
C
Fe
Fe
ок - ся, в - ль
ок - ся, в
в - ся, ок - ль
+5
+4
+3
+2
+1
0
-1
-2
-3
+6
Окисление (отдача электронов)
восстановление
- 4 е
Слайд 14III. Расстановка коэффициентов методом
электронного баланса
0
-2
+3
Al + O2
2O
2O
ок - ся,
в - ся, ок - ль
+5
+4
+3
+2
+1
0
-1
-2
-3
Al2O3
0
Al
Al
0
+3
н о к
коэф.
12
4
3
окисление
-2
0
4
2
3
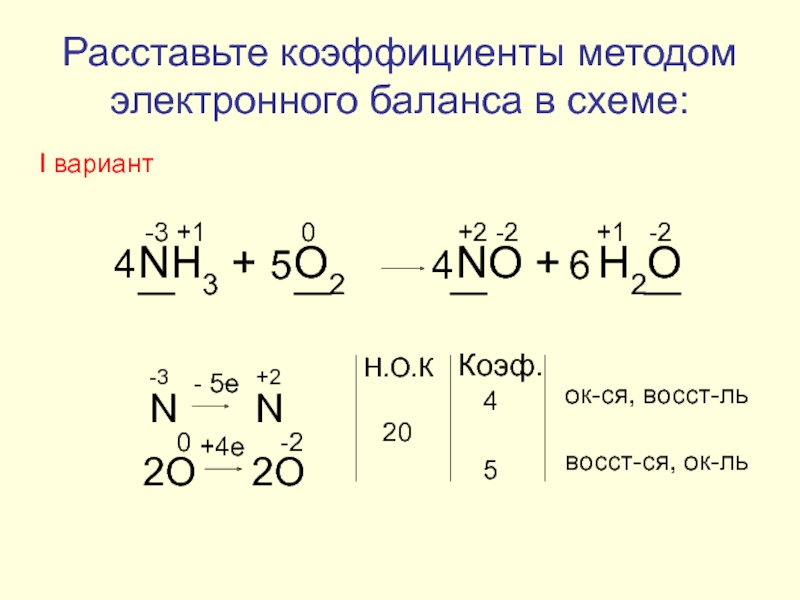
Слайд 15
NH3 + O2
-3
+1
0
+2
-2
+1
-2
N N
-3
+2
- 5e
2O 2O
+4e
Н.О.К
20
Коэф.
4
5
ок-ся, восст-ль
восст-ся, ок-ль
0
-2
4
6
5
4
Расставьте коэффициенты методом электронного баланса в схеме:
I вариант
Слайд 16Расставьте коэффициенты методом электронного баланса в схеме:
H2S +
+1
-2
0
+4
-2
+1
-2
S S
-2
+4
- 6e
2O 2O
+4e
Н.О.К
12
Коэф.
2
3
ок-ся, восст-ль
восст-ся, ок-ль
0
-2
2
2
3
2
II вариант
Слайд 17
NH3 + O2 N2
-3
+1
0
0
+1
-2
2N 2N
-3
0
- 6e
2O 2O
+4e
Н.О.К
12
Коэф.
2
3
ок-ся, восст-ль
восст-ся, ок-ль
0
-2
4
6
3
2
Расставьте коэффициенты методом электронного баланса в схеме:
III вариант
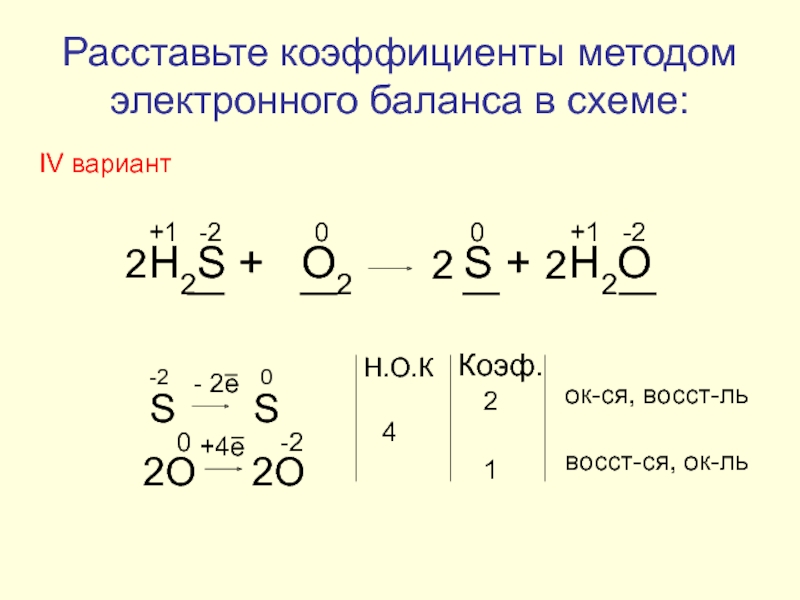
Слайд 18
H2S + O2 S +
+1
-2
0
0
+1
-2
S S
-2
0
- 2e
2O 2O
+4e
Н.О.К
4
Коэф.
2
1
ок-ся, восст-ль
восст-ся, ок-ль
0
-2
2
2
2
Расставьте коэффициенты методом электронного баланса в схеме:
IV вариант