- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Теория электролитической диссоциации
Содержание
- 1. Презентация по химии на тему Теория электролитической диссоциации
- 2. Задачи урокаУзнать, что такое электролиты.Понять, почему некоторые
- 3. Что мы уже знаемМногие вещества растворимы в
- 4. Проверим, как проводят электрический ток некоторые вещества и их растворы.
- 5. Электролиты - вещества, которые в растворе
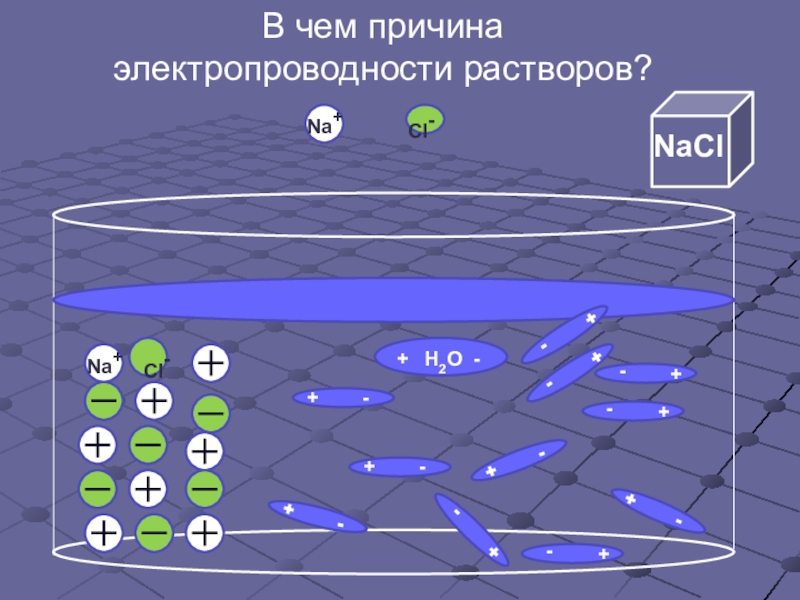
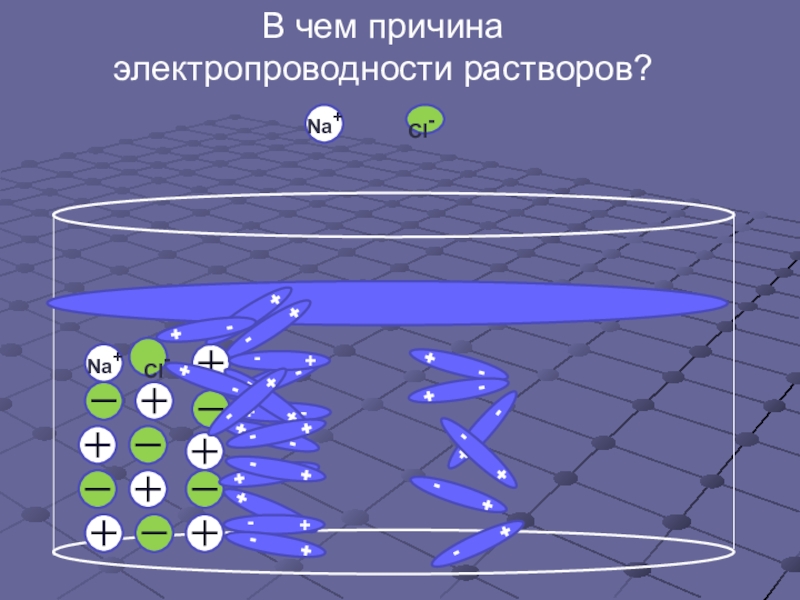
- 6. В чем причина электропроводности растворов?Cl-
- 7. В чем причина электропроводности растворов?Cl-
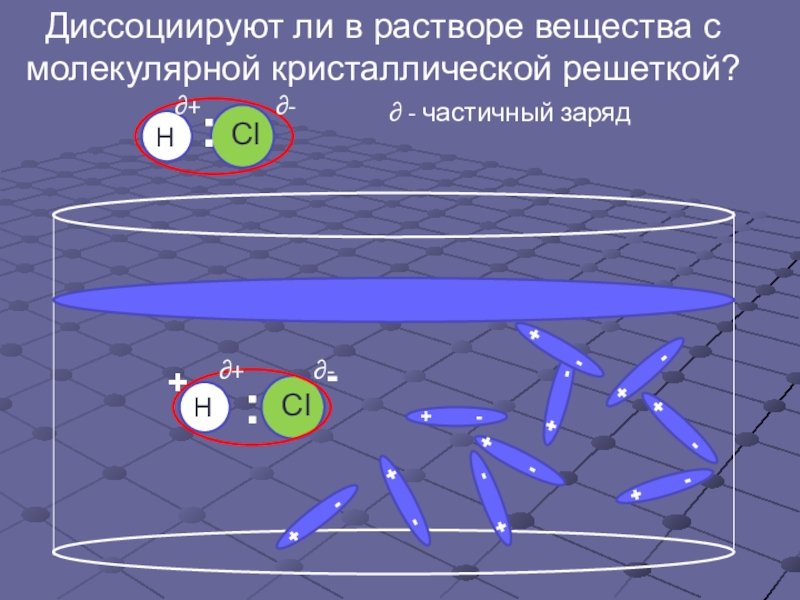
- 8. Диссоциируют ли в растворе вещества с молекулярной кристаллической решеткой?::∂+∂-∂ - частичный заряд∂-∂++-
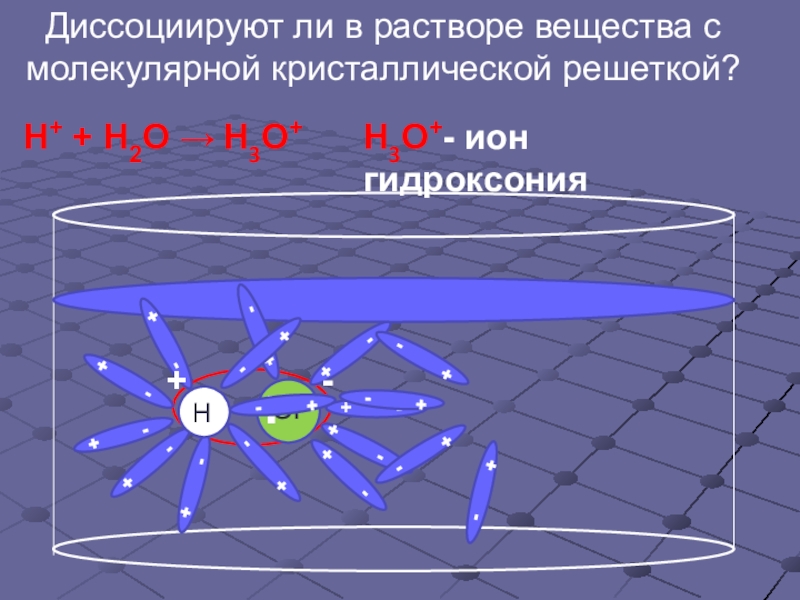
- 9. Диссоциируют ли в растворе вещества с молекулярной кристаллической решеткой?Н+ + Н2О → Н3О+Н3О+- ион гидроксония
- 10. Диссоциируют ли в растворе вещества с
- 11. Диссоциируют ли в растворе вещества с
- 12. ••ВыводыВ водном растворе могут диссоциировать вещества, в
- 13. Выводы3. Ион может состоять как из одного
- 14. Как классифицируют сильные электролиты по виду ионов,
- 15. От чего зависит сила кислоты?Свойства кислот определяются
- 16. От чего зависит сила кислоты?H2SO3 → ?H2SO4
- 17. Напишем уравнения диссоциации; определим класс, к которому
- 18. Что характерно для сильных электролитов?Сильные электролиты диссоциируют
- 19. Как диссоциируют электролиты средней силы, например, многоосновные
- 20. Как диссоциируют кислые соли? Дигидрофосфат калия
- 21. •Выводы 1.В зависимости от образующихся ионов
- 22. Домашнее задание: Задачник Кузнецовой, Левкина; cтр.16,
Слайд 2Задачи урока
Узнать, что такое электролиты.
Понять, почему некоторые растворы проводят электрический ток.
Научиться
Познакомиться с понятием степень диссоциации.
Попрактиковаться в применении таблицы растворимости.
Слайд 3Что мы уже знаем
Многие вещества растворимы в воде, т. е. образуют
3. Вещество можно выделить из его раствора выпариванием.
Это указывает на физическую природу растворения (Аррениус).
4.Растворение веществ сопровождается выделением или поглощением тепла. Это указывает на химическую природу растворения (Менделеев).
2. Истинные растворы – однородные системы
переменного состава, содержащие частицы
растворенного вещества, частицы растворителя и
продукты взаимодействия этих частиц.
5. Современная теория растворов рассматривает растворение как физико-химический процесс.
Слайд 5 Электролиты - вещества, которые в растворе или
расплаве проводят электрический
или расплава электролит не проводит электрический
ток!
Неэлектролиты - вещества, которые в растворе или
расплаве не проводят электрический ток.
Что мы узнали из опыта?
Электролиты по электропроводности своих растворов делят на сильные и слабые.
Слайд 8Диссоциируют ли в растворе вещества с
молекулярной кристаллической решеткой?
:
:
∂+
∂-
∂ - частичный
∂-
∂+
+
-
Слайд 9Диссоциируют ли в растворе вещества с
молекулярной кристаллической решеткой?
Н+ + Н2О
Н3О+- ион гидроксония
Слайд 10Диссоциируют ли в растворе вещества с
молекулярной кристаллической решеткой?
Химическая связь между
К этим зарядам притягиваются противоположными зарядами диполи воды, чем еще более поляризуют электронную плотность молекулы.
Слайд 11Диссоциируют ли в растворе вещества с
молекулярной кристаллической решеткой?
3. Сильно поляризованная
Н3О+- ион гидроксония
Н+ + Н2О → Н3О+
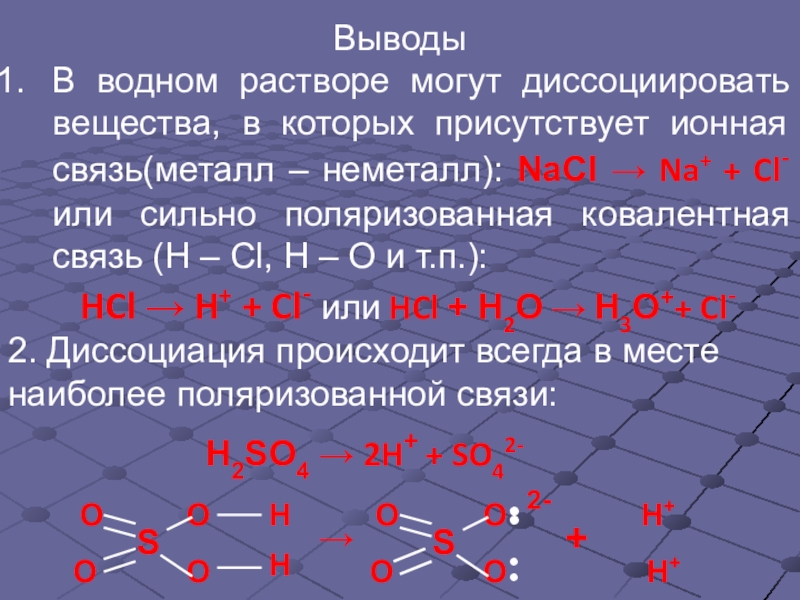
Слайд 12•
•
Выводы
В водном растворе могут диссоциировать вещества, в которых присутствует ионная связь(металл
HCl → H+ + Cl- или HCl + Н2О → Н3О++ Cl-
2. Диссоциация происходит всегда в месте наиболее поляризованной связи:
H2SO4 → 2H+ + SO42-
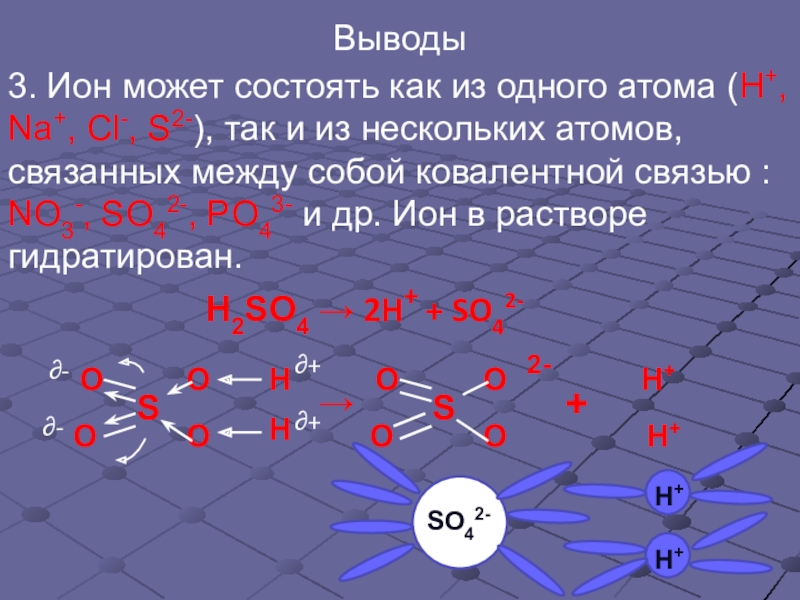
Слайд 13Выводы
3. Ион может состоять как из одного атома (Н+, Na+, Сl-,
NO3-, SO42-, PO43- и др. Ион в растворе гидратирован.
H2SO4 → 2H+ + SO42-
∂+
∂+
∂-
∂-
SO42-
H+
H+
Слайд 14Как классифицируют сильные электролиты по виду ионов, на которые они диссоциируют?
Электролиты,
анионов образуются только гидроксид-анионы ОН-, -
основания (или щелочи).
Ва(ОН)2 → Ва 2+ + 2ОН-
Электролиты, при диссоциации которых в качестве
катионов образуются только катионы водорода Н+,
- кислоты. Анион называют кислотным остатком.
HNO3 → 2H+ + NO3-
Электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка, - средние соли.
Ва(NО3)2 → Ва 2+ + 2NО3-
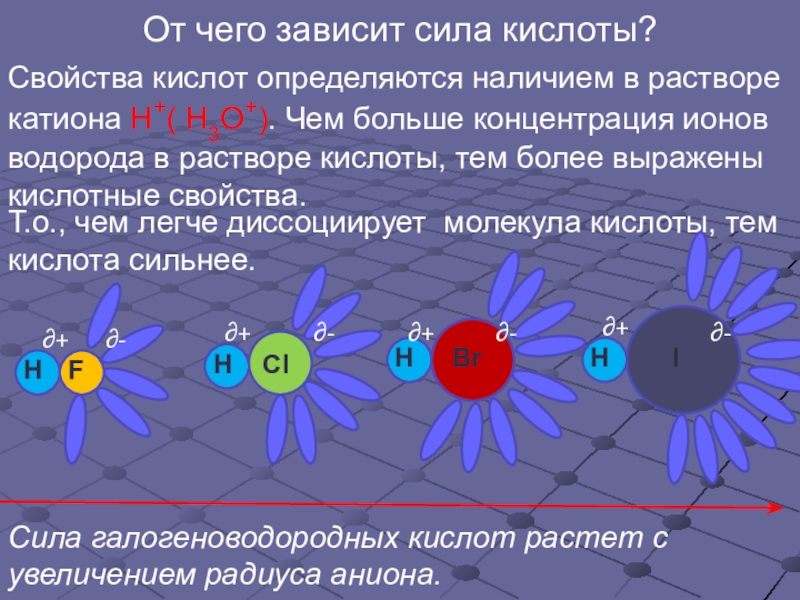
Слайд 15От чего зависит сила кислоты?
Свойства кислот определяются наличием в растворе катиона
Сила галогеноводородных кислот растет с увеличением радиуса аниона.
Т.о., чем легче диссоциирует молекула кислоты, тем кислота сильнее.
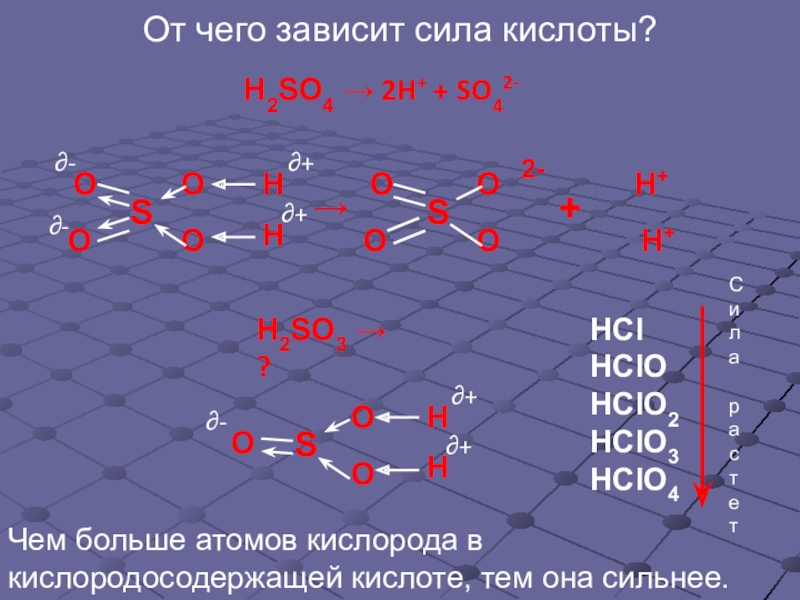
Слайд 16От чего зависит сила кислоты?
H2SO3 → ?
H2SO4 → 2H+ + SO42-
Чем
НСl
HClO
HClO2
HClO3
HClO4
C
и
л
а
р
а
с
т
е
т
Слайд 17Напишем уравнения диссоциации; определим класс, к которому принадлежит электролит.
йодоводородная кислота
НI
→ Н+
йодид магния
MgI2
→ Mg2+ +2I-
гидроксид стронция
Sr(OH)2
→ Sr2+ +2OH-
сульфат стронция
SrSO4
→ Sr2+ +SO42-
карбонат калия
К2СO3
→ 2К+ + СO32-
cульфат железа (III)
Fe2(SO4)3
→ 2Fe3+ + 3SO42-
Слайд 18Что характерно для сильных электролитов?
Сильные электролиты диссоциируют полностью.
Раствор сильного электролита –
Сильными электролитами являются все растворимые
соли и основания(см. ТР), а также сильные кислоты:
HCl, HBr, HI, HNO3, H2SO4, HClO4 и др.
Сила электролита характеризуется степенью электролитической диссоциации (α). α – это отношение количества вещества электролита, распавшегося на ионы (nрасп), к количеству вещества растворенного электролита (nобщ).
α = nрасп/nобщ
α сильного электролита = 1
Слайд 19Как диссоциируют электролиты средней силы, например, многоосновные кислоты?
Многоосновные кислоты диссоциируют ступенчато:
H3РO4 → H+ + H2РO4-
Суммарное уравнение:
H3РO4 → 3H+ + РO43-
H2РO4- → H+ + HРO42-
HРO42-→ H+ + РO43-
Степень диссоциации каждой последующей ступени меньше предыдущей. Многоосновные кислоты способны образовывать кислые соли.
Слайд 20Как диссоциируют кислые соли?
Дигидрофосфат калия
Кислую соль можно рассматривать как производное многоосновной кислоты, у которой не все атомы водорода замещены на атомы металла или другие катионы.
К3РO4 → 3К+ + РO43-
Гидрофосфат калия К2НРO4 → 2К+ + HРO42-
Средняя соль фосфат калия:
Слайд 21•
Выводы
1.В зависимости от образующихся ионов электролиты классифицируют на основания,
2. Сила электролита характеризуется степенью электролитической диссоциации.
3. Щелочи, растворимые соли, серная, соляная, азотная и хлорная кислоты – сильные электролиты.
Слайд 22Домашнее задание: Задачник Кузнецовой, Левкина; cтр.16, №2-2(а,б), cтр.17, №2-3(а-в), 2-10 (кроме
2-2. Напишите уравнения диссоциации следующих веществ:
нитрата калия, карбоната калия, хлорида магния, гидроксида бария, иодоводородной кислоты;
сульфата магния, бромоводородной кислоты, хлорида кальция, гидроксида калия, сульфата алюминия.
2-3. Подберите по три примера веществ, при диссоциации которых в растворе будет присутствовать ион:
а)OH-, б)SO42-, в) NO3-,г) PO43-
2-10. Из данного перечня выберите сильные электролиты: ортофосфорная кислота, фосфат натрия, нитрат серебра, серная кислота, хлорная кислота, иодоводородная кислота.