- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Щелочные металлы
Содержание
- 1. Презентация по химии на тему Щелочные металлы
- 2. ОпределениеЩелочные металлы – это элементы 1-й группы периодической таблицы химических элементов. В группу входят:ЛИТИЙНАТРИЙКАЛИЙРУБИДИЙЦЕЗИЙФРАНЦИЙ
- 3. Общая характеристикаВ Периодической системе щелочные металлы следуют
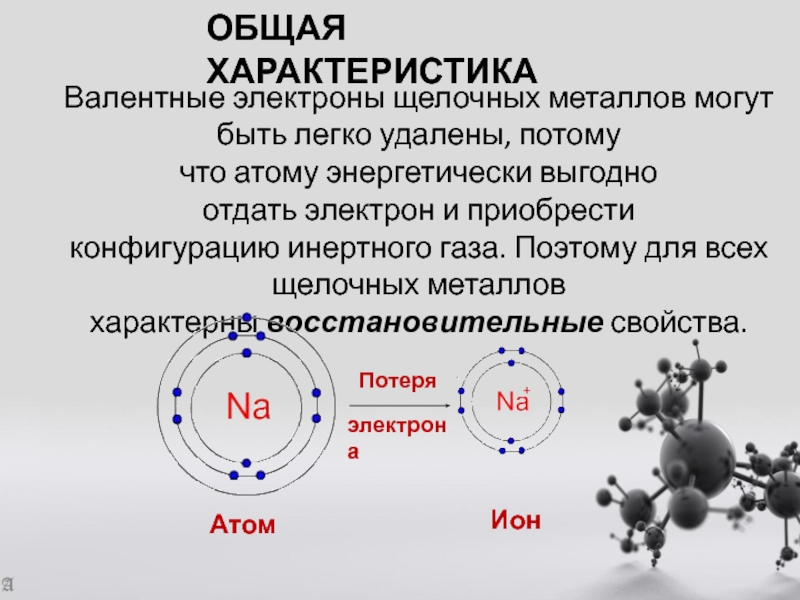
- 4. Общая характеристикаВалентные электроны щелочных металлов могут быть легко удалены, потому
- 5. Физические свойстваЦвет: серебристо-белый (цезий – золотисто-желтый).Кристаллическая решетка:
- 6. Химические свойстваВзаимодействие с водой: взрывоопасны!Без взрыва реагирует
- 7. Химические свойства3. Взаимодействие с неметаллами: с галогенами
- 8. Химические свойства4. Взаимодействие с кислотами: щелочные металлы
- 9. 5. Взаимодействие с аммиаком: реагируют с аммиаком
- 10. Химические свойства7. Качественное определение щелочных металлов: при
- 11. получениеВсе щелочные металлы встречаются в природе исключительно
- 12. ПрименениеЩелочные металлы и их соединения используются в разных сферах деятельности человека.двигателиПроизводство стеклаПроизводство бензинареакторыМылоБумага
- 13. Щелочные металлы?
- 14. ЛитийПорядковый номерОбозначениеАтомная массаЛатинское названиеОткрыт в 1817 годуПРИМЕНЕНИЕ
- 15. НатрийПорядковый номерОбозначениеАтомная массаЛатинское названиеОткрыт в 1807 годуПРИМЕНЕНИЕ
- 16. КалийПорядковый номерОбозначениеАтомная массаЛатинское названиеПРИМЕНЕНИЕОткрыт в 1807 году
- 17. РубидийПорядковый номерОбозначениеАтомная массаЛатинское названиеОткрыт в 1861 годуПРИМЕНЕНИЕ
- 18. ЦезийПорядковый номерОбозначениеАтомная массаЛатинское названиеОткрыт в 1860 годуПРИМЕНЕНИЕ
- 19. ФранцийПРИМЕНЕНИЕПорядковый номерОбозначениеАтомная массаЛатинское названиеОткрыт в 1939 годуНа
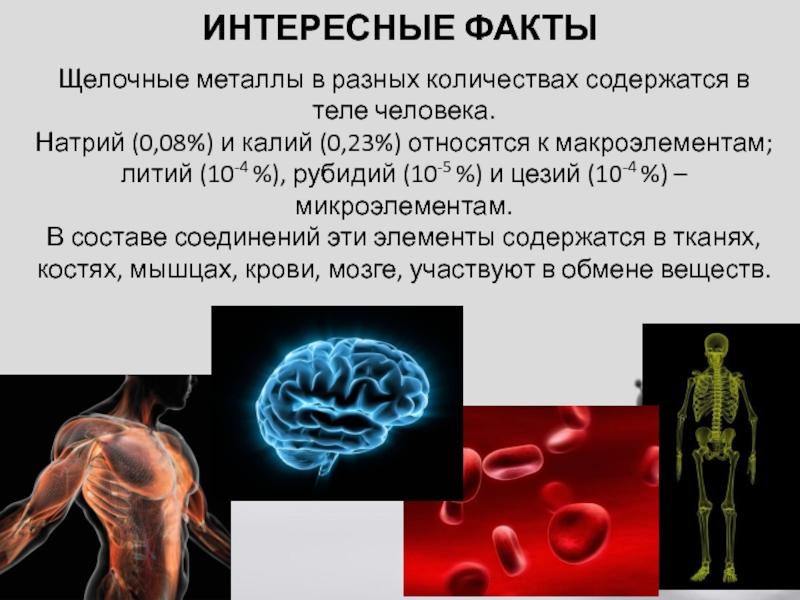
- 20. Интересные фактыЩелочные металлы в разных количествах содержатся
Слайд 2Определение
Щелочные металлы – это элементы 1-й группы периодической таблицы химических элементов.
В группу входят:
ЛИТИЙ
НАТРИЙ
КАЛИЙ
РУБИДИЙ
ЦЕЗИЙ
ФРАНЦИЙ
Слайд 3Общая характеристика
В Периодической системе щелочные металлы следуют за инертными газами, поэтому
Слайд 4Общая характеристика
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести
Атом
Ион
Потеря
электрона
Слайд 5Физические свойства
Цвет: серебристо-белый (цезий – золотисто-желтый).
Кристаллическая решетка: с металлическим типом связи.
Плотность:
to плавления и кипения: низкая.
Тепло- и электропроводность: высокая.
Слайд 6Химические свойства
Взаимодействие с водой:
взрывоопасны!
Без взрыва реагирует только литий.
Общая формула:
2. Взаимодействие с кислородом:
литий сгорает с образованием оксида 4Li + O2 = 2Li2O;
натрий образует пероксид 2Na + O2 = Na2O2;
калий, рубидий и цезий горят с
образованием надпероксида K + O2 = KO2.
Слайд 7Химические свойства
3. Взаимодействие с неметаллами:
с галогенами щелочные металлы образуют галогениды
с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании:
2Na + H2 = 2NaH – гидрид,
2K + S = K2S – сульфид,
3K + P = K3P – фосфид,
4Cs + Si = Cs4Si – силицид,
2Li + 2C = Li2C2 – карбид (калий, рубидий
и цезий карбиды не образуют),
с азотом реагирует только литий при
комнатной to 6Li + N2 = 2Li3N - нитрид.
Слайд 8Химические свойства
4. Взаимодействие с кислотами:
щелочные металлы способны реагировать с разбавленными
Взаимодействие щелочных металлов с кислотами практически всегда
сопровождается взрывом,
и такие реакции на
практике не проводятся.
Слайд 95. Взаимодействие с аммиаком:
реагируют с аммиаком с образованием амида:
2Li
6. Восстановление металлов из оксидов и солей: менее активные металлы могут быть получены восстановлением щелочными металлами:
3Na + AlCl3 = Al + 3NaCl.
Химические свойства
Слайд 10Химические свойства
7. Качественное определение щелочных металлов: при нагревании металла или его
ЛИТИЙ
НАТРИЙ
КАЛИЙ
РУБИДИЙ
ЦЕЗИЙ
Слайд 11получение
Все щелочные металлы встречаются в природе исключительно в виде соединений, их
Литий получают электролизом расплава хлорида лития:
2LiCl 2Li + Cl2;
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl 2Na + Cl2,
прокаливая соду с углем в закрытых тиглях:
Na2CO3 + 2C = 2Na + 3CO;
Калий получают, пропуская пары натрия через
расплав хлорида калия при 800°С:
KCl + Na = K + NaCl;
Рубидий и цезий получают восстановлением их
хлоридов кальцием при 700–800 °С:
2RbCl + Ca = 2Rb + CaCl2.
Слайд 12Применение
Щелочные металлы и их соединения используются в разных сферах деятельности человека.
двигатели
Производство
Производство бензина
реакторы
Мыло
Бумага
Слайд 15Натрий
Порядковый номер
Обозначение
Атомная масса
Латинское название
Открыт в 1807 году
ПРИМЕНЕНИЕ
Слайд 17Рубидий
Порядковый номер
Обозначение
Атомная масса
Латинское название
Открыт в 1861 году
ПРИМЕНЕНИЕ
Слайд 19Франций
ПРИМЕНЕНИЕ
Порядковый номер
Обозначение
Атомная масса
Латинское название
Открыт в 1939 году
На данный момент франций не
полураспада и высокой радиоактивности.
Является одним из редчайших элементов.
Многие свойства металла являются
теоретическими, одно из них –
стремление растворить самого себя.
Слайд 20Интересные факты
Щелочные металлы в разных количествах содержатся в теле человека.
Натрий (0,08%)
литий (10-4 %), рубидий (10-5 %) и цезий (10-4 %) – микроэлементам.
В составе соединений эти элементы содержатся в тканях, костях, мышцах, крови, мозге, участвуют в обмене веществ.