- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Подгруппа углерода 9 класс
Содержание
- 1. Презентация по химии на тему: Подгруппа углерода 9 класс
- 2. Цель урока: обобщение и систематизация знаний по
- 3. Задачи:образовательные: повторить строение атомов углерода и кремния,
- 4. 20 декабря 2017 года в ходе своей
- 5. Квест в реальности – это командная игра,
- 6. Точки
- 7. Точка №1 (строение)Заполнить таблицу (общая характеристика подгруппы
- 8. Ответы точки №1C - углерод Si –
- 9. Точка №2 (нахождение в природе)Дать краткую характеристику
- 10. Ответы точки №2Нахождение углерода в природеСсвободный углерод
- 11. Слайд 11
- 12. Точка №3 (получение)Закончить предложенные реакции получения соединений
- 13. Ответы точки №32CO + O2 = 2CO2CH4 = C
- 14. Точка №4 (химические свойства)№1 (одно очко)Отравление лорда.Один
- 15. Точка №4 (химические свойства)2. Докончить предложенные уравнения
- 16. Ответы точки №4Это угарный газ (СО) –
- 17. Ответы точки №4Na2CO3 + 2HCl = 2NaCl +
- 18. Точка №5 (применение)Из предложенных предметов выберите те,
- 19. Ответы точки №5
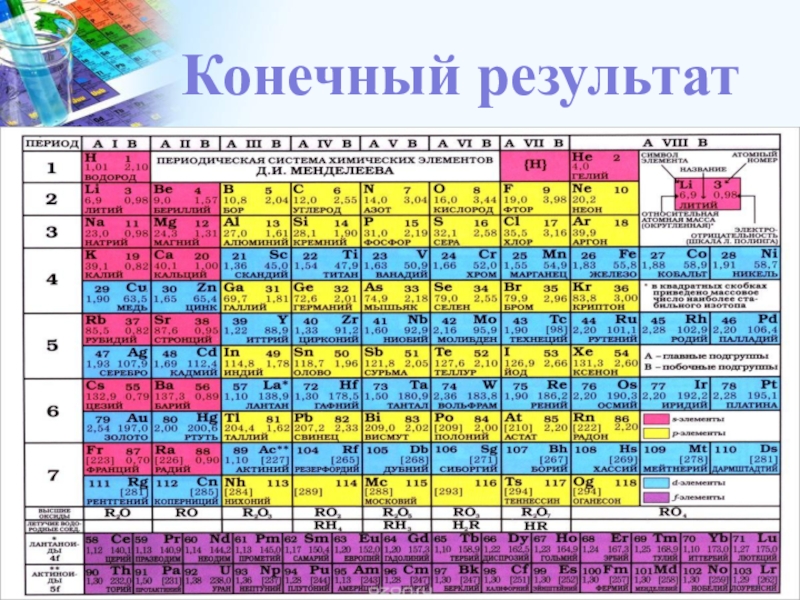
- 20. www.PresentationPro.comКонечный результат
- 21. www.PresentationPro.comРефлексия Х – харизматичная И – интересная
Слайд 1Обобщающий урок по теме:
«Подгруппа углерода» в 9 классе
Хамукова Марина Алиевна
2018-2019
Слайд 2Цель урока: обобщение и систематизация знаний по теме “Подгруппа углерода”, формирование
Слайд 3Задачи:
образовательные: повторить строение атомов углерода и кремния, строение простых веществ, образованных
воспитательные: формировать научное мировоззрение учащихся, а также идей о материальности мира, причинно-следственных связей явлений; воспитание культуры общения;
развивающие: развитие познавательного интереса школьников, совершенствование умений анализировать и сравнивать, участвовать в проблемном диалоге.
20 декабря 2017 года в ходе своей 72-й сессии Генеральная ассамблея ООН провозгласила 2019 год Международным годом Периодической таблицы химических элементов. Ранее эта инициатива была выдвинута Российской Федерацией в рамках ЮНЕСКО и была одобрена на 39-й сессии Генеральной конференции Организации.
Слайд 420 декабря 2017 года в ходе своей 72-й сессии Генеральная ассамблея
Оборудование: лабораторные штативы, химические стаканы, модели кристаллических решёток, минералы, цветная бумага, клей.
Реактивы: карбонат кальция, соляная кислота, гидрокарбонат натрия, силикат натрия, фенолфталеин.
Тип урока: игровой урок (квест)
Слайд 5Квест в реальности – это командная игра, суть которой заключается в
Слайд 6Точки
команда, получившая больше очков зарабатывает пазл.
Строение
Нахождение в природе
Получение
Химические свойства
Применение
Слайд 7Точка №1 (строение)
Заполнить таблицу (общая характеристика подгруппы углерода), одно очко.
Собрать кристаллическую
С помощью предложенных карточек расположите химические элементы подгруппы углерода в нужном порядке, по ПСХЭ, одно очко.
Команда, у которой набирается больше очков получает один пазл.
Слайд 9Точка №2
(нахождение в природе)
Дать краткую характеристику нахождения углерода и кремния
Установить соответствие меду картинками минералов соединений кремния и их названиями, одно очко.
«Лучший геолог» (найти спрятанный минерал), одно очко.
Команда, у которой набирается больше очков получает один пазл.
Слайд 10Ответы точки №2
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза
Нахождение кремния в природе.
В свободном виде кремний в природе не встречается. Чаще всего в природе кремний встречается в виде кремнезёма- соединений на основе оксида кремния. Основные минералы образуемые диоксидом кремния – это песок (речной и кварцевый), кварц, кварциты, кремень и т.д.
Слайд 12Точка №3 (получение)
Закончить предложенные реакции получения соединений углерода и кремния, одно
С помощью предложенных реактивов получить углекислый газ и кремниевую кислоту, одно очко.
Команда, у которой набирается больше очков получает один пазл.
Слайд 14Точка №4
(химические свойства)
№1 (одно очко)
Отравление лорда.
Один богатый лорд, проживающий в
Вопрос1. Назовите имя убийцы и объясните, как он оказался в камине?
Вопрос 2. Почему убийца очень безжалостен к людям?
Слайд 15Точка №4
(химические свойства)
2. Докончить предложенные уравнения реакций, характеризующих некоторые химические
3. «Расколдуйте цветы», из представленных реактивов нужно выбрать тот, который поможет осуществить данное действие, одно очко.
4. С помощью предложенных карточек , по одной из которых должны оказаться в руках у участников, нужно правильно выстроить химическое уравнение, одно очко.
Команда, у которой набирается больше очков получает один пазл.
Слайд 16Ответы точки №4
Это угарный газ (СО) – сильнейший яд. Образуется при
В случае отравления угарным газом вместо оксигемоглобина образуется карбоксигемоглобин, который не способен выполнять функцию переноса кислорода к тканям и органам. Наступает кислородное голодание (гипоксия).
Слайд 17Ответы точки №4
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
SiO2 + 2NaOH
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
2 HCl + Na2SiO3 =2 NaCl + H2SiO3
Ca(OH)2 + CO2 = CaCO3(белый осадок) + H2O
№3. Фенолфталеиновый в щелочах малиновый.
Слайд 18Точка №5 (применение)
Из предложенных предметов выберите те, которые содержат углерод и
Одним из типичных продуктов силикатной промышленности является кирпич, с помощью специальных заготовок и клея выложите «кирпичную» стену, одно очко.
Команда, у которой набирается больше очков получает один пазл.
Слайд 21www.PresentationPro.com
Рефлексия
Х – харизматичная
И – интересная
М – многогранная
И
Я – яркая