- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Классификация химических реакций (9 класс)
Содержание
- 1. Презентация по химии на тему Классификация химических реакций (9 класс)
- 2. Люблю грозу в начале мая,Когда вечерний первый
- 3. Горе тебе, гроза – атаман,Ты свой произнес приговор,Средь пожаров ограбленных странТы забудешь пламенный взор!(М.Лермонтов «Атаман»)
- 4. Мой костер в тумане светит:Искры гаснут на лету:(Я. Полянский «Песни цыганки»)
- 5. Туча по небу идет,Бочка по морю плывет.(А.Пушкин «Сказка о царе Салтане»)
- 6. Тогда услышал я (о, диво)Запах скверный,Как будто
- 7. Дайте мне дворец высокий,И крутой зеленый сад.Чтоб в тени его широкойЗрел янтарный виноград.(М.Лермонтов «Желанье»)
- 8. Пламя рдеет, пламя пышет,Искры брызжут и летят,А
- 9. Полдневный час.Жара гнетет дыханье;Глядишь прищурясь, - блеск
- 10. Вопрос: Что называют
- 11. Вопрос: Какие признаки химических реакций вы
- 12. Вопрос:А каковы же условия возникновения и течения
- 13. Классификация химических реакций в неорганической и органической химии
- 14. Цель: Повторить и
- 15. Задачи:
- 16. 1 признак химической реакции: Число и состав
- 17. Определить какое вещество пропущено, уровнять химическую реакцию,
- 18. 2 признак химической реакции: Изменение степени окисления.
- 19. Уровнять предложенную реакцию с помощью электронного баланса
- 20. 3 признак химической реакции: Тепловой эффект.1) Тепловой
- 21. Определить, какая из предложенных реакций является экзотермической
- 22. 4 признак химической реакции: Агрегатное состояние
- 23. Определить тип химической реакции по агрегатному состоянию
- 24. 5 признак химической реакции: Введение других веществ.
- 25. Определить среди предложенных реакций каталитическую? 1)
- 26. 6 признак химической реакции: Обратимость.1) Необратимая
- 27. Определить среди предложенных реакций обратимые и необратимые?
- 28. Применение химических реакций в строительстве.
- 29. Резка и
- 30. Получение синтетического
- 31. Получение взрывчатых веществ Получение горючего топлива
- 32. Получение красителей и типографической краски Получение пластмасс
- 33. Закрепление: Выполнение индивидуальных дифференцированных заданий по карточкам.
- 34. Итоги урока: 1) О каком явлении
- 35. «Если на небе зажигаются звезды то это
- 36. Домашнее задание:Реферат:«Значение всех типов реакций в реальной жизни, в ее богатстве и разнообразии»
- 37. Спасибо за урок!
Слайд 1Без химии ты глух и нем
И шагу не шагнешь порой.
Не вырастишь
И дом хороший не построишь.
Химию любить и не лениться –
Значит, понятно будет все:
Почему коптит порою примус,
На морозе сушиться белье.
Жизнь вокруг себя узнаешь,
Разрешить любой серьезный спор,
Без огня в дороге яйца сваришь
И без спичек разведешь костер.
Слайд 2Люблю грозу в начале мая,
Когда вечерний первый гром,
Как бы резвясь и
Грохочет в небе голубом.
(Ф.Тютчев «Весенняя гроза»)
Слайд 3Горе тебе, гроза – атаман,
Ты свой произнес приговор,
Средь пожаров ограбленных стран
Ты
(М.Лермонтов «Атаман»)
Слайд 6Тогда услышал я (о, диво)
Запах скверный,
Как будто тухлое разбилось яйцо,
Иль карантинный
Курил жаровней серной.
Я, нос, зажав, отворотил лицо:
(А.Пушкин, Стихотворение, 1832)
Слайд 7
Дайте мне дворец высокий,
И крутой зеленый сад.
Чтоб в тени его широкой
Зрел
(М.Лермонтов «Желанье»)
Слайд 8Пламя рдеет, пламя пышет,
Искры брызжут и летят,
А на них прохладой дышат,
Из-за
(Ф.Тютчев «Пламя рдеет, пламя пышет»)
Слайд 9Полдневный час.
Жара гнетет дыханье;
Глядишь прищурясь,
- блеск глаза слезит,
И над землею
Мигает быстро, будто бы кипит.
(К.Случевский «Полдневный час»)
Слайд 10Вопрос:
Что называют химической реакцией?
Слайд 11Вопрос:
Какие признаки химических реакций вы знаете?
Признаки химической реакции:
Изменение окраски;
Появление
Образование осадка;
Выделение газа;
Выделение или поглощение тепла;
Выделение света.
Слайд 12Вопрос:
А каковы же условия возникновения и течения химических реакций?
Условия возникновения и
1) Измельчение;
2) Перемешивание;
3) Нагревание;
4) Растворение;
5) Давление;
6) Добавление катализатора.
Слайд 14Цель:
Повторить и обобщить представление о химической
Слайд 161 признак химической реакции:
Число и состав исходных и полученных веществ.
1) Реакция
2) Реакция разложения – это процесс, в котором из одного вещества образуется несколько.
3) Реакция замещения – это процесс, где простое вещество замещает одну часть в сложном.
4) Реакция обмена – это процесс, где два сложных вещества обмениваются своими составными частями.
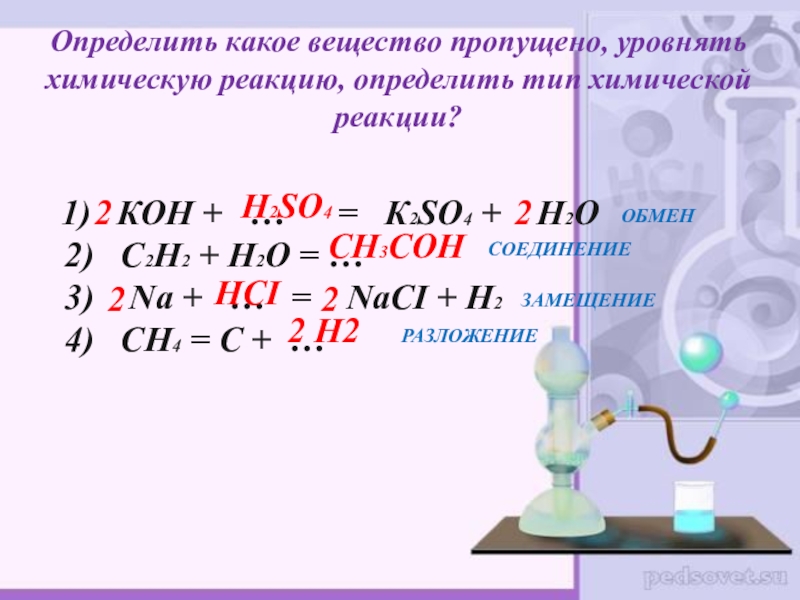
Слайд 17Определить какое вещество пропущено, уровнять химическую реакцию, определить тип химической реакции?
2
2
Н2SО4
ОБМЕН
СН3СОН
СОЕДИНЕНИЕ
2
2
НСI
ЗАМЕЩЕНИЕ
2 Н2
РАЗЛОЖЕНИЕ
Слайд 182 признак химической реакции:
Изменение степени окисления.
1) Степени окисления – величина, которая
2) ОВР – это реакция, идущая с изменением степени окисления.
3) Не ОВР – это реакция, идущая без изменения степени окисления.
4) Окислитель – это частица, принимающая электроны.
5) Восстановитель – это частица, отдающая электроны.
6) Окисление – это процесс отдачи электронов.
7) Восстановление – это процесс принятия электронов.
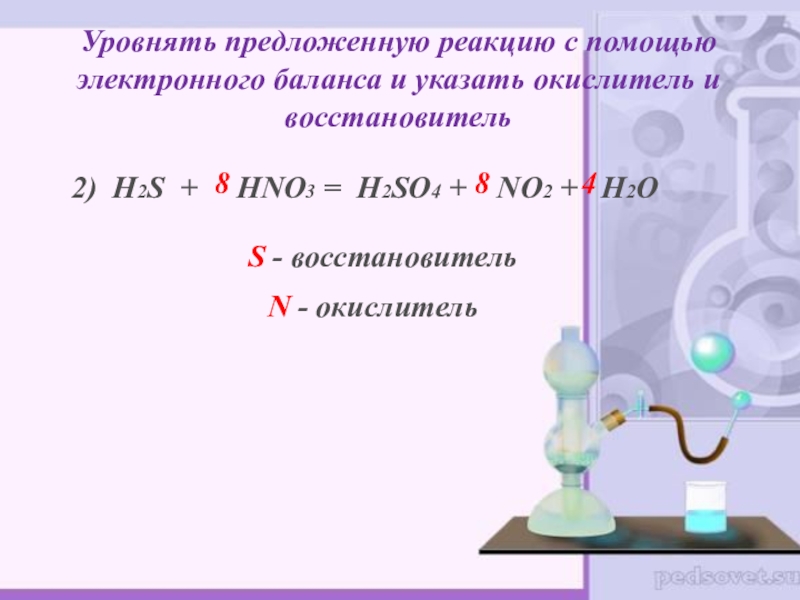
Слайд 19Уровнять предложенную реакцию с помощью электронного баланса и указать окислитель и
2) H2S + HNO3 = H2SO4 + NO2 + H2O
8
8
4
S - восстановитель
N - окислитель
Слайд 203 признак химической реакции:
Тепловой эффект.
1) Тепловой эффект реакции – энергия реакции,
2) Экзотермическая – это реакция, идущая с выделением тепла (энергии).
3) Эндотермическая – это реакция, идущая с поглощением тепла (энергии).
Слайд 21Определить, какая из предложенных реакций является экзотермической ?
1) СН4
+
-
экзотермическая
эндотермическая
Слайд 224 признак химической реакции:
Агрегатное состояние веществ.
1) Гомогенная реакция – это
2) Гетерогенная реакция – это процесс, в котором все вещества находятся в разных агрегатных состояниях.
Слайд 23Определить тип химической реакции по агрегатному состоянию веществ.
1) 3
ГОМОГЕННАЯ
ГЕТЕРОГЕННАЯ
Слайд 245 признак химической реакции:
Введение других веществ.
1) Катализатор – вещество, ускоряющее химическую
2) Ингибитор – вещество, замедляющее химическую реакцию, но само при этом не расходуется.
3) Каталитическая реакция – процесс, идущий с помощью катализатора.
4) Некаталитическая реакция – процесс, идущий без катализатора.
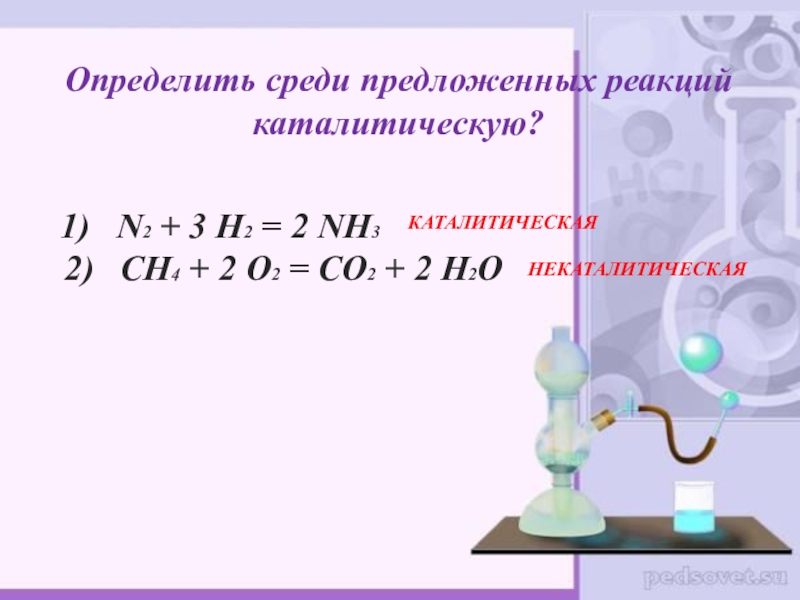
Слайд 25Определить среди предложенных реакций каталитическую?
1) N2 + 3
КАТАЛИТИЧЕСКАЯ
НЕКАТАЛИТИЧЕСКАЯ
Слайд 266 признак химической реакции:
Обратимость.
1) Необратимая реакция – это процесс, идущий
2) Обратимая реакция – это процесс, идущий в двух направлениях.
3) Химическое равновесие – это состояние системы, где скорость прямой реакции равна скорости обратной.
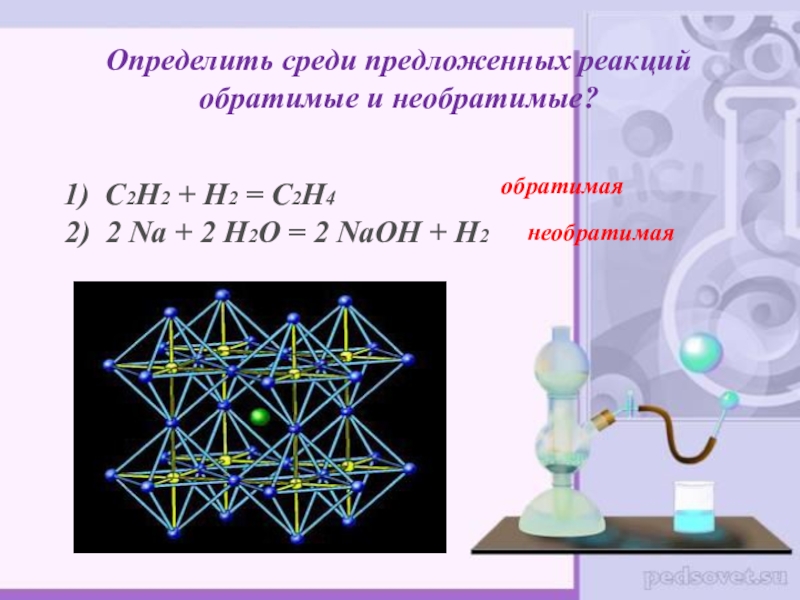
Слайд 27Определить среди предложенных реакций обратимые и необратимые?
1) С2Н2 +
обратимая
необратимая
Слайд 30
Получение синтетического бензина и бензина
Получение антифризов и растворителей
Слайд 34Итоги урока:
1) О каком явлении мы сегодня вели речь?
3) Какие умения на уроке применяли?
4)Достигли ли мы поставленных задач в начале урока?