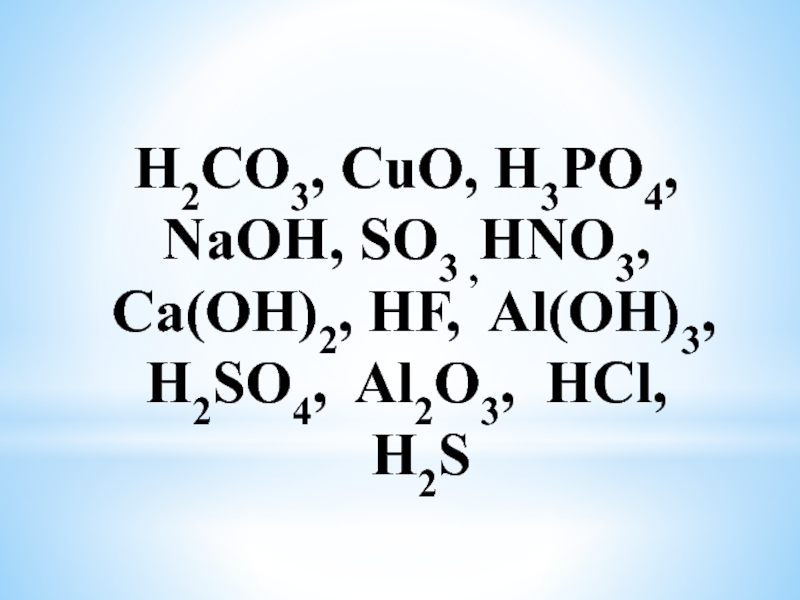- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Кислоты 8 класс
Содержание
- 1. Презентация по химии на тему Кислоты 8 класс
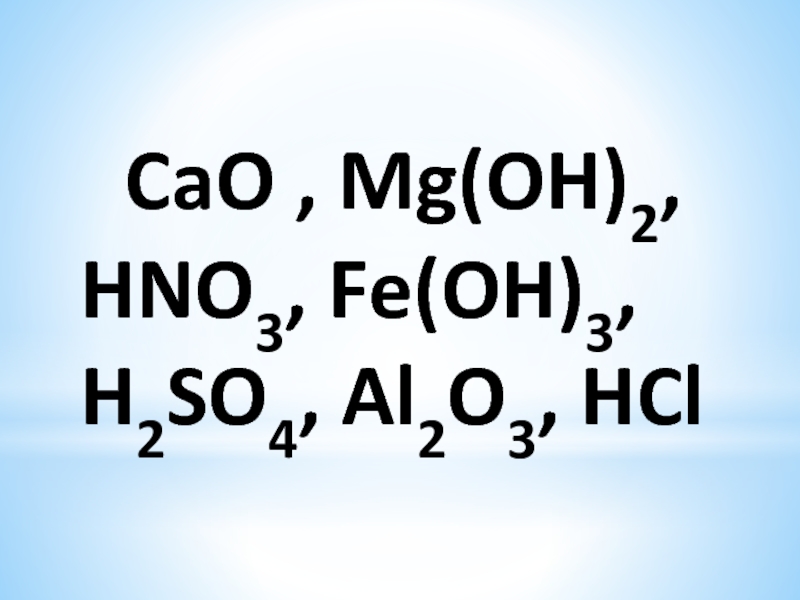
- 2. CaO , Mg(OH)2, HNO3, Fe(OH)3, H2SO4, Al2O3, HCl
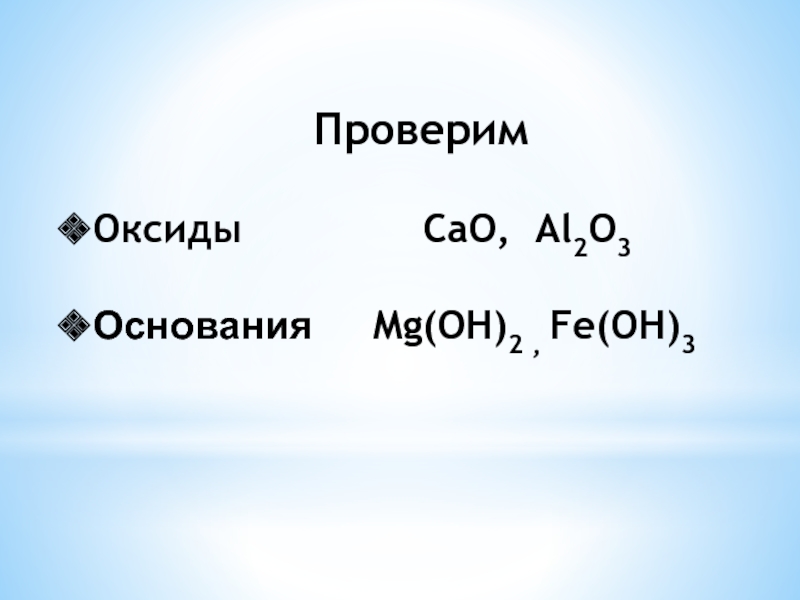
- 3. ПроверимОксиды CaO, Al2O3Основания Mg(OH)2 , Fe(OH)3
- 4. Изменение окраски индикаторов в щелочной среде
- 5. H2SO4, HCl
- 6. Слайд 6
- 7. Задание: Исследовать окраску индикаторов в
- 8. Слайд 8
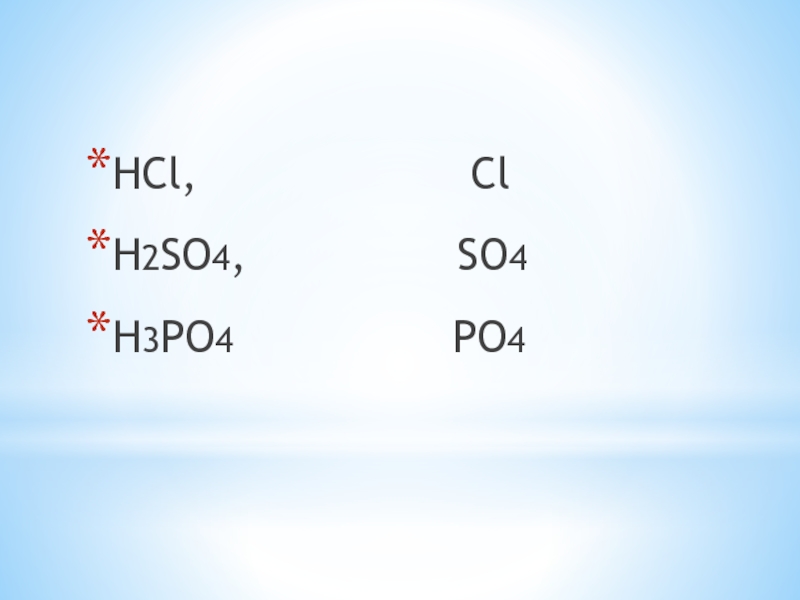
- 9. HCl,
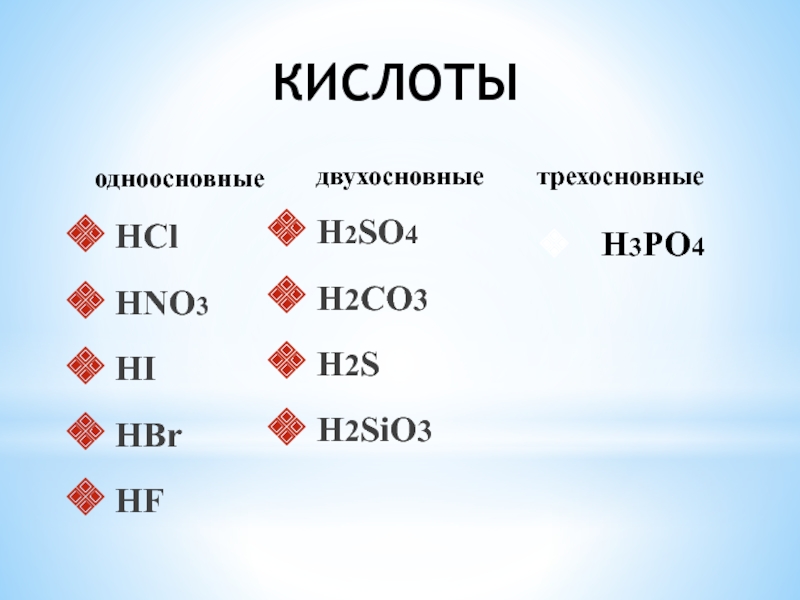
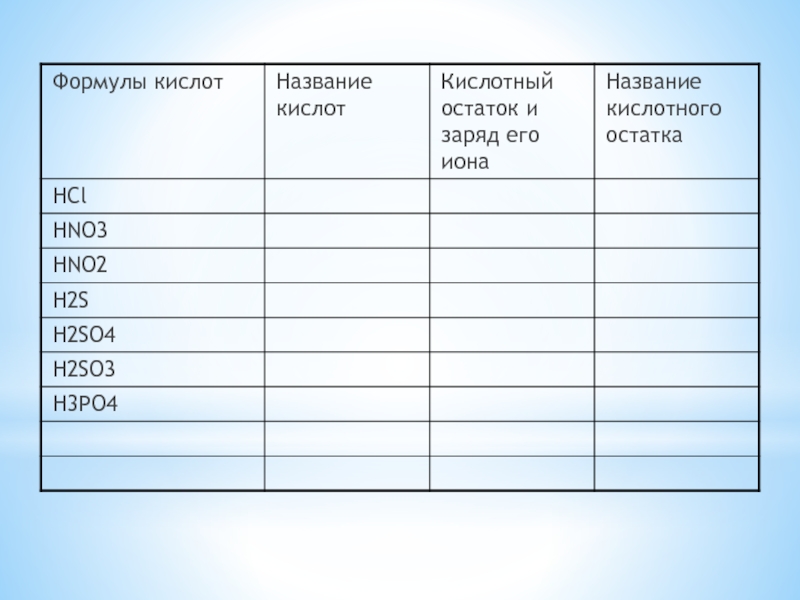
- 10. КИСЛОТЫ HCl HNO3 HI HBr HF H2SO4 H2CO3 H2S H2SiO3 H3PO4одноосновныедвухосновныетрехосновные
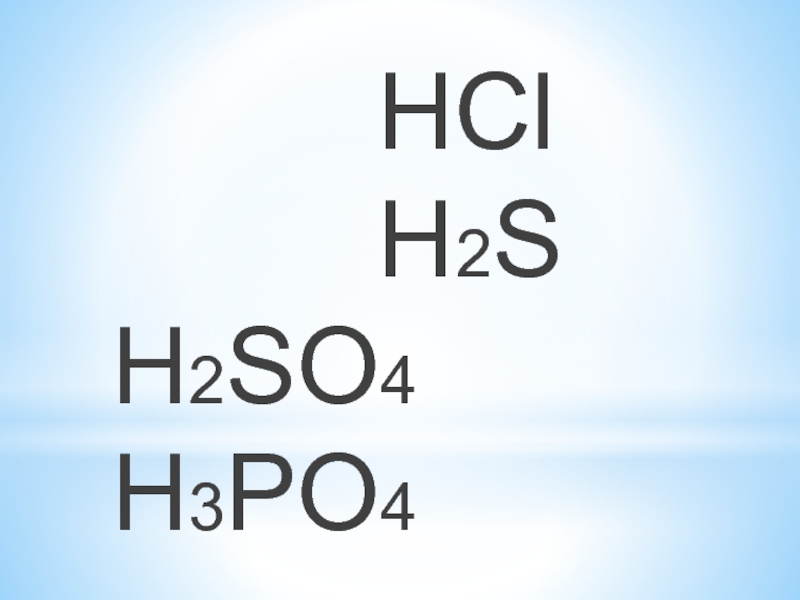
- 11. HCl H2SH2SO4 H3PO4
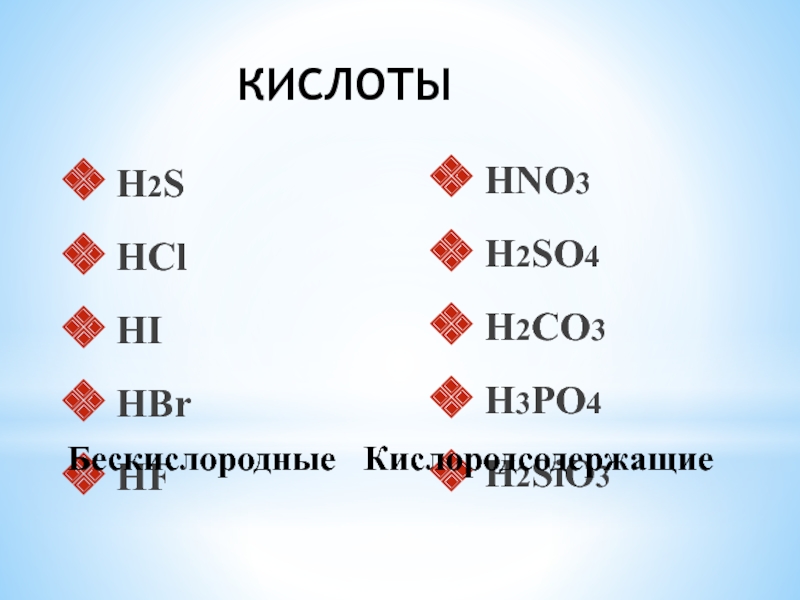
- 12. H2S HCl HI HBr HF HNO3 H2SO4 H2CO3 H3PO4 H2SiO3БескислородныеКислородсодержащиеКИСЛОТЫ
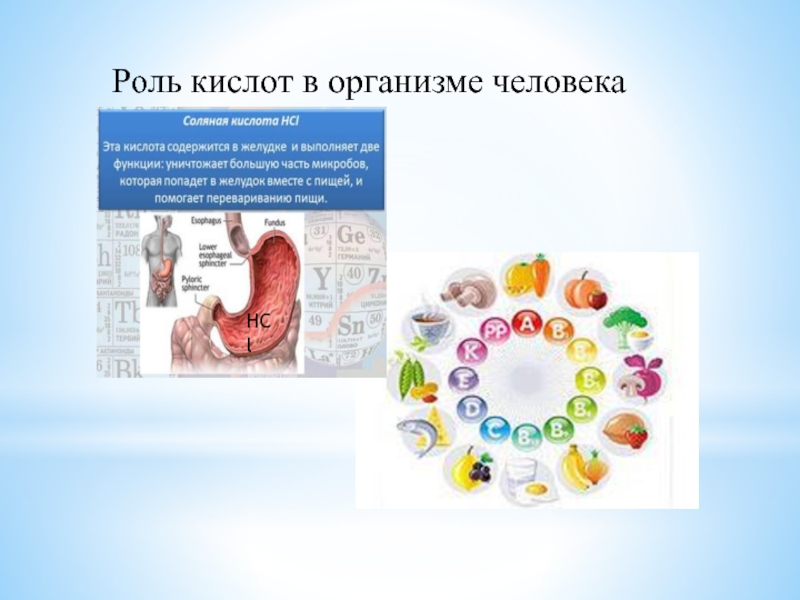
- 13. HCLРоль кислот в организме человекаHCl
- 14. Правило разбавление кислот: сначала вода, затем кислота, иначе случиться большая беда.
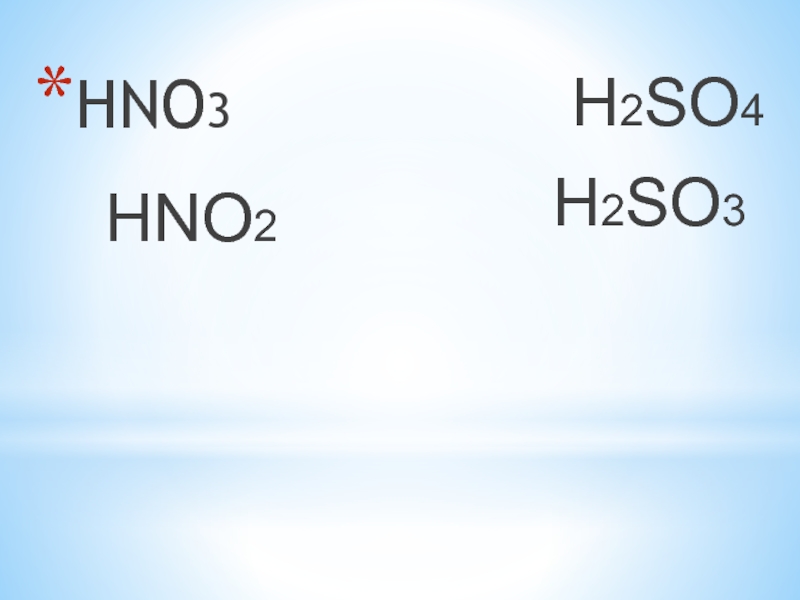
- 15. HNO3HNO2H2SO4H2SO3
- 16. КИСЛОТЫ HNO3 H2SO4 H2CO3 H3PO4 HCl HNO3 HIРастворимые в водеНерастворимые в водеH2SiO3
- 17. КИСЛОТЫ Жидкие HNO3 H2SO4 HCl Твердые H3PO4 H3BO3
- 18. ОРГАНИЧЕСКИЕ КИСЛОТЫНЕОРГАНИЧЕСКИЕ КИСЛОТЫ
- 19. КИСЛОТЫУгольная и сернистая кислоты в свободном виде
- 20. Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им оксиды».
- 21. Разрушение горных пород
- 22. H2CO3, CuO, H3PO4, NaOH,
- 23. Проверим Оксиды Основания Кислоты CuO, Al2O3, SO3
- 24. Слайд 24
- 25. 1) Найдите формулы кислот. Разместите их в
- 26. Домашнее заданиеПараграф №21, выпол. У1-3,заполнить таблицу
CaO , Mg(OH)2, HNO3, Fe(OH)3, H2SO4, Al2O3, HCl
Слайд 1
«Химик не такой должен быть,
который дальше дыму и пеплу
ничего не видит,
а такой, который на основании опытных данных может делать теоретические выводы»
М.В.Ломоносов
ничего не видит,
а такой, который на основании опытных данных может делать теоретические выводы»
М.В.Ломоносов
Слайд 7Задание:
Исследовать окраску индикаторов в кислотных средах.
Оборудование и
реактивы:
2 пробирки с соляной и с лимонными кислотами, лакмусовая, фенолфталеиновая и метилоранжевая бумажки.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1). Перепишите в тетрадь таблицу, представленную в конце опыта.
2). Смочите соляной кислотой (HCl) из 1-ой пробирки лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
Затем этой кислотой смочите фенолфталеиновую бумагу.
Результаты наблюдений запишите в таблицу.
В пробирку с соляной кислотой опустите метилоранжевую бумагу.
Результаты наблюдений запишите в таблицу.
3). Повторите опыты, описанные выше в пункте 2), пробирку с лимонной кислотой.
Не забывайте результаты наблюдений фиксировать в таблице!
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
2 пробирки с соляной и с лимонными кислотами, лакмусовая, фенолфталеиновая и метилоранжевая бумажки.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1). Перепишите в тетрадь таблицу, представленную в конце опыта.
2). Смочите соляной кислотой (HCl) из 1-ой пробирки лакмусовую бумажку. Результаты наблюдений (изменение окраски бумажки) запишите в таблицу.
Затем этой кислотой смочите фенолфталеиновую бумагу.
Результаты наблюдений запишите в таблицу.
В пробирку с соляной кислотой опустите метилоранжевую бумагу.
Результаты наблюдений запишите в таблицу.
3). Повторите опыты, описанные выше в пункте 2), пробирку с лимонной кислотой.
Не забывайте результаты наблюдений фиксировать в таблице!
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Слайд 19КИСЛОТЫ
Угольная и сернистая кислоты в свободном виде не существуют
H2CO3
H2O + CO2
H2SO3 H2O + CO2
H2SO3 H2O + CO2
Слайд 20Каждой кислоте соответствует свой оксид. Дополните таблицу «Кислоты и соответствующие им
оксиды».
Слайд 23Проверим
Оксиды
Основания
Кислоты
CuO, Al2O3, SO3
NaOH, Al(OH)3 Ca(OH)2
H2CO3, H3PO4, HNO3, HF,
H2SO4, HCl, H2S
H2SO4, HCl, H2S
Слайд 251) Найдите формулы кислот. Разместите их в таком порядке, чтобы внизу
получилось название индикатора.
KCl, H2SO4, О3, HCl, BaO, NaOH, H3PO4,H2CO3, CO2, HNO3, H2, H2SO3, CuF2.
б л о а в г к м и у е с д
2) Игра «Третий лишний»
В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
HCl H2SO4 H3PO4
H2SO3 H2SiO3 H3PO4
3) Ребята решили укомплектовать свою учебную лабораторию оксидами, основаниями и кислотами. Заказ им прислали по почте в виде двух посылок:
1-я посылка: NaOH, CaO, H3PO4, HNO3, Ca(OH)2, Cr2O3;
2-я посылка: FeO, H2SO4, KOH, Fe(OH)2, P2O5, HCl.
Но названия веществ подписать забыли. Помогите ребятам.
4) Даны кислотные остатки:
F¯ ; ClO4¯ ; SiO3²¯.
Составьте формулы возможных кислот, назовите их и дайте им характеристику, используя признаки классификации.
KCl, H2SO4, О3, HCl, BaO, NaOH, H3PO4,H2CO3, CO2, HNO3, H2, H2SO3, CuF2.
б л о а в г к м и у е с д
2) Игра «Третий лишний»
В каждом ряду найдите лишнюю формулу, ответ мотивируйте:
HCl H2SO4 H3PO4
H2SO3 H2SiO3 H3PO4
3) Ребята решили укомплектовать свою учебную лабораторию оксидами, основаниями и кислотами. Заказ им прислали по почте в виде двух посылок:
1-я посылка: NaOH, CaO, H3PO4, HNO3, Ca(OH)2, Cr2O3;
2-я посылка: FeO, H2SO4, KOH, Fe(OH)2, P2O5, HCl.
Но названия веществ подписать забыли. Помогите ребятам.
4) Даны кислотные остатки:
F¯ ; ClO4¯ ; SiO3²¯.
Составьте формулы возможных кислот, назовите их и дайте им характеристику, используя признаки классификации.