- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Электролиз
Содержание
- 1. Презентация по химии на тему Электролиз
- 2. В соединениях металлы и неметаллы обычно находятся в связанном состоянии.Например, хлорид меди (II) и хлорид натрия.
- 3. Промышленность нуждается в свободных активных металлах таких,
- 4. Также необходимы и простые вещества - неметаллы: фтор, йод, бром …
- 5. Известны способы разделения металлов и неметаллов из
- 6. схема электролиза хлорида меди (II)В гальваническую (электродную)
- 7. Катод Анод – + Сu2+ + 2ē
- 8. 2NaCl → 2Na + Cl2На катоде (–):Na+
- 9. электролиз водных растворов Процесс на катоде не
- 10. Правила определения катодных процессов1. Если катион (+)
- 11. Катодные процессы в водных растворах солей
- 12. Правила определения анодных процессов1. Если анод (+)
- 13. Схема электролиза с растворимым анодом(очистка меди путём
- 14. Анодные процессы в водных растворах солей
- 15. Анионы по их способности окисляться располагаются в
- 16. применение электролиза Электролиз широко используют в промышленности
- 17. Успехов !!!
Слайд 2В соединениях металлы и неметаллы обычно находятся в связанном состоянии.
Например, хлорид
Слайд 3Промышленность нуждается в свободных активных металлах таких, как натрий, калий и
Восстановить эти металлы из минералов практически не возможно, так как к ним очень трудно подобрать восстановители.
Слайд 5
Известны способы разделения металлов и неметаллов из растворов и расплавов их
Электролизом называются окислительно-восстановительные процессы, протекающие в растворах и расплавах электролитов под действием постоянного электрического тока.
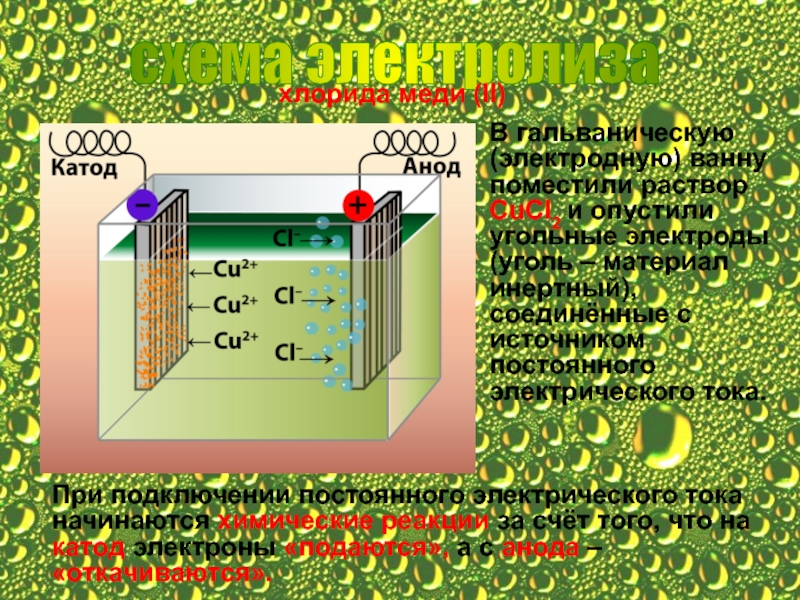
Слайд 6схема электролиза
хлорида меди (II)
В гальваническую (электродную) ванну поместили раствор СuCl2
При подключении постоянного электрического тока начинаются химические реакции за счёт того, что на катод электроны «подаются», а с анода – «откачиваются».
Слайд 7
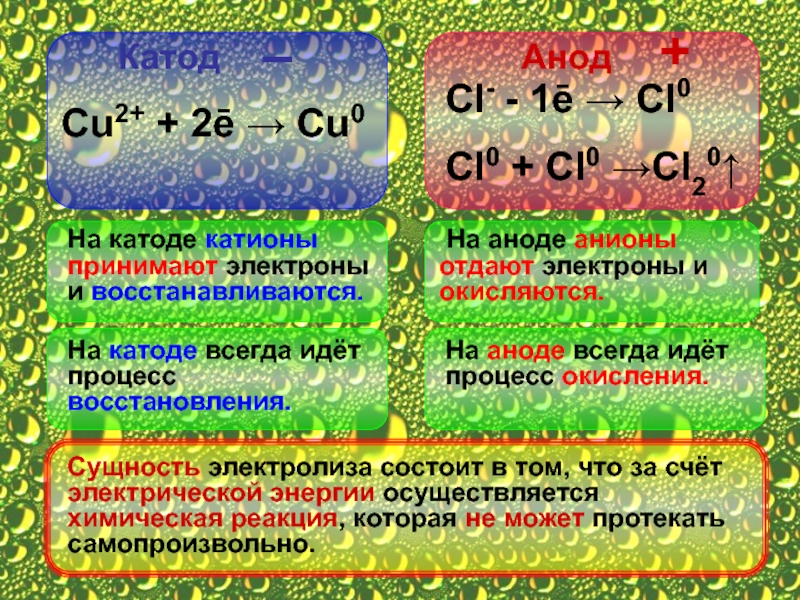
Катод
Анод
–
+
Сu2+ + 2ē → Cu0
Сl- - 1ē
Cl0 + Cl0 →Cl20↑
На катоде катионы принимают электроны и восстанавливаются.
На аноде анионы отдают электроны и окисляются.
На катоде всегда идёт процесс восстановления.
На аноде всегда идёт процесс окисления.
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Слайд 8
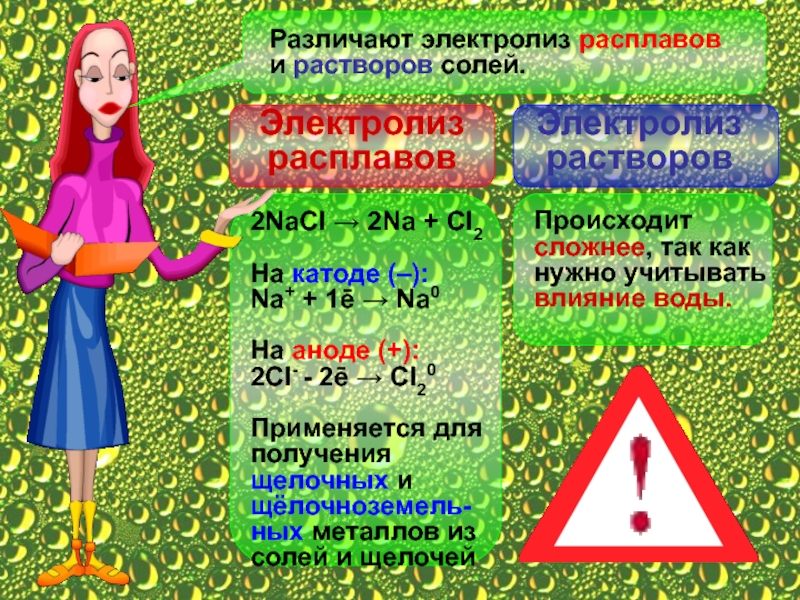
2NaCl → 2Na + Cl2
На катоде (–):
Na+ + 1ē → Na0
На
2Сl- - 2ē → Cl20
Применяется для получения щелочных и щёлочноземель-ных металлов из солей и щелочей
Происходит сложнее, так как нужно учитывать влияние воды.
Электролиз расплавов
Электролиз растворов
Различают электролиз расплавов и растворов солей.
Слайд 9электролиз водных
растворов
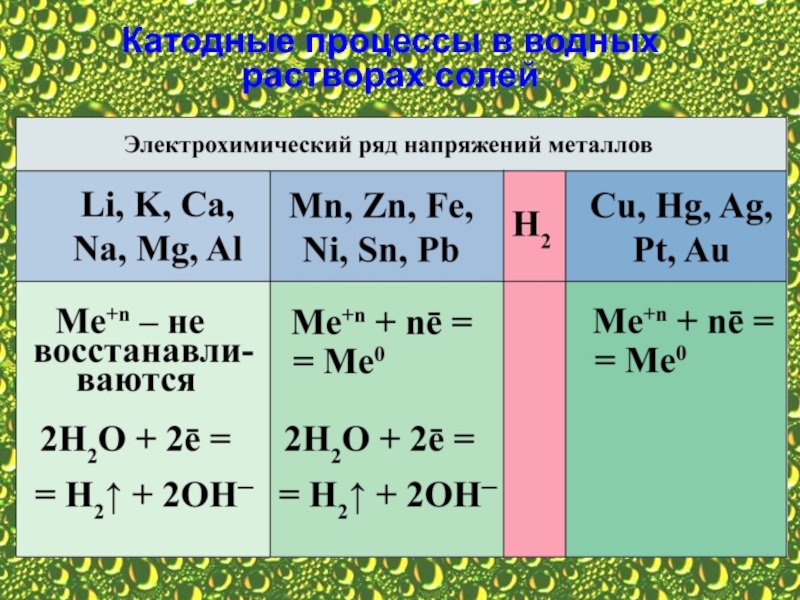
Процесс на катоде не зависит от материала катода,
Процесс на аноде зависит от материала анода и от природы аниона.
Для определения результатов электролиза водных растворов существуют правила определения катодных и анодных процессов.
Слайд 10Правила определения катодных процессов
1. Если катион (+) находится в начале ряда
2. Если катион (+) находится между Аl и Н2, то на катоде (–) восстанавливаются одновременно и ионы металла, и молекулы воды.
3. Если катион (+) находится после водорода, то на катоде (–) идёт только процесс восстановления ионов металла.
4. Если в растворе смесь катионов разных металлов, то первыми восстанавливаются катионы металла, имеющего наибольшее алгебраическое значение электродного потенциала.
Слайд 12Правила определения анодных процессов
1. Если анод (+) растворимый (Fe, Cu, Zn,
2. Если анод (+) нерастворимый, т. е. инертный (уголь, графит, Pt, Au), то:
а) на аноде (+) окисляется анион (–) бескислородной кислоты;
б) на аноде (+) окисляется вода, если соли фториды или соли кислородсодержащих кислот.
3. При электролизе растворов щелочей идёт окисление гидроксид-ионов.
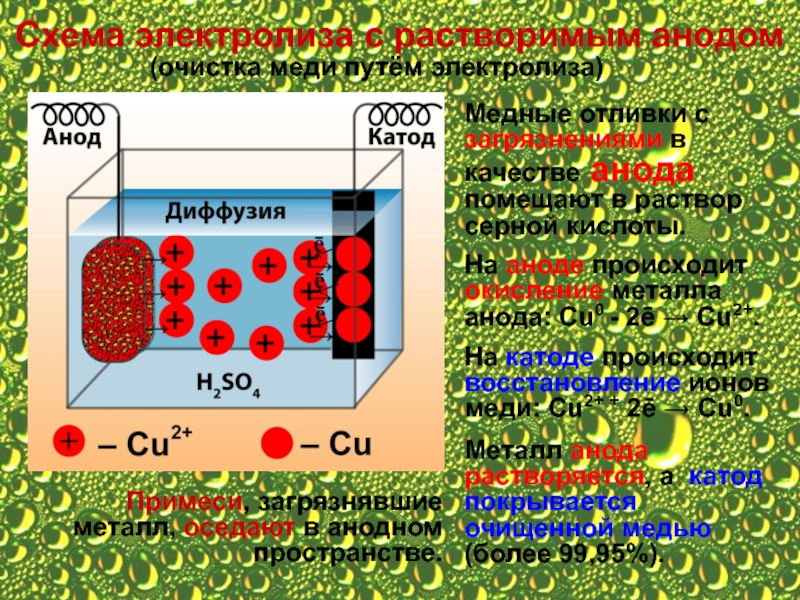
Слайд 13Схема электролиза с растворимым анодом
(очистка меди путём электролиза)
Медные отливки с загрязнениями
На аноде происходит окисление металла анода: Сu0 - 2ē → Cu2+.
На катоде происходит восстановление ионов меди: Сu2+ + 2ē → Cu0.
Металл анода растворяется, а катод покрывается очищенной медью (более 99,95%).
Примеси, загрязнявшие металл, оседают в анодном пространстве.
Слайд 15
Анионы по их способности окисляться располагаются в следующем порядке:
F–, NO3–, SO42–,
Характер среды влияет но процессы окисления-восстановления.
При большой концентрации ионов Н+ на катоде (–) может протекать реакция их восстановления:
2Н+ + 2ē = Н2↑.
При большой концентрации ионов ОН– они окисляются на аноде (+):
4ОН– - 4ē = О2 + 2Н2О
Восстановительная способность возрастает
Окислительная способность убывает
Слайд 16применение электролиза
Электролиз широко используют в промышленности для выделения и очистки
Алюминий, магний, натрий, кадмий получают только электролизом.
Очистку меди, никеля, свинца проводят целиком электрохимическим методом.
Защита металлов от коррозии: на поверхность изделий наносят тонкий слой серебра, хрома, никеля, золота, меди.