- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Химический свойства кислот
Содержание
- 1. Презентация по химии Химический свойства кислот
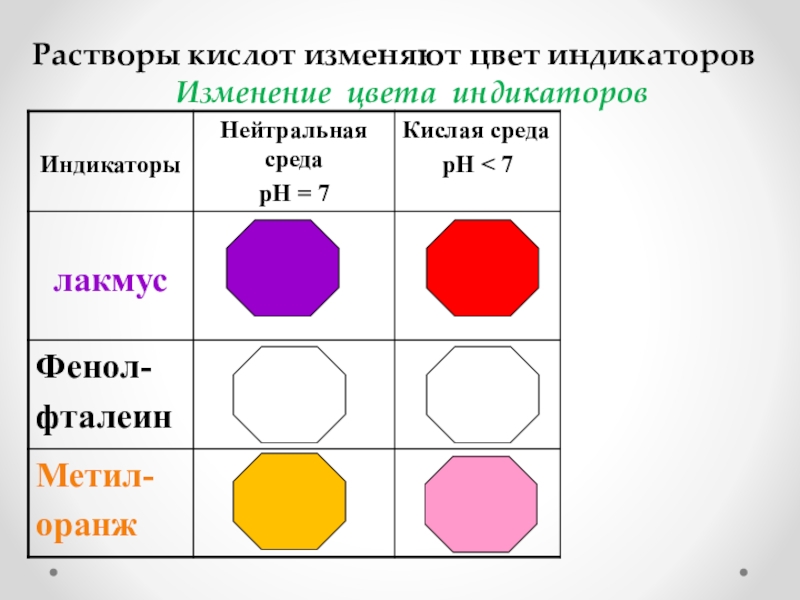
- 2. Растворы кислот изменяют цвет индикаторовИзменение цвета индикаторов
- 3. Химические свойства кислот
- 4. 1.Взаимодействие с металлами, стоящими до водорода
- 5. Примечание. С азотной или серной концентрированными кислотами
- 6. 2.Кислоты взаимодействуют с основными и ↑амфотерными оксидами
- 7. 3. Кислоты взаимодействуют со щелочами (растворимыми основаниями)
- 8. 4.Кислоты взаимодействуют с нерастворимыми основаниями и амфотерными
- 9. 5.Кислоты взаимодействуют с солями, если выпадает осадок
- 10. 6.Более сильные кислоты вытесняют более слабые кислоты
- 11. Домашнее задание §35
Растворы кислот изменяют цвет индикаторовИзменение цвета индикаторов
Слайд 4
1.Взаимодействие с металлами, стоящими до водорода в ряду активности:
Zn
+ 2HCl=H2↑+ ZnCl2 (реакция замещения)
Zn + 2H++2Cl-=H2↑+ Zn2+ +2Cl-
Zn + 2H+=H2↑+ Zn2+-
3Ca + 2H3PO4=3H2↑ + Ca3(PO4)2
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
Fe + 2HCl = FeCl2 + H2↑
Zn + 2H++2Cl-=H2↑+ Zn2+ +2Cl-
Zn + 2H+=H2↑+ Zn2+-
3Ca + 2H3PO4=3H2↑ + Ca3(PO4)2
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
Fe + 2HCl = FeCl2 + H2↑
Слайд 5Примечание.
С азотной или серной концентрированными кислотами реакция идёт иначе:
Mg + 2H2SO4(конц.) = SO2↑ + 2H2O + MgSO4
Слайд 62.Кислоты взаимодействуют с основными и ↑амфотерными оксидами с образованием соли и
воды
3CaО + 2H3PO4=3H2О + Ca3(PO4)2
3CaО + 6H++2PO43-=3H2О + 3Ca2++2PO4 3-
3CaО + 6H+=3H2О + 3Ca2+
2HNO3+ZnO = Zn(NO3)2 + H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
Al2O3+6HNO3=2Al(NO)3+3H2O
3CaО + 2H3PO4=3H2О + Ca3(PO4)2
3CaО + 6H++2PO43-=3H2О + 3Ca2++2PO4 3-
3CaО + 6H+=3H2О + 3Ca2+
2HNO3+ZnO = Zn(NO3)2 + H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
Al2O3+6HNO3=2Al(NO)3+3H2O
Слайд 73. Кислоты взаимодействуют со щелочами (растворимыми основаниями) с образованием соли и
воды
NaOH + HCl = NaCl + H2O
Na+ +OH- + H++Cl- = Na++Cl -+ H2O
OH- + H+ = H2O
KOH + HCl = KCl + H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
NaOH + HCl = NaCl + H2O
Na+ +OH- + H++Cl- = Na++Cl -+ H2O
OH- + H+ = H2O
KOH + HCl = KCl + H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
Слайд 84.Кислоты взаимодействуют с нерастворимыми основаниями и амфотерными гидроксидами с образованием соли
и воды, если полученная соль растворима
Zn(OH)2+2HNO3=Zn(NO)3+2H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
Zn(OH)2+2HNO3=Zn(NO)3+2H2O
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
2HCl + Cu(OH)2 = CuCl2 + 2H2O
Слайд 95.Кислоты взаимодействуют с солями, если выпадает осадок или выделяется газ:
H2SO4
+ BaCl2 = 2HCl + BaSO4↓
Слайд 106.Более сильные кислоты вытесняют более слабые кислоты из их солей:
K3PO4 + 3HCl = 3KCl + H3PO4
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
K2CO3 + 2HCl = 2KCl + CO2+ H2O (в данном случае непрочная угольная кислота H2CO3 распадается на воду и углекислый газ)
Аналогично предыдущему уравнению запишем его в виде полного и сокращённого ионных уравнений.
K2CO3 + 2HCl = 2KCl + CO2+ H2O (в данном случае непрочная угольная кислота H2CO3 распадается на воду и углекислый газ)