- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 9 класс электролитическая диссоциация
Содержание
- 1. Презентация по химии 9 класс электролитическая диссоциация
- 2. ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ
- 3. Для объяснения особенностей водных растворов электролитов шведским ученым С.
- 4. 1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют)на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы. Ионы находятся
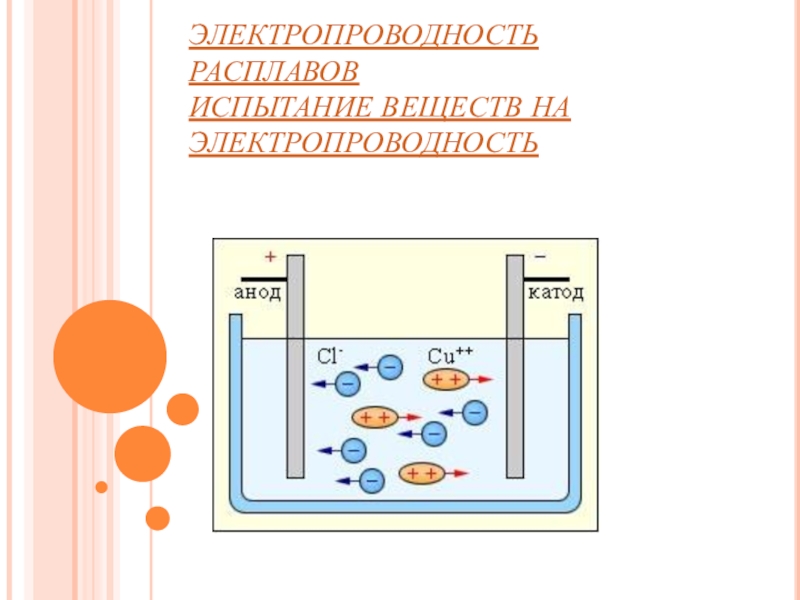
- 5. ЭЛЕКТРОПРОВОДНОСТЬ РАСПЛАВОВ ИСПЫТАНИЕ ВЕЩЕСТВ НА ЭЛЕКТРОПРОВОДНОСТЬ
- 6. К сильным электролитам относятся1) кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);2) основания
- 7. К слабым электролитам относятся:1) неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS,
- 8. Уравнения диссоциации Уравнение, отражающее обратимый процесс (↔)
- 9. Диссоциация кислот Кислотами называют электролиты, которые при
- 10. Диссоциация оснований Основаниями называют электролиты, которые
- 11. Диссоциация солей Солями называют электролиты, которые при
- 12. Тест по теме "Электролитическая диссоциация. Реакции ионного
- 13. 4. Катионы металла и анионы кислотного остатка
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются. Процесс распада вещества на свободные ионы при
Слайд 1Урок №5. Электролиты и неэлектролиты. Электролитическая диссоциация веществ в водных растворах
Слайд 2 ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ
ДИССОЦИАЦИИ
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
Процесс распада вещества на свободные ионы при его растворении и расплавлении называются электролитической диссоциацией
Растворы всех веществ можно разделить на две группы: проводят электрический ток или проводниками не являются.
Процесс распада вещества на свободные ионы при его растворении и расплавлении называются электролитической диссоциацией
Слайд 3Для объяснения особенностей водных растворов электролитов шведским ученым С. Аррениусом в 1887 г. была предложена теория
электролитической диссоциации. В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи. Современное содержание этой теории можно свести к следующим трем положениям:
.
Слайд 41. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют)на ионы – положительно (катионы) и отрицательно (анионы) заряженные частицы. Ионы находятся в более устойчивых электронных состояниях,
чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4 и т.д.).
2. В растворах и расплавах электролиты проводят электрический ток.
Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами
Слайд 6К сильным электролитам относятся
1) кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);
2) основания – гидроксиды металлов первой
группы главной подгруппы (щелочи) – LiOH, NaOH, KOH, RbOH, CsOH, а также гидроксиды щелочноземельных металлов – Ba(OH)2 , Ca(OH)2, Sr(OH)2
) соли, растворимые в воде
) соли, растворимые в воде
Слайд 7К слабым электролитам относятся:
1) неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H3PO4, H2SiO3, HCNS, HСlO и др.);
2) вода
(H2O);
3) гидроксид аммония (NH4OH);
4) большинство органических кислот
(например, уксусная CH3COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов
3) гидроксид аммония (NH4OH);
4) большинство органических кислот
(например, уксусная CH3COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов
Слайд 8Уравнения диссоциации
Уравнение, отражающее обратимый процесс (↔) диссоциации данного вещества, называется уравнением
диссоциации. В растворе или расплаве преимущественно находятся ионы (→). При испарении воды или охлаждении расплава вновь образуются кристаллы или молекулы(←):
KOH K+ + OH─
HCl H+ + Cl─
K2SO4 2K+ + SO42─
Fe2(SO4)3 2Fe3+ + 3SO42─
При написании уравнений диссоциации следите, чтобы сумма положительных и отрицательных зарядов в правой части уравнения была равна 0
KOH K+ + OH─
HCl H+ + Cl─
K2SO4 2K+ + SO42─
Fe2(SO4)3 2Fe3+ + 3SO42─
При написании уравнений диссоциации следите, чтобы сумма положительных и отрицательных зарядов в правой части уравнения была равна 0
Слайд 9Диссоциация кислот
Кислотами называют электролиты, которые при диссоциации образуют катионы только Н+,
например:
HNO3 H+ + NO3 ─
H2SO4 H+ + HSO4 ─ 2 H+ + SO42 ─
H3PO4 H+ + H2PO4─ 2 H+ + HPO42 ─ 3H+ + PO4 3─
Кислоты окрашивают все индикаторы в красный цвет разных оттенков
HNO3 H+ + NO3 ─
H2SO4 H+ + HSO4 ─ 2 H+ + SO42 ─
H3PO4 H+ + H2PO4─ 2 H+ + HPO42 ─ 3H+ + PO4 3─
Кислоты окрашивают все индикаторы в красный цвет разных оттенков
Слайд 10Диссоциация оснований
Основаниями называют электролиты, которые при диссоциации образуют анионы только
OH─ :
NaOH Na+ + OH ─
Ca(OH)2 CaOH+ + OH ─ Ca2+ + 2 OH ─
Ba(OH)2 BaOH+ + OH ─ Ba2+ + 2 OH ─
Основания (щёлочи) окрашивают бесцветный фенолфталеин в малиновый цвет, а лакмус и универсальный индикатор ─ в синий
NaOH Na+ + OH ─
Ca(OH)2 CaOH+ + OH ─ Ca2+ + 2 OH ─
Ba(OH)2 BaOH+ + OH ─ Ba2+ + 2 OH ─
Основания (щёлочи) окрашивают бесцветный фенолфталеин в малиновый цвет, а лакмус и универсальный индикатор ─ в синий
Слайд 11Диссоциация солей
Солями называют электролиты, которые при диссоциации образуют катионы металла (или
аммония NH4+) и анионы кислотного остатка:
K3PO4 3K+ + PO43─
Al2(SO4)3 2Al3+ + 3SO4 2─
NH4NO3 NH4+ + NO3─
K3PO4 3K+ + PO43─
Al2(SO4)3 2Al3+ + 3SO4 2─
NH4NO3 NH4+ + NO3─
Слайд 12Тест по теме "Электролитическая диссоциация. Реакции ионного обмена"
1. К неэлектролитам относится:
1)
нитрат калия 2) гидроксид бария
3) хлорид кальция 4) оксид азота(II)
2. К хорошо растворимым электролитам относится:
1) бромид натрия 2) гидроксид цинка
3) карбонат кальция 4) гидроксид магния
3. В водном растворе наибольшее количество сульфат-анионов образуется при
диссоциации 1 моль:
1) Al2(SO4)3 2)PbS
3) CaSO4 4) K2SO4
3) хлорид кальция 4) оксид азота(II)
2. К хорошо растворимым электролитам относится:
1) бромид натрия 2) гидроксид цинка
3) карбонат кальция 4) гидроксид магния
3. В водном растворе наибольшее количество сульфат-анионов образуется при
диссоциации 1 моль:
1) Al2(SO4)3 2)PbS
3) CaSO4 4) K2SO4
Слайд 134. Катионы металла и анионы кислотного остатка образуются при диссоциации:
1) оксидов 2)
кислот
3) солей 4) оснований
5. Выберите верную запись правой части уравнения диссоциации карбоната калия:
1) = K+ + CO3¯ 2) = K+ + CO32-
3) = 2K+ + CO32- 4) = 2K+ + HCO3¯
6. Наибольшее количество анионов образуется при диссоциации 1 моль:
1) AlCl3 2) Zn(OH)2
3) Al(OH)3 4) Zn(NO3)2
3) солей 4) оснований
5. Выберите верную запись правой части уравнения диссоциации карбоната калия:
1) = K+ + CO3¯ 2) = K+ + CO32-
3) = 2K+ + CO32- 4) = 2K+ + HCO3¯
6. Наибольшее количество анионов образуется при диссоциации 1 моль:
1) AlCl3 2) Zn(OH)2
3) Al(OH)3 4) Zn(NO3)2