- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 8 класс на тему Классификация кислот
Содержание
- 1. Презентация по химии 8 класс на тему Классификация кислот
- 2. Расставьте коэффициенты в уравнениях, напишите полное и
- 3. ZnO +2 HNO3 = Zn(NO3)2 + H2OZnO + 2H+ +
- 4. Классификация кислот
- 5. Типичные реакции кислотКислота + Основание
- 6. Кислота + ОснованиеРеакция протекает с любыми кислотами
- 7. Кислота + оксид металлаСuO+ H2SO4 CuSO4+ H2O
- 8. Кислота + металлZn + HCl
- 9. Кислота + сольУсловия протекания:Выпадение осадка;BaCl2+ H2SO4
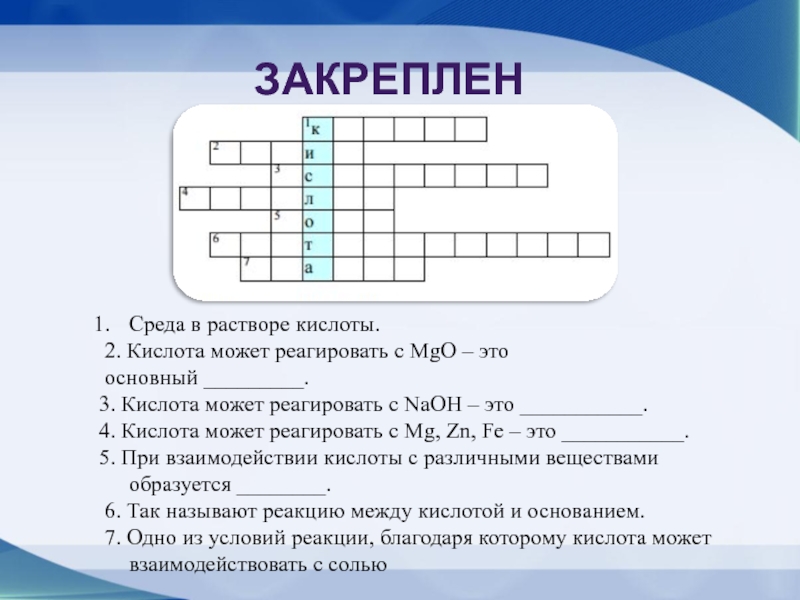
- 10. ЗакреплениеСреда в растворе кислоты. 2. Кислота может
- 11. Домашнее задание§ 38 упражнение № 4, выучить
Расставьте коэффициенты в уравнениях, напишите полное и сокращенное ионные уравнения. Определите тип химической реакции.ZnO + HNO3 = Zn(NO3)2 + H2OAl + H2SO4(разб) = Al2(SO4)3 + H2↑HCl + FeS =FeCl2 + H2SH2SO4 + Fe(OH)3 = Fe2(SO4)3 + H2OСамостоятельная работа
Слайд 2Расставьте коэффициенты в уравнениях, напишите полное и сокращенное ионные уравнения. Определите
тип химической реакции.
ZnO + HNO3 = Zn(NO3)2 + H2O
Al + H2SO4(разб) = Al2(SO4)3 + H2↑
HCl + FeS =FeCl2 + H2S
H2SO4 + Fe(OH)3 = Fe2(SO4)3 + H2O
ZnO + HNO3 = Zn(NO3)2 + H2O
Al + H2SO4(разб) = Al2(SO4)3 + H2↑
HCl + FeS =FeCl2 + H2S
H2SO4 + Fe(OH)3 = Fe2(SO4)3 + H2O
Самостоятельная работа
Слайд 3
ZnO +2 HNO3 = Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3- = Zn2+ + 2NO3- + H2O
ZnO
+ 2H+ = Zn2+ + H2O
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2↑
2Al0 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2↑
2Al0 + 6H+ = 2Al3+ +3 H2↑
2HCl + FeS =FeCl2 + H2S
2H+ + 2Cl- + FeS =Fe2+ + 2Cl- + H2S
2H+ + FeS =Fe2+ + H2S
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42- + 2Fe(OH)3 = 2Fe3+ + 3SO42- + 6H2O
6H+ + 2Fe(OH)2 = 2Fe2+ + 6H2O
2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2↑
2Al0 + 6H+ + 3SO42- = 2Al3+ + 3SO42- + 3H2↑
2Al0 + 6H+ = 2Al3+ +3 H2↑
2HCl + FeS =FeCl2 + H2S
2H+ + 2Cl- + FeS =Fe2+ + 2Cl- + H2S
2H+ + FeS =Fe2+ + H2S
3H2SO4 + 2Fe(OH)3 = Fe2(SO4)3 + 6H2O
6H+ + 3SO42- + 2Fe(OH)3 = 2Fe3+ + 3SO42- + 6H2O
6H+ + 2Fe(OH)2 = 2Fe2+ + 6H2O
Проверь себя
Слайд 5Типичные реакции кислот
Кислота + Основание Соль +
Вода (реакция обмена)
Кислота + Оксид металла Соль + Вода (реакция обмена)
Кислота + Металл Соль + Водород (реакция замещения)
Кислота + Соль Новая соль + Новая кислота (реакция обмена)
Кислота + Оксид металла Соль + Вода (реакция обмена)
Кислота + Металл Соль + Водород (реакция замещения)
Кислота + Соль Новая соль + Новая кислота (реакция обмена)
Слайд 6Кислота + Основание
Реакция протекает с любыми кислотами и основаниями (растворимыми и
нерастворимыми).
Реакция кислоты с щелочами называется реакцией нейтрализации.
NaOH + HCl NaCl + H2O
Сu(OH)2+ H2SO4 CuSO4+ 2H2O
Реакция кислоты с щелочами называется реакцией нейтрализации.
NaOH + HCl NaCl + H2O
Сu(OH)2+ H2SO4 CuSO4+ 2H2O
Слайд 8Кислота + металл
Zn + HCl ZnCl2 +H2
Условия протекания
реакции:
1.Металл должен находиться в ряду напряжений металлов до водорода;
2. Продуктом реакции является растворимая соль.
3.Раекция протекает только с растворимыми кислотами.
4.Концентрированные серная и азотная кислоты образуют иные продукты реакции.
1.Металл должен находиться в ряду напряжений металлов до водорода;
2. Продуктом реакции является растворимая соль.
3.Раекция протекает только с растворимыми кислотами.
4.Концентрированные серная и азотная кислоты образуют иные продукты реакции.
Слайд 9Кислота + соль
Условия протекания:
Выпадение осадка;
BaCl2+ H2SO4 BaSO4
+ 2HCl
2.Выделение газа.
Na2CO3 + 2HCl = CO2↑ + H2O + 2NaCl
2.Выделение газа.
Na2CO3 + 2HCl = CO2↑ + H2O + 2NaCl
Слайд 10Закрепление
Среда в растворе кислоты.
2. Кислота может реагировать с MgO –
это
основный _________.
3. Кислота может реагировать с NaOH – это ___________.
4. Кислота может реагировать с Mg, Zn, Fe – это ___________.
5. При взаимодействии кислоты с различными веществами образуется ________.
6. Так называют реакцию между кислотой и основанием.
7. Одно из условий реакции, благодаря которому кислота может взаимодействовать с солью
основный _________.
3. Кислота может реагировать с NaOH – это ___________.
4. Кислота может реагировать с Mg, Zn, Fe – это ___________.
5. При взаимодействии кислоты с различными веществами образуется ________.
6. Так называют реакцию между кислотой и основанием.
7. Одно из условий реакции, благодаря которому кислота может взаимодействовать с солью
Слайд 11Домашнее задание
§ 38 упражнение № 4, выучить типичные реакции кислот. Придумайте
задачу, которая основывалась бы на реакции нейтрализации.