- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 11 класс Химическая связь
Содержание
- 1. Презентация по химии 11 класс Химическая связь
- 2. ЭПИГРАФЧтобы достигнуть знания, нужно исследовать сущность вещей;
- 3. дать определение химической связи;познакомиться с различными типами химической связи;научиться определять тип связи в различных соединениях.Задачи урока:
- 4. Причиной образования химической связи является стремление
- 5. ХИМИЧЕСКАЯ СВЯЗЬ – ЭТО СВЯЗЬ МЕЖДУ ХИМИЧЕСКИМИ
- 6. Энергия химической связи – количество теплоты, поглощаемое
- 7. Различают четыре типа химических связей:Ионная связь.Ковалентная связь.Металлическая
- 8. Выполните упражнение №1Из предложенного списка распределите формулы
- 9. Ионная связьэто связь, образовавшаяся за счёт электростатического
- 10. -ОН , -2SO, - Cl
- 11. Механизм образования ионной
- 12. Ковалентная связьэто связь, возникает между атомами за счёт образования общих электронных пар.ēēēēēē
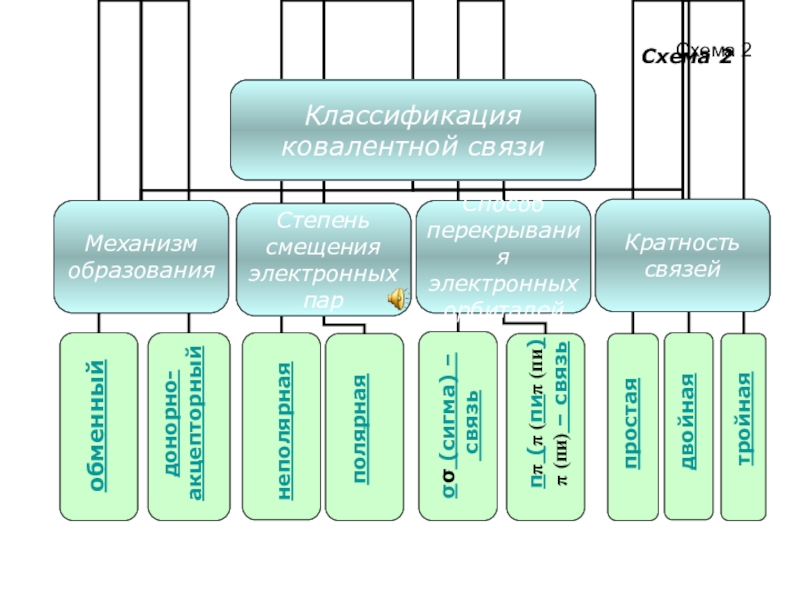
- 13. Схема 2обменныйдонорно-акцепторныйполярнаянеполярнаяσσ (сигма) – связьππ (π (пиπ (пи)π (пи) – связьпростаядвойнаятройнаяСхема 2
- 14. Обменный механизм образования ковалентной связи☼ Действует,
- 15. Слайд 15
- 16. Донорно-акцепторный механизм образования ковалентной связи
- 17. Степень смещения электронных пар☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов.Ряд
- 18. Кратность ковалентной связи☼Зависит от числа общих электронных
- 19. Перекрывание электронных орбиталей. σ – связь.это ковалентная
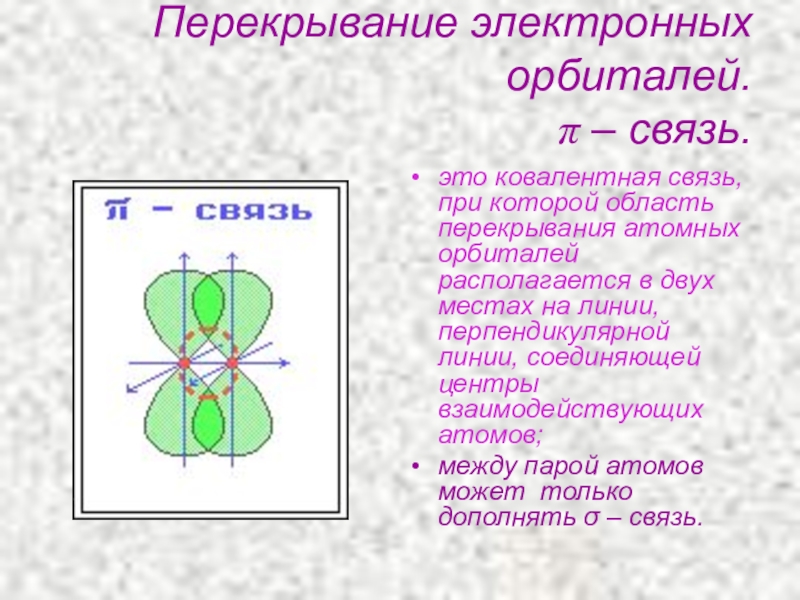
- 20. Перекрывание электронных орбиталей. π – связь.это ковалентная
- 21. Свойства веществ:Твердые;Имеют высокие температуры плавления.Свойства веществ:При обычных
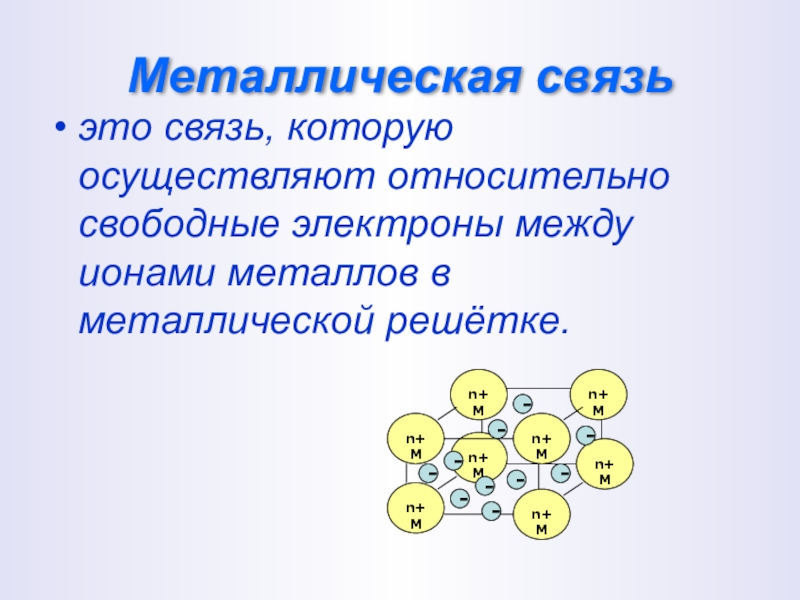
- 22. Металлическая связьэто связь, которую осуществляют относительно свободные
- 23. Механизм образования металлической связи:
- 24. Слайд 24
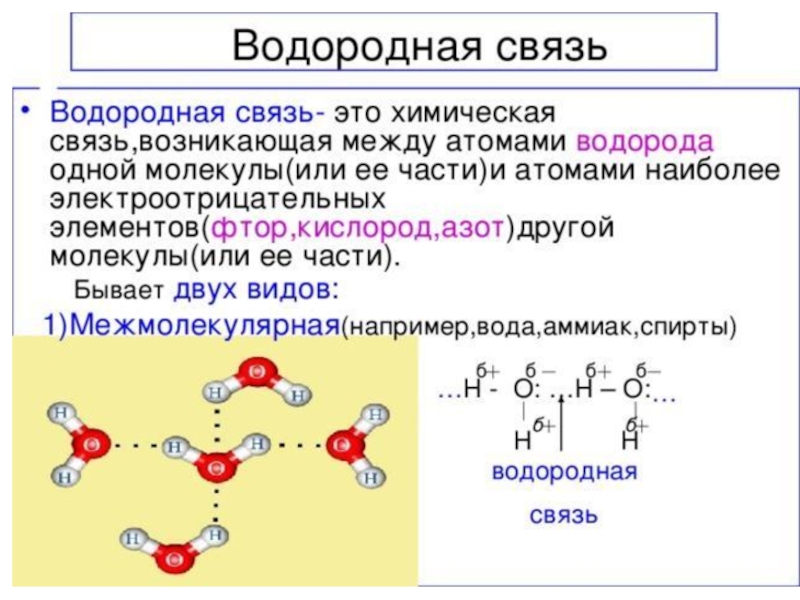
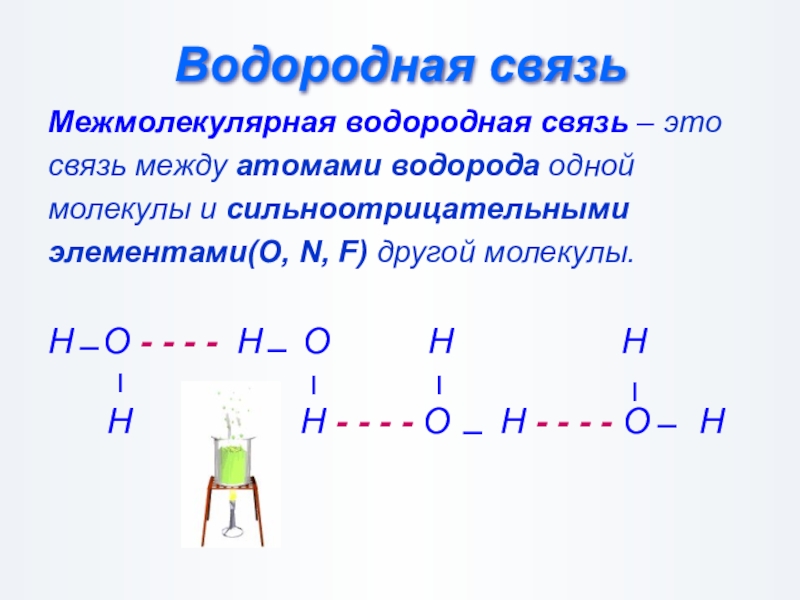
- 25. Водородная связьМежмолекулярная водородная связь – этосвязь между
- 26. Водородная связьВнутримолекулярная водородная связь – эта связь
- 27. Задание «Крестики-нолики»Соедините прямой линией три клетки, которые содержат формулы веществ с типом химической связи:а) ковалентная неполярная
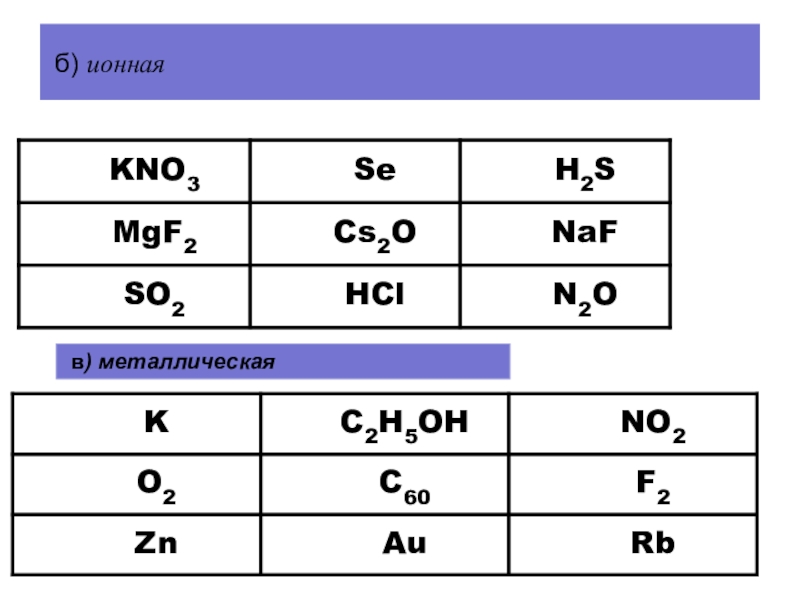
- 28. б) ионнаяв) металлическая
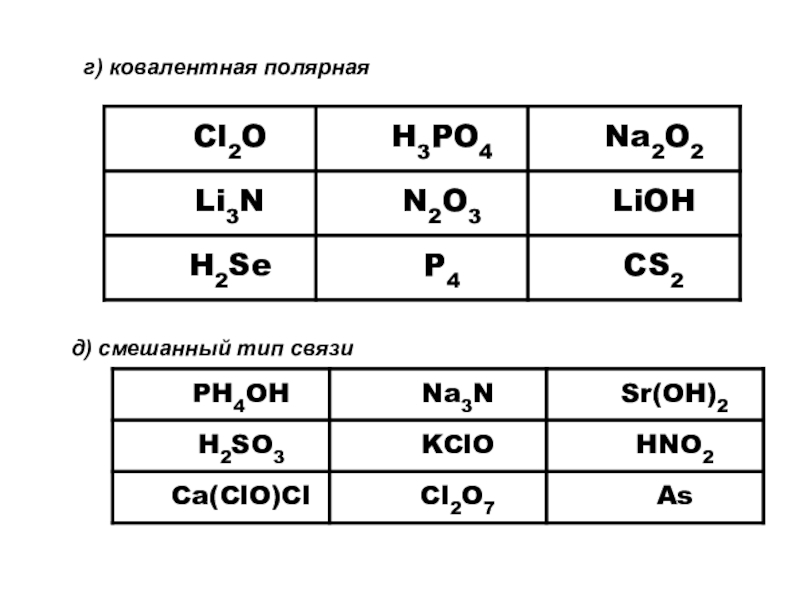
- 29. г) ковалентная полярнаяд) смешанный тип связи
- 30. ОтветыОтвет:Cl2 – I2 – O3 Ответ: MgF2
- 31. Задание «Кто точнее»Определите по формуле вещества тип химической связи, используя обозначения, приведенные ниже.
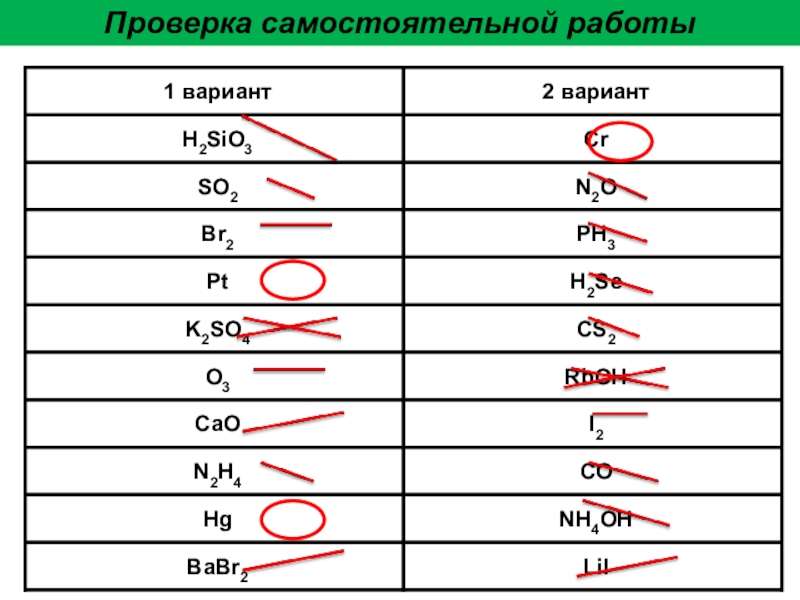
- 32. Проверка самостоятельной работы
- 33. Подведение итогов урокаНа уроке я узналВыполнил ____________заданийНе понял___________Было интересно:
- 34. Домашнее задание параграф6 №3,4 параграф 7№2,3Тест I
- 35. Тесты04. К соединениям с ионным типом связи
- 36. тесты08. Отметьте группу, в которой перечислены ТОЛЬКО
- 37. Тест III уровня подготовка к одимпиаде
- 38. тесты13. Ни одна из связей в молекуле
- 39. тесты15. Отметьте истинное утверждение: а) в молекуле N2 нет
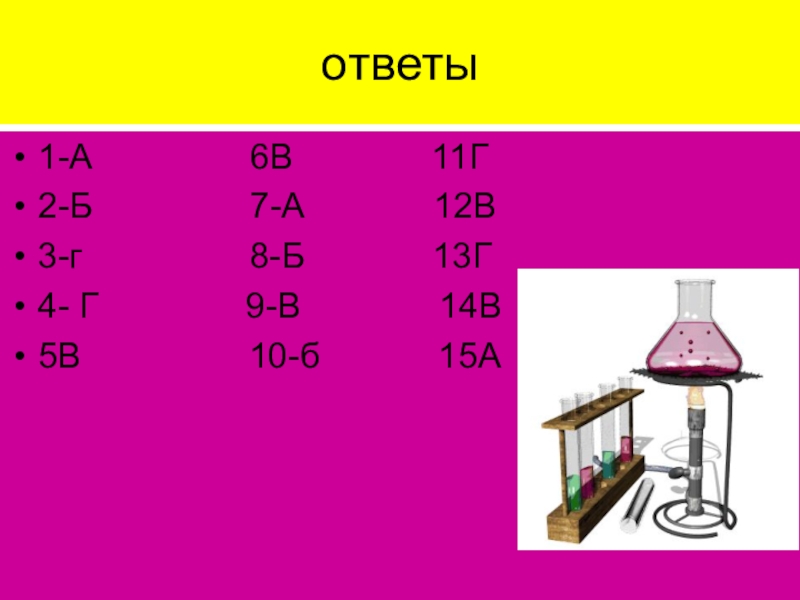
- 40. ответы1-А
- 41. Спасибо за внимание !
- 42. Молодцы !Спасибо за урок!
Слайд 2ЭПИГРАФ
Чтобы достигнуть знания, нужно исследовать сущность вещей; поэтому, кто желает обрести
Слайд 3
дать определение химической связи;
познакомиться с различными типами химической связи;
научиться определять тип
Задачи урока:
Слайд 4 Причиной образования химической связи является стремление системы к минимуму энергии:
Происходит уменьшение энергии на величину энергии связи(Есв.).
Энергия связи (Есв.)- энергия, необходимая для разрушения этой связи.
Слайд 5ХИМИЧЕСКАЯ СВЯЗЬ – ЭТО СВЯЗЬ МЕЖДУ ХИМИЧЕСКИМИ ЧАСТИЦАМИ (АТОМНЫМИ ЧАСТИЦАМИ, МОЛЕКУЛАМИ,
Химическая связь – это взаимодействие атомных частиц, сопровождающееся перестройкой электронных оболочек (орбиталей), как правило, ВЭУ.
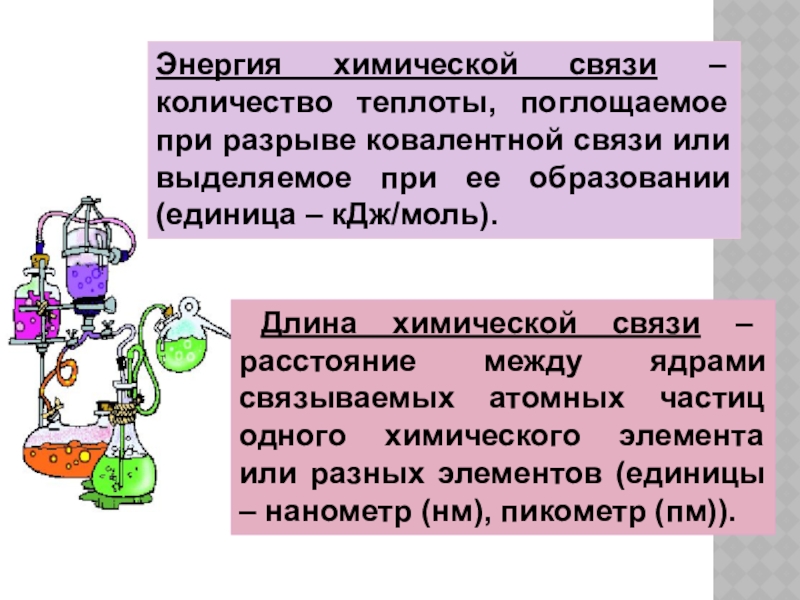
Слайд 6Энергия химической связи – количество теплоты, поглощаемое при разрыве ковалентной связи
Длина химической связи – расстояние между ядрами связываемых атомных частиц одного химического элемента или разных элементов (единицы – нанометр (нм), пикометр (пм)).
Слайд 7Различают четыре типа химических связей:
Ионная связь.
Ковалентная связь.
Металлическая связь.
Водородная связь.
Рис.1
Слайд 8Выполните упражнение №1
Из предложенного списка распределите формулы веществ
в таблице по соответствующим
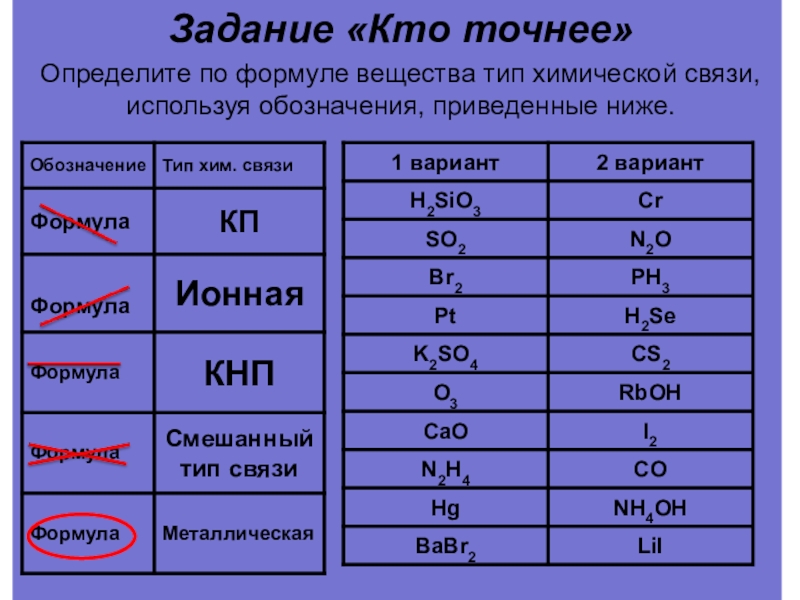
PCl 5, CH 4 , Fe, O2, P2O5, HF, CsF, Cu2O, KCl, N2, P4, FeO
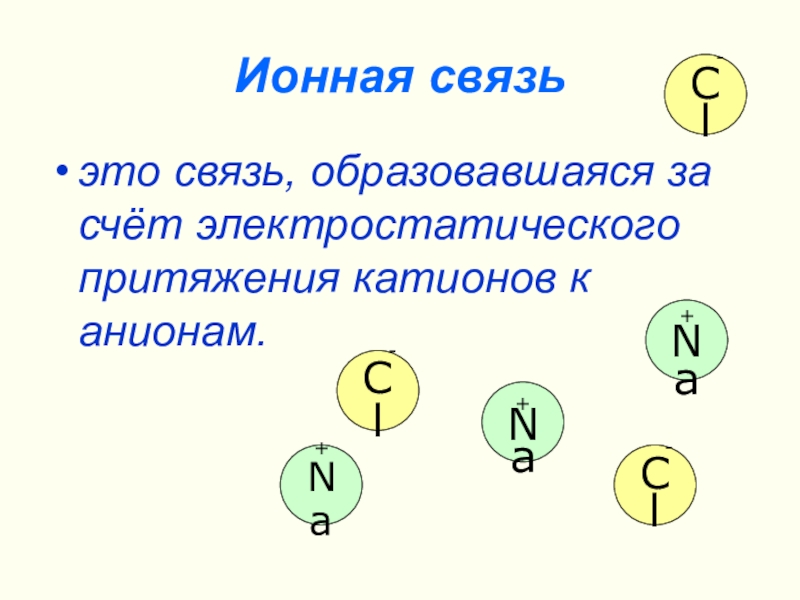
Слайд 9Ионная связь
это связь, образовавшаяся за счёт электростатического притяжения катионов к анионам.
+
Na
-
Cl
+
Na
-
Cl
+
Na
-
Cl
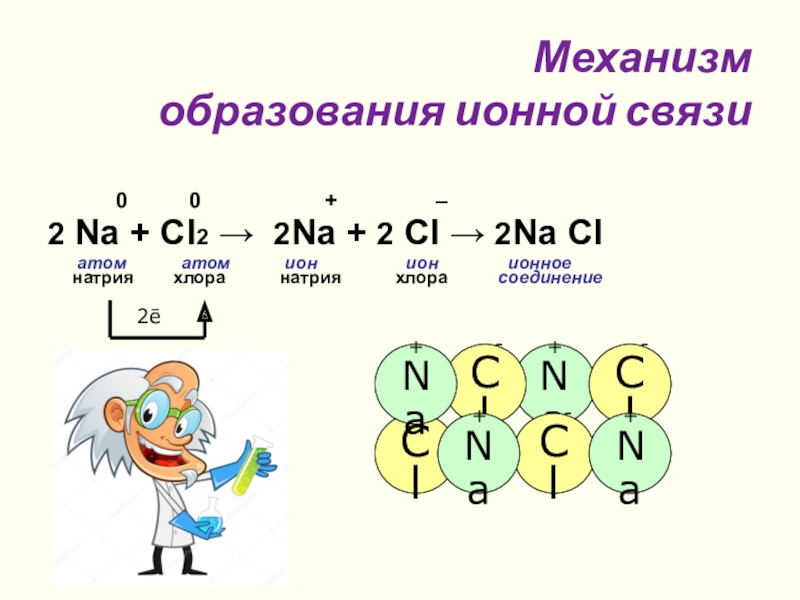
Слайд 11 Механизм
образования ионной связи
0 0 + –
2 Na + Cl2 → 2Na + 2 Cl → 2Na Cl
атом атом ион ион ионное
натрия хлора натрия хлора соединение
2ē
+
Na
-
Cl
-
Cl
-
Cl
-
Cl
+
Na
+
Na
+
Na
Слайд 12Ковалентная связь
это связь, возникает между атомами за счёт образования общих электронных
ē
ē
ē
ē
ē
ē
Слайд 13Схема 2
обменный
донорно-
акцепторный
полярная
неполярная
σσ (сигма) –
связь
ππ (π (пиπ (пи)π (пи) – связь
простая
двойная
тройная
Схема
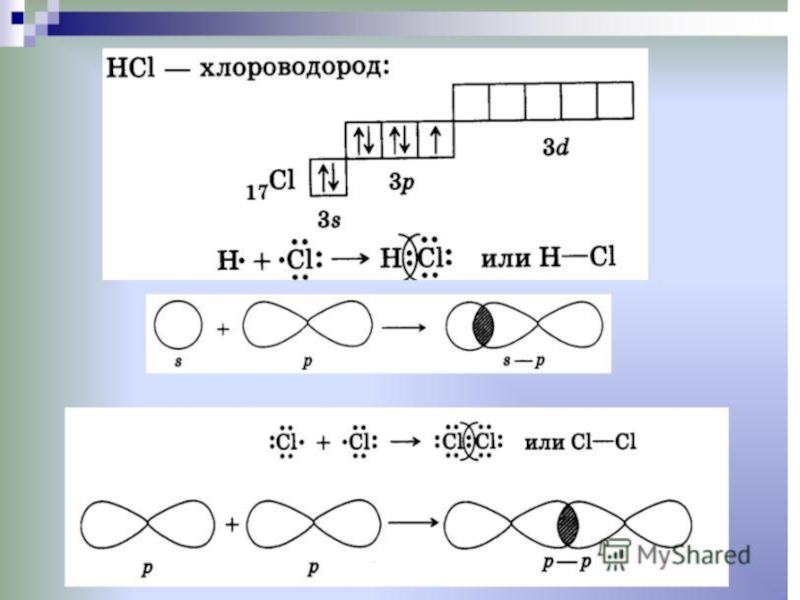
Слайд 14Обменный механизм образования ковалентной связи
☼ Действует, когда атомы образуют общие
Например:
Н2 – водород Н• + •Н → Н ׃ Н или Н - Н ;
НCl – хлороводород или соляная кислота
Н• + • Cl → Н Cl или H – Cl ;
3. N2 – азот N • + • N → N N или N N.
••
••
••
••
••
••
••
••
••
•••
•
•
•
•
•••
••
••
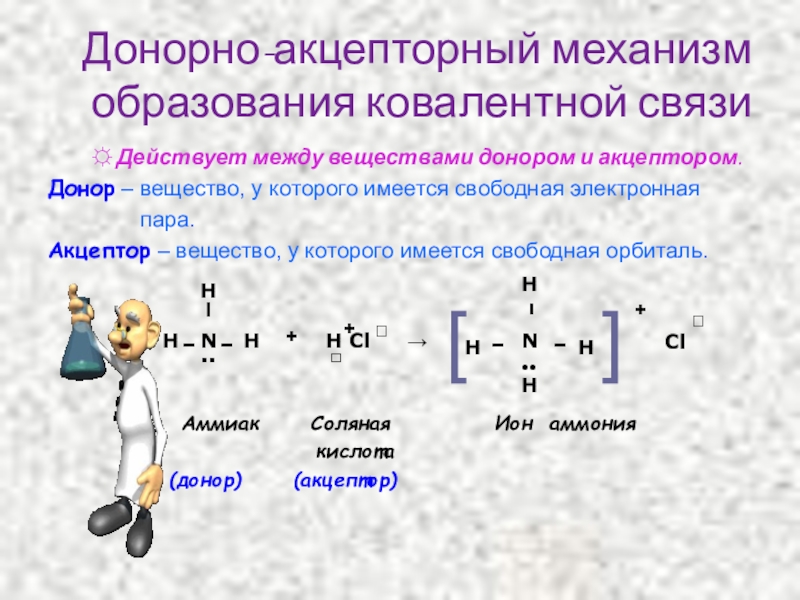
Слайд 16Донорно-акцепторный механизм образования ковалентной связи
☼ Действует между
Донор – вещество, у которого имеется свободная электронная
пара.
Акцептор – вещество, у которого имеется свободная орбиталь.
Аммиак Соляная Ион аммония
кислота
(донор) (акцептор)
Н
Н
N
H
..
-
-
І
+
H Cl
□
→
+
[ ]
-
-
-
H
H
H
H
N
••
+
Cl
Слайд 17Степень смещения электронных пар
☼Зависит от ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ элементов.
Ряд электроотрицательности: F, O,
НЕПОЛЯРНАЯ ковалентная связь – это связь, образованная
между атомами с одинаковой электроотрицательностью.
Например : H – H; Cl – Cl; N N.
ПОЛЯРНАЯ ковалентная связь – это связь, образованная между
атомами с разной электроотрицательностью.
Например: H – Cl; H – S – H.
ІІІ
Слайд 18Кратность ковалентной связи
☼Зависит от числа общих электронных пар, связывающих атомы.
Бывает:
ПРОСТАЯ
ДВОЙНАЯ « » - это одна σ-связь и одна
π-связь;
3. ТРОЙНАЯ « » - это одна σ-связь и две
π- связи.
ІІ
ІІІ
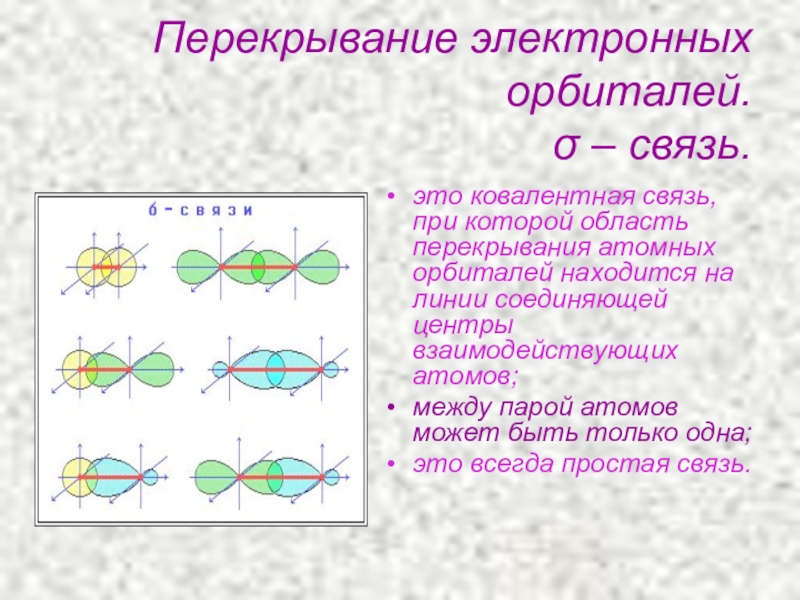
Слайд 19Перекрывание электронных орбиталей.
σ – связь.
это ковалентная связь, при которой область перекрывания
между парой атомов может быть только одна;
это всегда простая связь.
Слайд 20Перекрывание электронных орбиталей.
π – связь.
это ковалентная связь, при которой область перекрывания
между парой атомов может только дополнять σ – связь.
Слайд 21Свойства веществ:
Твердые;
Имеют высокие температуры плавления.
Свойства веществ:
При обычных условиях вещества газообразные (H2,
Большинство веществ сильно летучие, т.е. имеют низкие to кипения и плавления;
Растворы и расплавы не проводят электрический ток.
Слайд 22Металлическая связь
это связь, которую осуществляют относительно свободные электроны между ионами металлов
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
n+
M
-
-
-
-
-
-
-
-
-
-
Слайд 23Механизм
образования металлической связи:
М - nē = М
Например:
для элементов (металлов) Ι группы главной
0 1+
подгруппы М - 1ē = М ;
для элементов (металлов) Ι Ι группы главной
0 2+
подгруппы М - 2ē = М .
Слайд 25Водородная связь
Межмолекулярная водородная связь – это
связь между атомами водорода одной
молекулы и
элементами(O, N, F) другой молекулы.
Н О - - - - Н О Н Н
Н Н - - - - О Н - - - - О Н
|
|
|
|
|
|
|
|
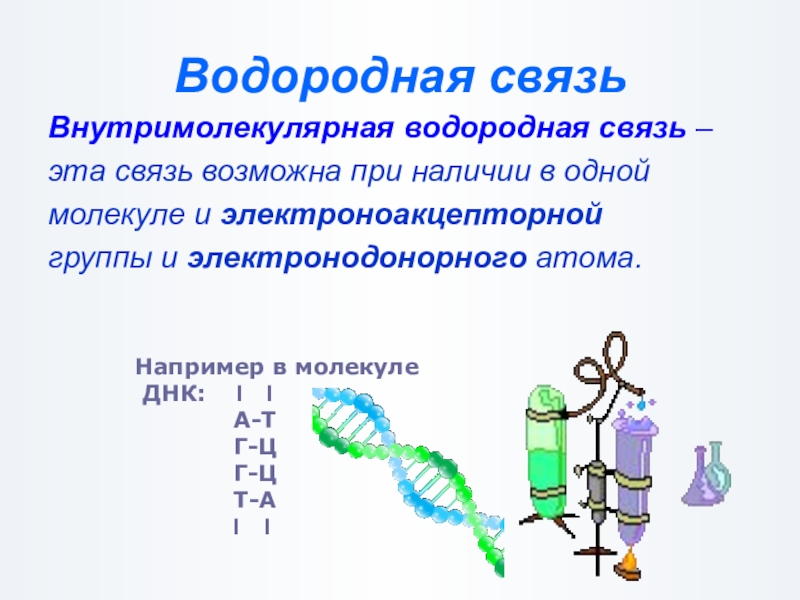
Слайд 26Водородная связь
Внутримолекулярная водородная связь –
эта связь возможна при наличии в
молекуле и электроноакцепторной
группы и электронодонорного атома.
Например в молекуле
ДНК: І І
А-Т
Г-Ц
Г-Ц
Т-А
І І
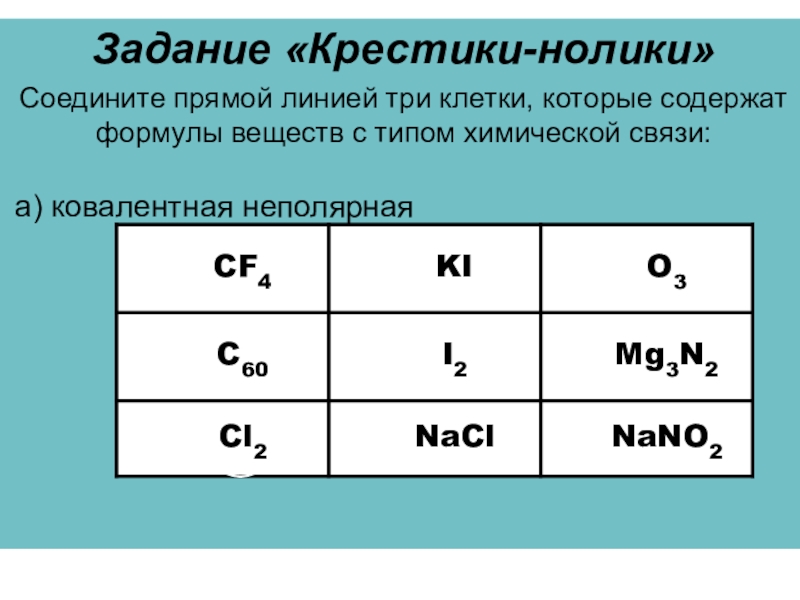
Слайд 27Задание «Крестики-нолики»
Соедините прямой линией три клетки, которые содержат формулы веществ с
а) ковалентная неполярная
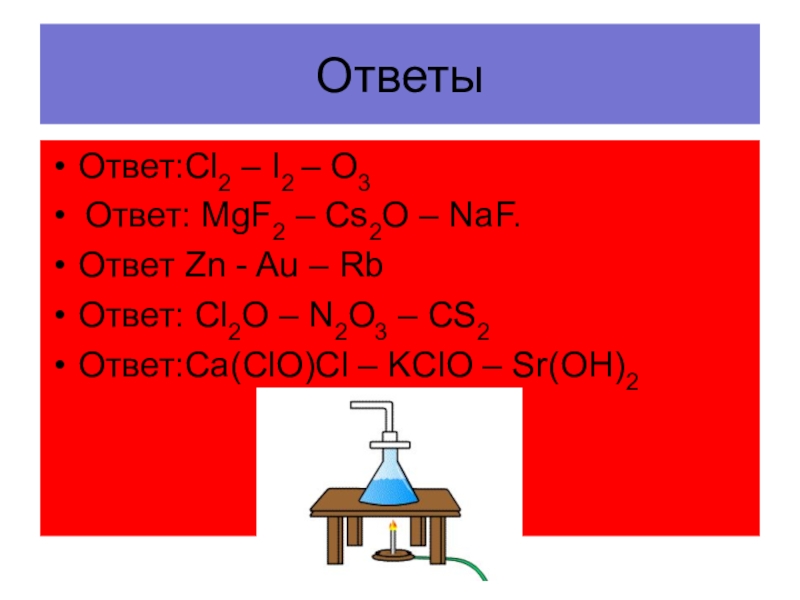
Слайд 30Ответы
Ответ:Cl2 – I2 – O3
Ответ: MgF2 – Cs2O – NaF.
Ответ
Ответ: Cl2O – N2O3 – CS2
Ответ:Ca(ClO)Cl – KClO – Sr(OH)2
Слайд 31Задание «Кто точнее»
Определите по формуле вещества тип химической связи, используя обозначения,
Слайд 33Подведение итогов урока
На уроке я узнал
Выполнил ____________заданий
Не понял___________
Было интересно:
Слайд 34Домашнее задание
параграф6 №3,4
параграф 7№2,3
Тест I уровня (совсем легкий)
01. Соединением с ионным
а) хлорид кальция; б) оксид серы (IV); в) азот; г) вода.
02. В сероводороде (H2S) химическая связь:
а) ковалентная неполярная; б) ковалентная полярная; в) ионная; г) металлическая.
03. Примером вещества с металлическим типом связи является:
а) хлорид меди (II); б) оксид меди (II); в) сульфат меди (II); г) медь.
Слайд 35Тесты
04. К соединениям с ионным типом связи относятся:
а) все простые вещества
а) HCl; б) Cl2O; в) Cl2; г) KCl.
Тест II уровня для отличников
06. Рассматривается группа веществ: BaO, NH3, MgF2, Li. Количество веществ с ионным типом связи в данной группе равно:
а) 0; б) 1; в) 2; г) 3.
07. Водородная связь может возникнуть между молекулами следующего соединения:
а) C2H5OH; б) C2H6; в) CH3OCH3; г) C2H5Cl.
Слайд 36тесты
08. Отметьте группу, в которой перечислены ТОЛЬКО вещества с ковалентным типом
а) ацетон, оксид магния, сульфат хрома (III); б) озон, 2-метилпропановая кислота, оксид хлора (VII); в) вода, иодоводород, ртуть; г) хлорид цезия, водород, бензол. 09. По донорно-акцепторному механизму возникает одна из связей в:
а) азоте; б) железе; в) ионе аммония; г) ионе кальция. 10. Химическая связь в оксиде рубидия и оксиде углерода (IV) соответственно:
а) ионная и ковалентная неполярная; б) ионная и ковалентная полярная; в) ковалентная полярная и ионная; г) металлическая и ковалентная полярная.
Слайд 37
Тест III уровня подготовка к одимпиаде
11. Отметьте истинное утверждение:
а) между молекулами
а) 2-нитрофенол; б) ДНК носорога; в) пара-крезол; г) гемоглобин.
Слайд 38тесты
13. Ни одна из связей в молекуле этого вещества НЕ образована
а) оксид углерода (II); б) азотная кислота; в) хлорид диметиламмония; г) диметиловый эфир. 14. Из приведенных ниже утверждений выберите ложное:
а) для металлов характерно отсутствие промежутка между валентной зоной и зоной проводимости, для полупроводников - наличие небольшого промежутка; б) парамагнитные свойства молекулярного кислорода невозможно объяснить, используя метод валентных связей, но данные свойства легко объясняются с привлечением теории молекулярных орбиталей; в) кислота Льюиса - это донор электронной пары, основание Льюиса - акцептор электронной пары; г) для гексафторида серы характерна sp3d2-гибридизация центрального атома.