- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Периодический закон и Периодическая система Д. И. Менделлева
Содержание
- 1. Презентация к уроку Периодический закон и Периодическая система Д. И. Менделлева
- 2. Цель: раскрыть смысл и осмыслить закономерности Периодического
- 3. Что такое химический элемент?Ответ: Вид атомов, обладающих одинаковыми свойствами
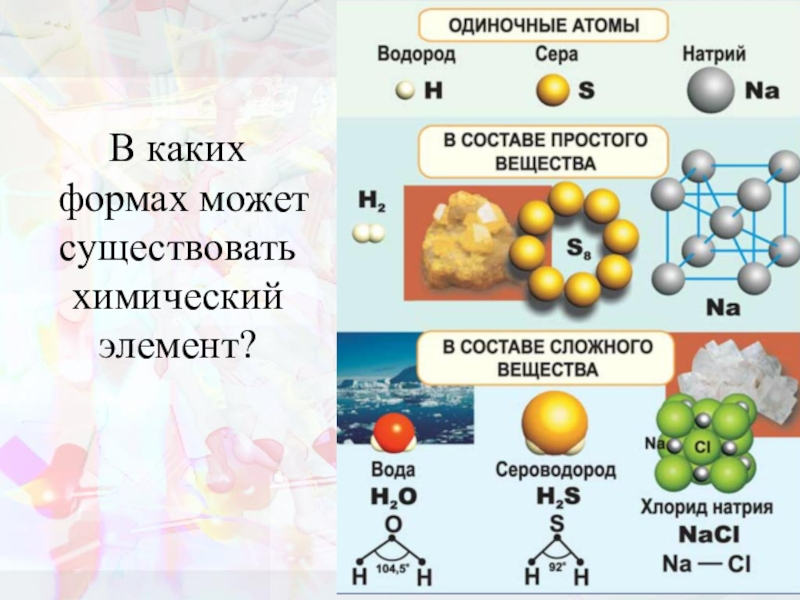
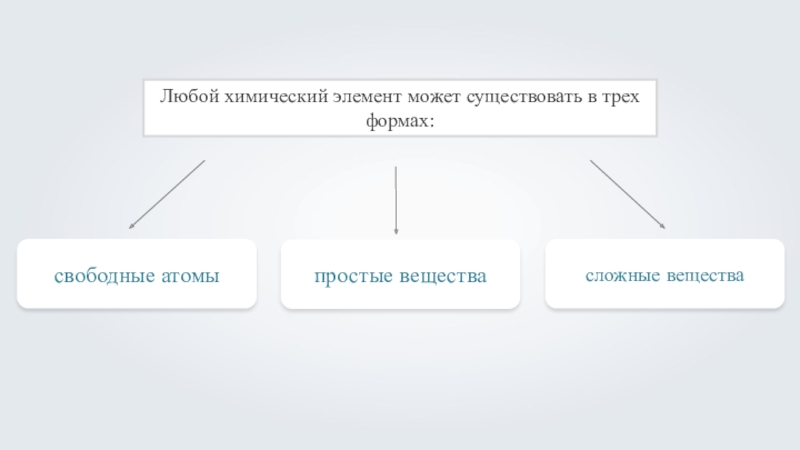
- 4. В каких формах может существовать химический элемент?
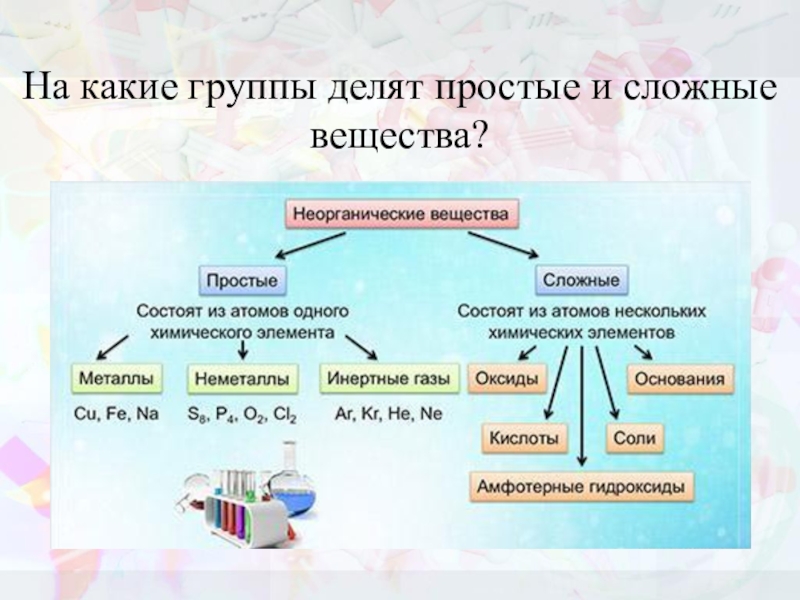
- 5. На какие группы делят простые и сложные вещества?
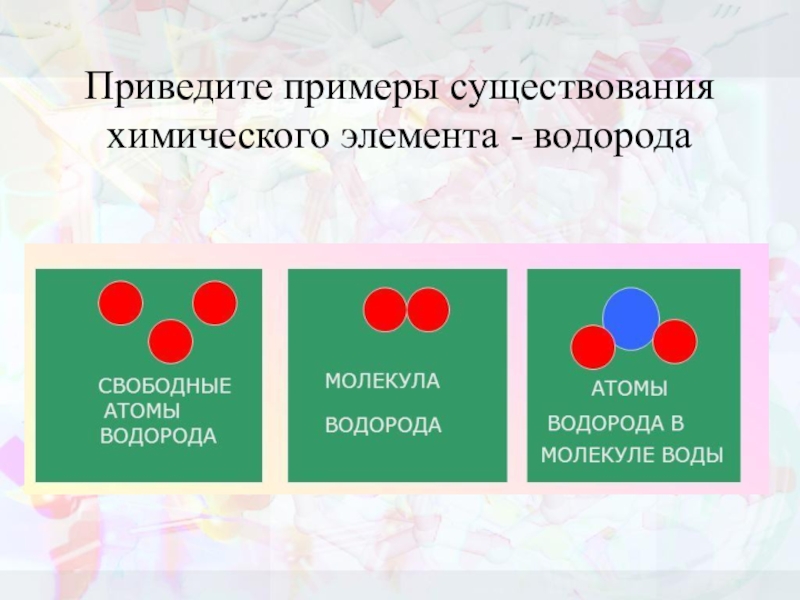
- 6. Приведите примеры существования химического элемента - водорода
- 7. Какие Вы знаете количественные характеристики атомов?ВалентностьОтносительная атомная масса
- 8. Что такое валентность?
- 9. Что показывает атомная масса?
- 10. Слайд 10
- 11. Слайд 11
- 12. История открытия. ПредшественникиПравило триад Дёберейнера (1829 г.)Если
- 13. Спираль ШанкуртуаАлександр Эмиль Бегуйе де Шанкуртуа,1820-1886
- 14. Закон октав НьюлендсаВ 1865 г. Ньюлендс опубликовал таблицу
- 15. Таблица Мейера 1864 г. Мейер опубликовал таблицу из
- 16. МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907) Открыл (1869) периодический закон
- 17. Слайд 17
- 18. Формулировка Д. И. Менделеева«Свойства элементов, а потому
- 19. Слайд 19
- 20. Свойства простых веществ и соединений, которые они
- 21. Слайд 21
- 22. Спасибо за урок!
Слайд 2Цель: раскрыть смысл и осмыслить закономерности Периодического закона и периодической системы
Задачи:
Рассмотреть предпосылки открытия периодического закона.
Изучить периодический закон, его значение и историю его развития.
Рассмотреть периодическую систему химических элементов Д. И. Менделеева как графическое выражение фундаментального закона природы – Периодического закона.
Слайд 12История открытия. Предшественники
Правило триад Дёберейнера
(1829 г.)
Если расположить три сходных по
Литий Li: Ar(Li) = 6,941 а.е.м.
Натрий Na: Ar(Na) = 22,99 а.е.м.
Калий K: Ar(K) = 39,102 а.е.м
Ar(Na) = ½ (Ar(Li) + Ar(K)) ≈ 23,0 а.е.м.
Иоганн Вольфганг Дёберейнер,
1780-1849
Слайд 13Спираль Шанкуртуа
Александр Эмиль Бегуйе де Шанкуртуа,
1820-1886
«Земная спираль» Шанкуртуа
На боковую поверхность цилиндра, разделенную на 16 частей, нанесена линия под углом 45°, на которой отмечены точки, соответствующие атомным весам элементов.
Сходные по свойствам элементы группируются на одной вертикальной линии.
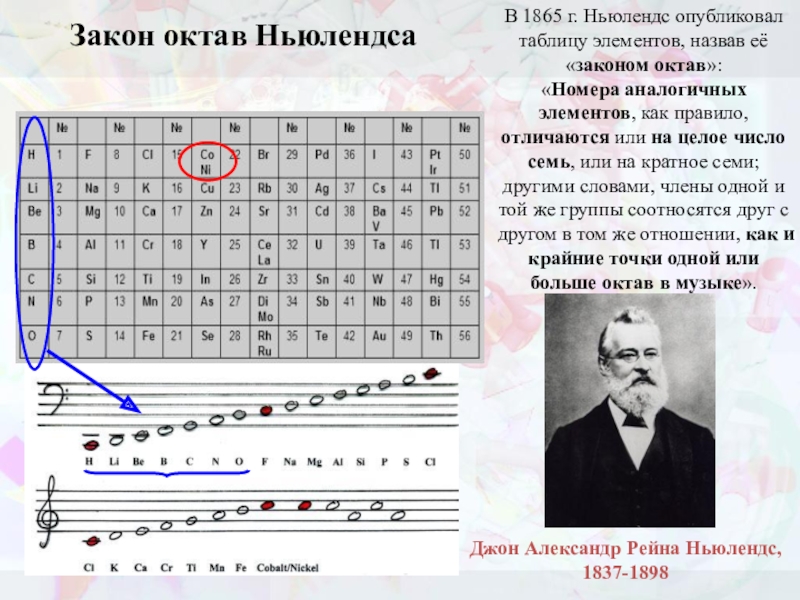
Слайд 14Закон октав Ньюлендса
В 1865 г. Ньюлендс опубликовал таблицу элементов, назвав её «законом
«Номера аналогичных элементов, как правило, отличаются или на целое число семь, или на кратное семи; другими словами, члены одной и той же группы соотносятся друг с другом в том же отношении, как и крайние точки одной или больше октав в музыке».
Джон Александр Рейна Ньюлендс, 1837-1898
Слайд 15Таблица Мейера
1864 г. Мейер опубликовал таблицу из 28 элементов, группируя их
Он ограничил число элементов, чтобы подчеркнуть закономерное изменение атомной массы в рядах подобных элементов
Таблица 1870 г. состояла из девяти столбцов
Некоторые ячейки таблицы Мейер оставил незаполненными
Юлиус Лотар Мейер,
1830-1895
Таблица Мейера 1864 г. (фрагмент)
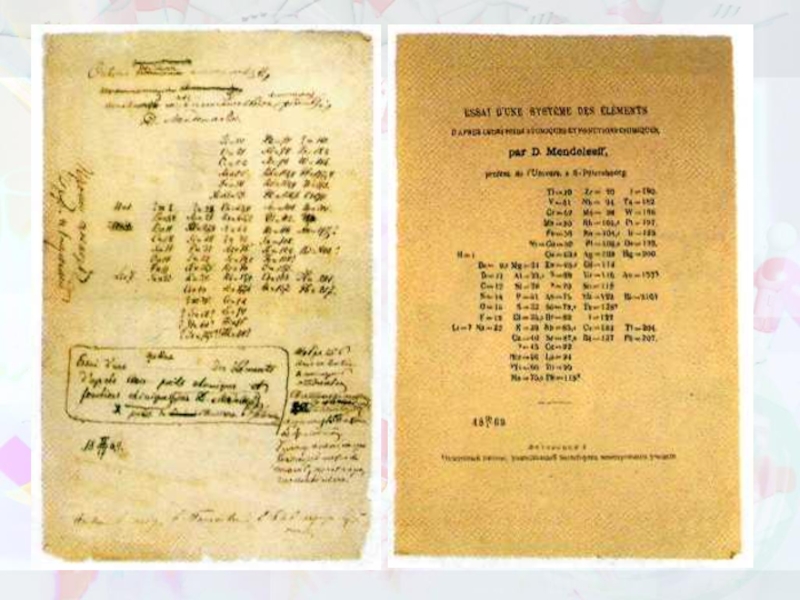
Слайд 16МЕНДЕЛЕЕВ Дмитрий Иванович (1834-1907)
Открыл (1869) периодический закон химических элементов — один
Оставил св. 500 печатных трудов, среди которых классические «Основы химии» (ч. 1-2, 1869-71, 13 изд., 1947) — первое стройное изложение неорганической химии.
Автор фундаментальных исследований по химии, химической технологии, физике, метрологии, воздухоплаванию, метеорологии, сельскому хозяйству, экономике, народному просвещению и др.
Заложил основы теории растворов, предложил промышленный способ фракционного разделения нефти, изобрел вид бездымного пороха, пропагандировал использование минеральных удобрений, орошение засушливых земель.
Один из инициаторов создания Русского химического общества (1868). Профессор Петербургского университета (1865-90), ушел в отставку в знак протеста против притеснения студенчества.
Организатор и первый директор (1893) Главной палаты мер и весов (ныне ВНИИ метрологии им. Менделеева).
Слайд 18
Формулировка Д. И. Менделеева
«Свойства элементов, а потому и свойства образуемых ими
Современный перевод
«Свойства простых веществ, а так же состав и свойства соединений элементов находятся в периодической зависимости от относительных атомных масс».
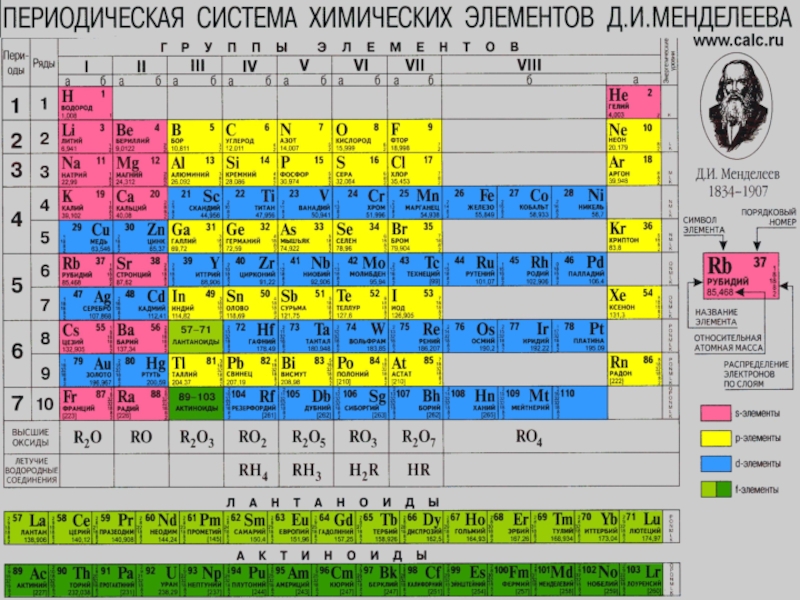
Периодический закон Д. И. Менделеева
Слайд 20Свойства простых веществ и соединений, которые они образуют, находятся в периодической
В основу современной классификации элементов положен главный признак – электронная конфигурация атомов.
Периодический закон был сформулирован почти за полстолетия до открытия электрона.
Периодический закон Д. И. Менделеева