- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Диссоциация кислот, щелочей и оснований
Содержание
- 1. Презентация Диссоциация кислот, щелочей и оснований
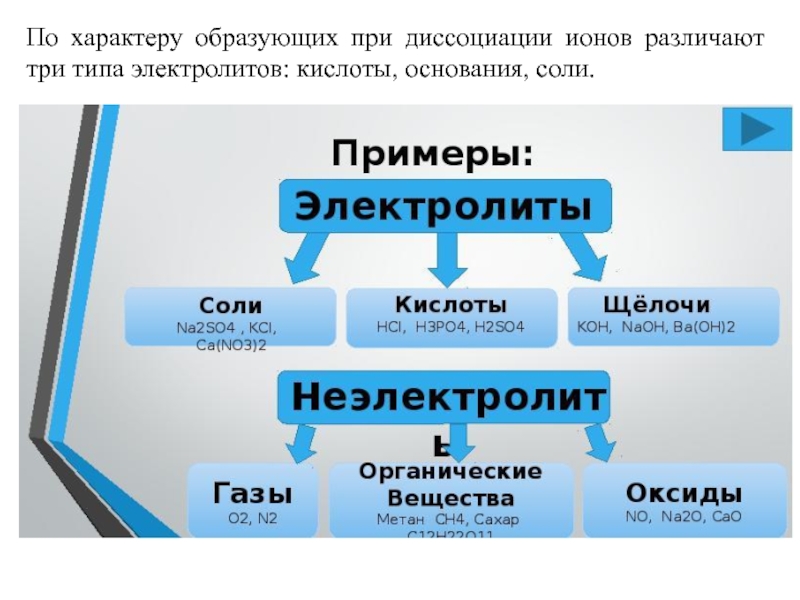
- 2. По характеру образующих при диссоциации ионов различают три типа электролитов: кислоты, основания, соли.
- 3. Кислоты – это электролиты, которые при диссоциации
- 4. Например,HCl -> H + + Cl -HNO 3 -> H + + NO 3 -Многоосновные кислоты
- 5. Основания – это электролиты, которые при диссоциации
- 6. Слайд 6
- 7. Соли – это электролиты которые при диссоциации
- 8. Составьте возможные уравнения электролитической диссоциации веществ в
По характеру образующих при диссоциации ионов различают три типа электролитов: кислоты, основания, соли.
Слайд 2По характеру образующих при диссоциации ионов различают три типа электролитов: кислоты,
основания, соли.
Слайд 3Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и
анионы кислотного остатка.
Составим уравнение электролитической диссоциации сильных кислот:
HCl ↔ H+ + Cl-
H2SO4 ↔ 2H+ + SO42-
Слабые многоосновные кислоты диссоциируют ступенчато. Число ступеней зависит от основности слабой кислоты Hx(Ac), где х – основность кислоты. Например,
H2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-
Слайд 4Например,
HCl -> H + + Cl -
HNO 3 -> H + + NO 3 -
Многоосновные кислоты диссоциируют ступенчато :
Н3РО4 ↔ Н+ + Н2РО-4 (первая
ступень) – дигидроортофосфат ион
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Н2РО-4 ↔ Н+ + НРO2-4 (вторая ступень) – гидроортофосфат ион
НРО2-4 ↔ Н+ + PОЗ-4 (третья ступень) – ортофосфат ион
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей.
Слайд 5Основания – это электролиты, которые при диссоциации образуют катионы металла и
анионы гидрокса групп.
Составим уравнение диссоциации сильных оснований (щелочей)
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba2+ + 2OH-
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у , где у- кислотность основания.
Например,
Fe(OH)2 ↔ FeOH+ + OH-
FeOH+ ↔ Fe2+ + OH-
Составим уравнение диссоциации сильных оснований (щелочей)
NaOH ↔ Na+ + OH-
Ba(OH)2 ↔ Ba2+ + 2OH-
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у , где у- кислотность основания.
Например,
Fe(OH)2 ↔ FeOH+ + OH-
FeOH+ ↔ Fe2+ + OH-
Слайд 7Соли – это электролиты которые при диссоциации образуют катионы металла (или
аммония NH4+) и анионы кислотных остатков:
K3PO4=3K++PO43-
NH4NO3=NH4++NO3-
K3PO4=3K++PO43-
NH4NO3=NH4++NO3-
Слайд 8Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
1) HCl,
2) HNO3, 3) H2SiO3 ,
4) Ca(OH)2 , 5) KOН, 6) Fe (OH)3 ,
7) NaCl , 8) KNO3 , 9) BaSO4
4) Ca(OH)2 , 5) KOН, 6) Fe (OH)3 ,
7) NaCl , 8) KNO3 , 9) BaSO4