- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кислород
Содержание
- 1. Кислород
- 2. Кислород
- 3. Что нам известно о кислороде?
- 4. Цель урока:1.Изучить строение атома, нахождение в природе,
- 5. Джозеф Пристли Открыл кислород 1 августа 1774Пристли
- 6. М.В. ЛомоносовИстория открытияМ.В. Ломоносов дал кислороду название
- 7. По примерам этим многим Кислород везде
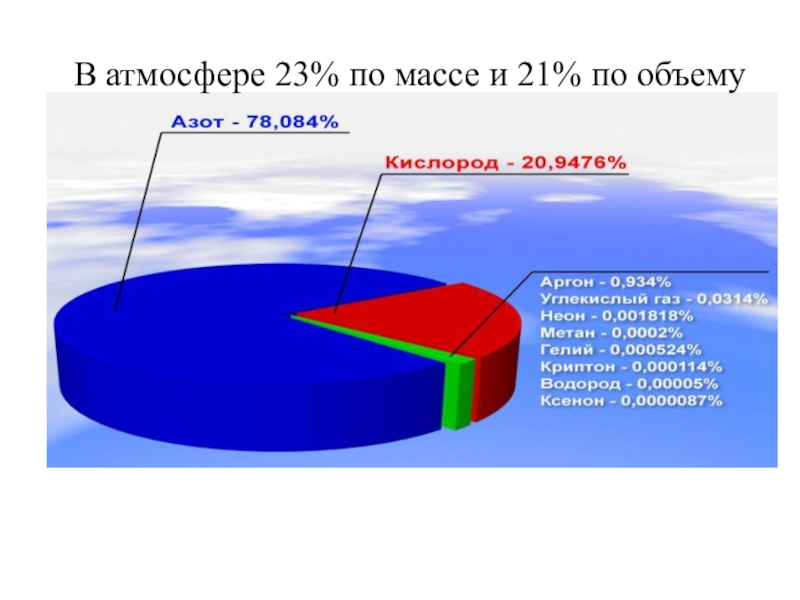
- 8. В атмосфере 23% по массе и 21% по объему
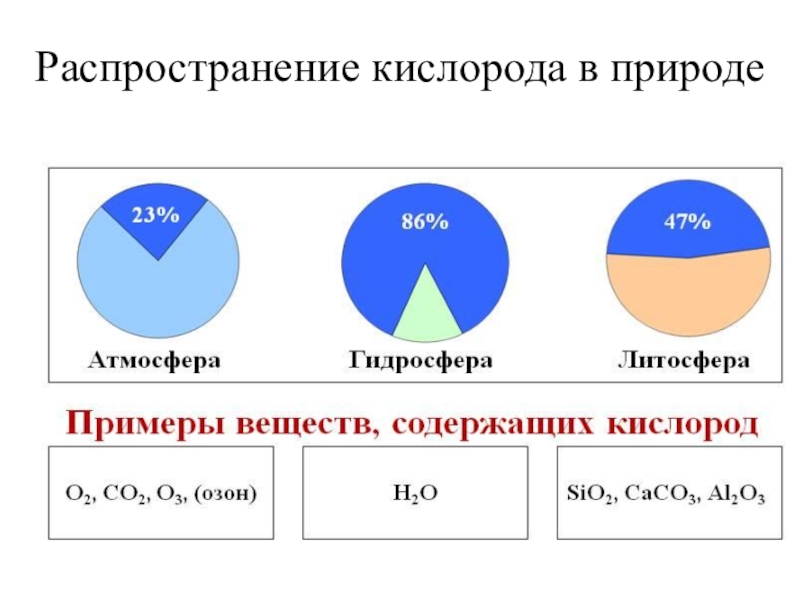
- 9. Распространение кислорода в природе
- 10. О чудо природа!Два атома легких
- 11. Входит в состав воды,которая составляетбольшую частьмассы живых организмови является внутреннейсредой клеток и тканей.Кислород как элемент
- 12. Кислород входит в составБиологически важныхмолекул, образующихживую материюКислород как элементБелкиАминокислоты и белкиуглеводыЖиры
- 13. Число нейтронов в ядре n0 =
- 14. Назовите имя элемента силача Кислород себя хвалил,Своей
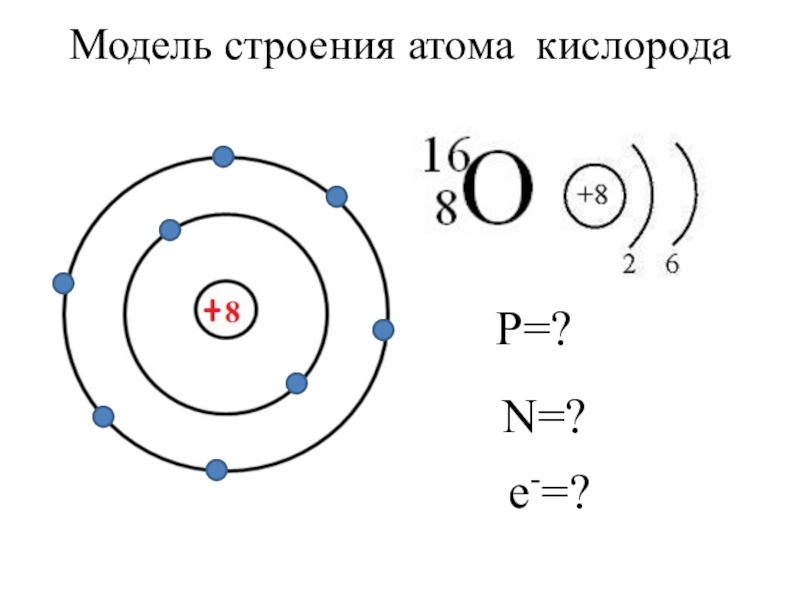
- 15. Модель строения атома кислорода Р=?N=?е-=?
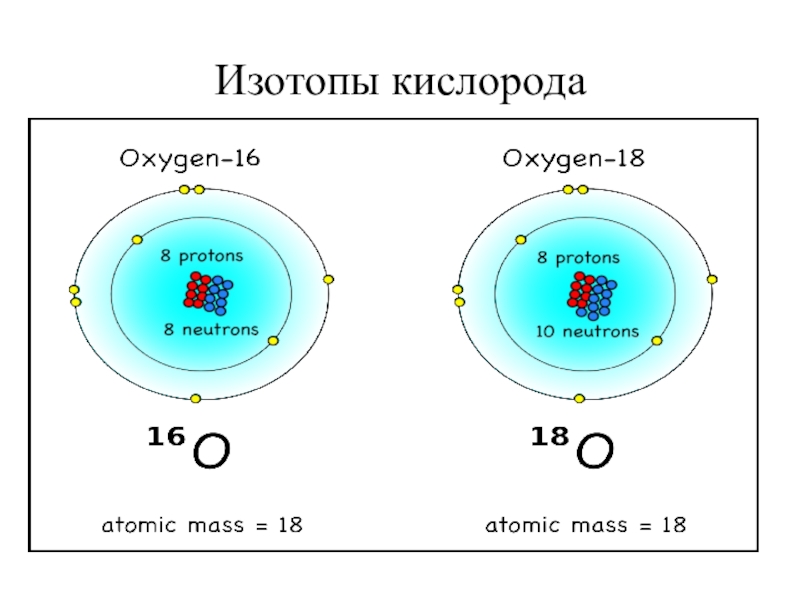
- 16. Изотопы кислорода
- 17. Кислород- простое веществоКовалентная неполярная связьO=O
- 18. Способы получения кислорода Разложение перманганата калия при
- 19. Способы собирания кислорода На каком свойстве кислорода основаны способы собирания кислорода?Как называется такой способ собирания газов?
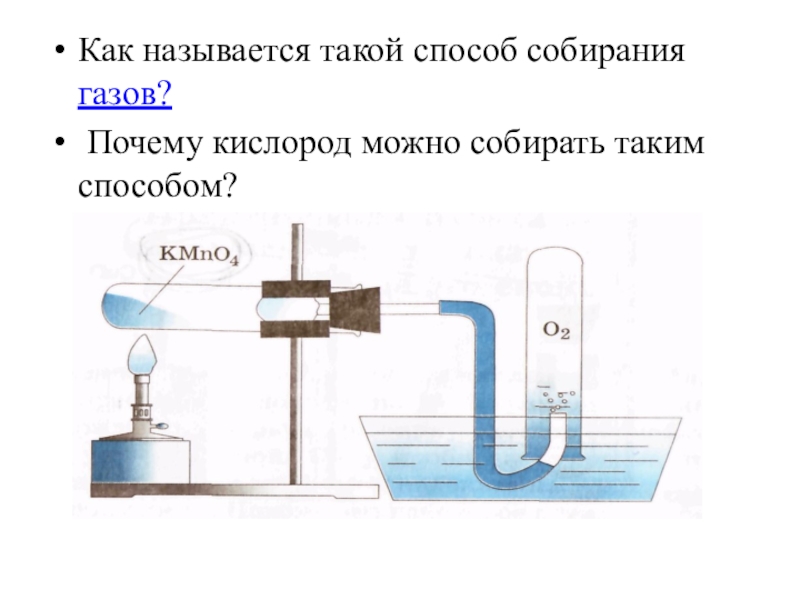
- 20. Как называется такой способ собирания газов? Почему кислород можно собирать таким способом?
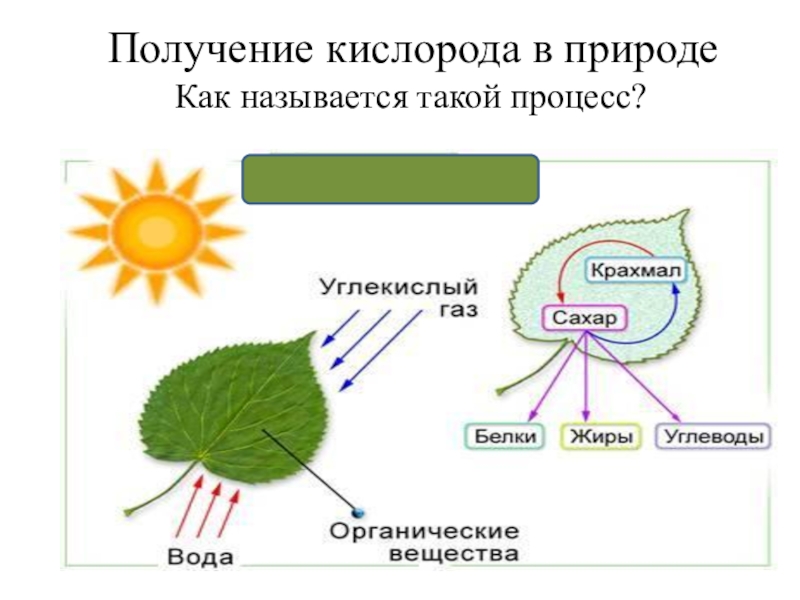
- 21. Получение кислорода в природеКак называется такой процесс?
- 22. В промышленности кислород получают из воздуха
- 23. Установка по производству кислорода из жидкого воздуха
- 24. Получение кислорода разложением воды электрическим токомНапишите уравнение происходящей при этом реакции
- 25. Получение кислорода в лаборатории 2H2O2
- 26. КислородБез……..Без………….…………………. в воде Mr =Немного тяжелеепри -183 С……….. при нормальных условиях...
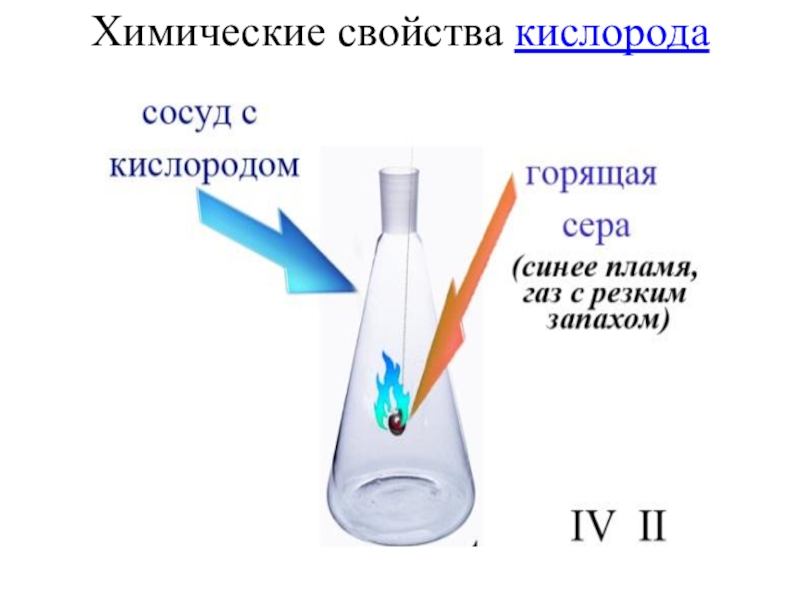
- 27. Химические свойства кислорода
- 28. Химические свойства кислорода
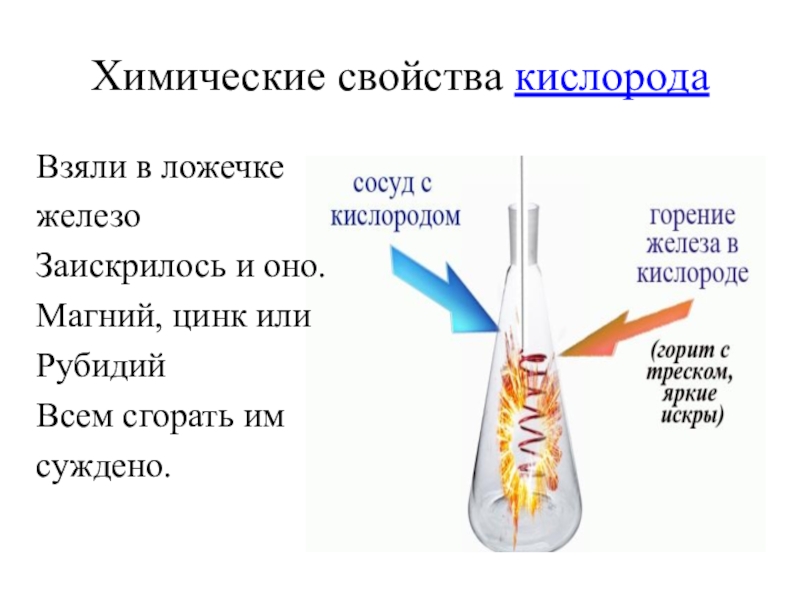
- 29. Химические свойства кислородаВзяли в ложечкежелезоЗаискрилось и оно.Магний, цинк илиРубидийВсем сгорать имсуждено.
- 30. Химические свойства кислорода
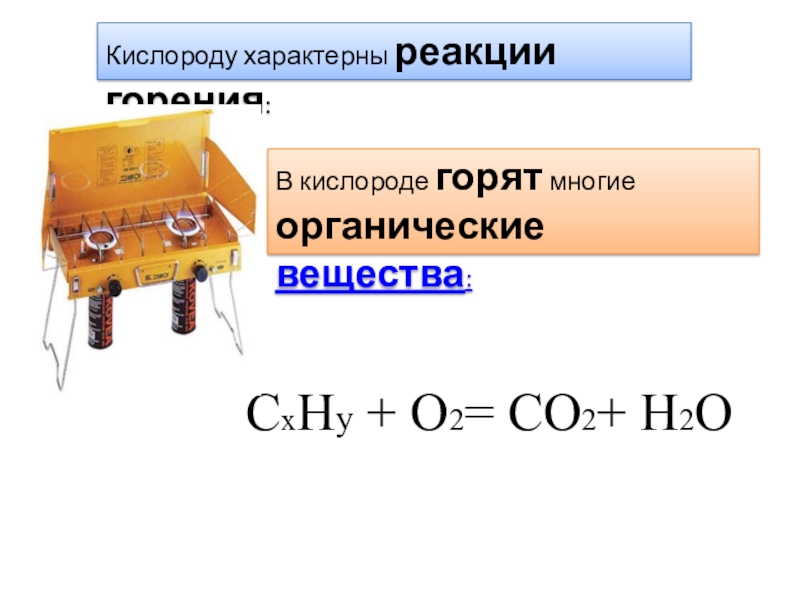
- 31. Кислороду характерны реакции горения:В кислороде горят многие органические вещества: CxHy + O2= CO2+ H2O
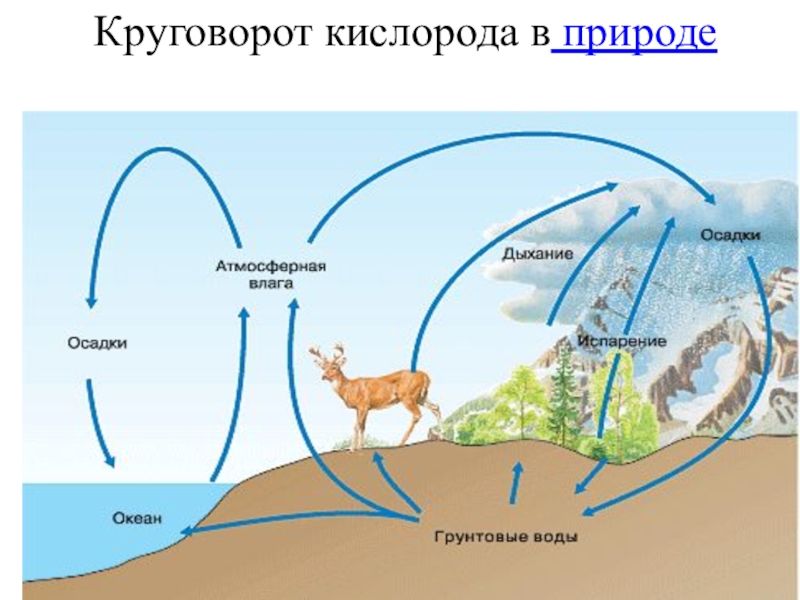
- 32. Круговорот кислорода в природе
- 33. Применение кислородаДля поддержания дыхания больных, в самолетах,
- 34. Окисление пищи – источник энергии. Кислород доставляется
- 35. Слайд 35
- 36. Аллотропия кислородаБез аллотропных проявленийНельзя представить кислород. За
- 37. Озон и кислород03 - озон обозначают, а кислород - всего
- 38. Озон- аллотропная модификация кислорода
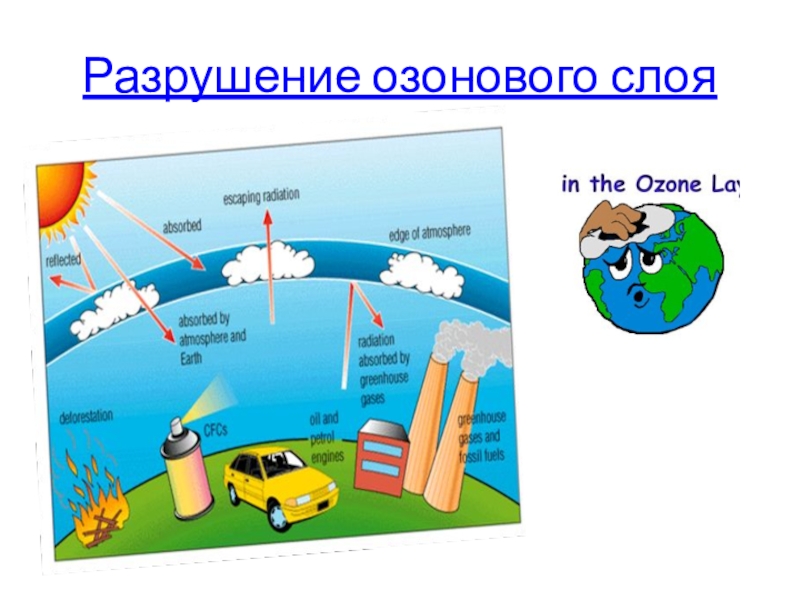
- 39. Разрушение озонового слоя
- 40. ОзонВолшебник, всех оксидов он родитель,Металлам часто портит
- 41. Озон- O3 (от греч. «озон»
- 42. Озон- O3 (от греч. «озон»
- 43. Кислород О2 и Озон О3О 3 +
- 44. недолговечен — он живет неболее получаса,
- 45. Применение озона
- 46. Применение медицинского озонаОсобенно эффективно его применение при
- 47. Применение Ozone DTA- генератора озонагенератор Ozone
- 48. Доказана высокая эффективность озонотерапии в лечении ожирения,
- 49. снижение цветности и повышение прозрачности воды; удаление привкусов
- 50. Озонирование воздуха в помещении позволяет избавиться от
- 51. Беление полотна, вместо беления на солнце, значительно
- 52. беление полотна, вместо беления на солнце, значительно
- 53. Позволяет резко снизить обсемененность поверхности плодов и овощей гнилостной микрофлорой. Озонирование плодоовощной продукции
- 54. Используется для очистки овощей , фруктов, воды, обработки мяса.Озонатор бытовой
- 55. Домашнее задание §25, № 4, 8 Поблемно- творческие задания
- 56. Кислород О2 и Озон О3
- 57. Слайд 57
Слайд 1Примерно века два назад
Открыт он был случайно.
Сейчас знаком с
И он для вас не тайна.
Известно, что горят отлично
В нем сера, фосфор, углерод,
Железо, магний.
Энергично сгорает также водород.
Без газа этого на свете
Не жили б звери и народ.
И вам теперь известно, верно? Его названье …..
Слайд 3Что нам известно о кислороде?
I.Кислород как химический элемент
Нахождение в природе
История открытия и названия элемента кислорода
Простые вещества - аллотропные модификации элемента
кислорода
II.Кислород как простое вещество
Получение
Физические свойства кислорода
Химические свойства кислорода
Применение кислорода
III.Озон- вторая аллотропная модификация кислорода
Слайд 4Цель урока:
1.Изучить строение атома, нахождение в природе, историю открытия и названия
2.Изучить свойства, получение и применение кислорода как простого вещества
Изучение кислорода как элемента и простого вещества.
Задачи:
Слайд 5Джозеф Пристли
Открыл кислород
1 августа 1774
Пристли направлял на
оксид ртути
лучи с помощью
мощной линзы
История открытия
2HgO=2Hg+O2
Слайд 6М.В. Ломоносов
История открытия
М.В. Ломоносов дал кислороду название
« кислотвор»
1775 году А.
установил, что кислород
является составной частью
воздуха, кислот и содержит-ся во многих веществах и
предложил назвать оксиген-
порождающий кислоту
А.Лавуазье
Слайд 7По примерам этим многим Кислород везде в природе, Он и в
Спирте, клее и картоне
Марганцовке, желатине,
Перекиси, аспирине,
В ванилине и крахмале –
Перечислим все едва ли.
В целлофане и капроне,
В извести, стекле, бетоне…
Он попал в кирпич, цемент-
Всюду «О» как элемент
Слайд 10 О чудо природа!
Два атома легких взяла водорода.
Прибавила атом один
И получилась частица воды,
Море воды, океаны и льды
Стал кислород чуть не всюду начинкой
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
Кислород как элемент
Слайд 11
Входит в состав воды,
которая составляет
большую часть
массы живых организмов
и является внутренней
средой
Кислород как элемент
Слайд 12 Кислород входит в состав
Биологически важных
молекул, образующих
живую материю
Кислород как элемент
Белки
Аминокислоты и
углеводы
Жиры
Слайд 13Число нейтронов в ядре n0 = (n0 = Ar- p+)
Общее
№ группы подгруппа
Число е- на внешнем слое
Максимальная степень окисления +
Минимальная степень окисления –
Кислород
O
Число протонов в ядре р+ =
№ периода
Относительная атомная масса Ar =
Слайд 14Назовите имя элемента силача
Кислород себя хвалил,
Своей силой всех дивил.
Я любого,
Захвачу себе в оксид.
Похвалялся, похвалялся,
Сам на удочку попался
К элементу силачу.
Имя знать его хочу
Слайд 18Способы получения кислорода
Разложение перманганата калия при нагревании:
2KMnO4 –t200
Нагрев KMnO4 Проверка собравшегося
кислорода
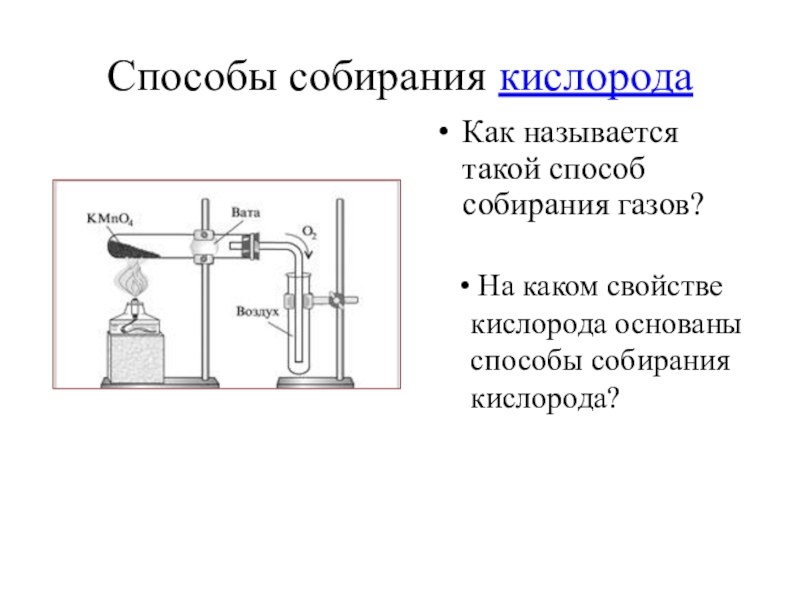
Слайд 19Способы собирания кислорода
На каком свойстве кислорода основаны способы собирания кислорода?
Как
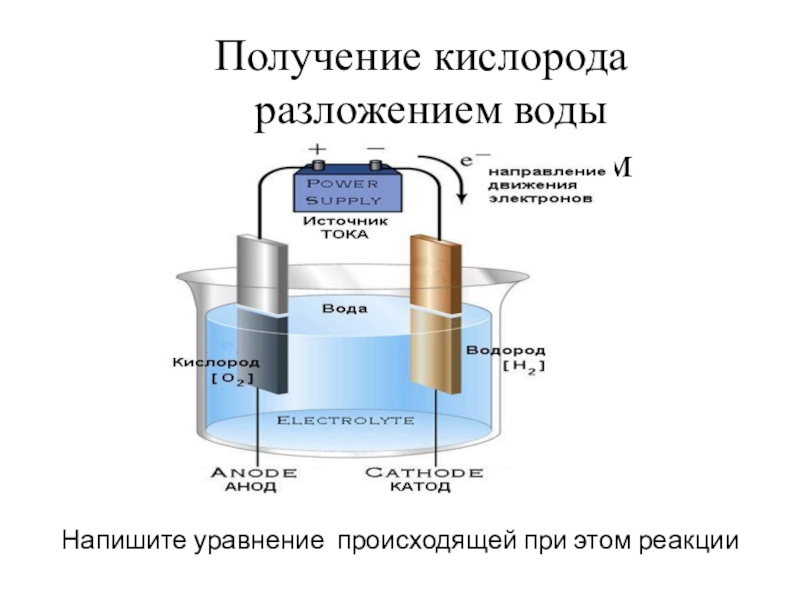
Слайд 24 Получение кислорода разложением воды электрическим током
Напишите уравнение происходящей при этом
Слайд 26Кислород
Без……..
Без………….
…………………. в воде
Mr =
Немного тяжелее
при
-183 С………..
при
Слайд 29Химические свойства кислорода
Взяли в ложечке
железо
Заискрилось и оно.
Магний, цинк или
Рубидий
Всем сгорать им
суждено.
Слайд 31Кислороду характерны реакции горения:
В кислороде горят многие
органические вещества:
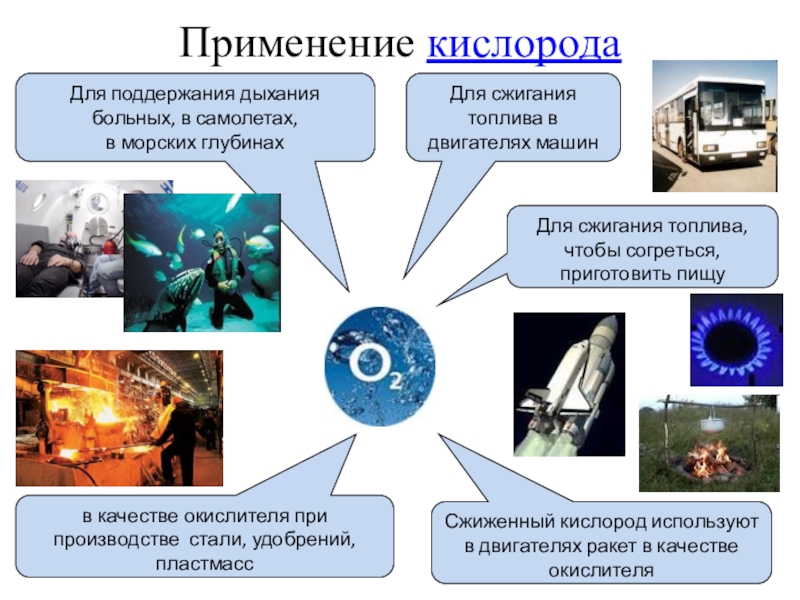
Слайд 33Применение кислорода
Для поддержания дыхания больных, в самолетах,
в морских глубинах
Для сжигания
Сжиженный кислород используют в двигателях ракет в качестве окислителя
в качестве окислителя при производстве стали, удобрений, пластмасс
Для сжигания топлива, чтобы согреться, приготовить пищу
Слайд 34Окисление пищи – источник энергии.
Кислород доставляется гемоглобином, который образует соединение
Кислород в жизни человека
Гемоглобин
Слайд 36Аллотропия кислорода
Без аллотропных проявлений
Нельзя представить кислород.
За счет незримых построений
Два
Одно нам хорошо известно:
Газообразный…….
Которым дышат, скажем, честно,
И человек и бегемот
Из элемента кислорода
(обозначают знаком О)
Еще придумала природа
Одно простое вещество,
Которое зовут озоном.
И в этом есть большой
резон:
В грозу запахнет над газоном –
От слова «пахнущий» -озон.
Как по составу различают
Два аллотропных вещества?
Слайд 40Озон
Волшебник, всех оксидов он родитель,
Металлам часто портит внешний вид.
Он самый мощный
И золото пред ним не устоит.
Когда в грозу могучий гром ударит,
И молния сверкнет над головой,
Волшебник этот чистоту нам дарит
И свежий воздух послегрозовой
Слайд 41
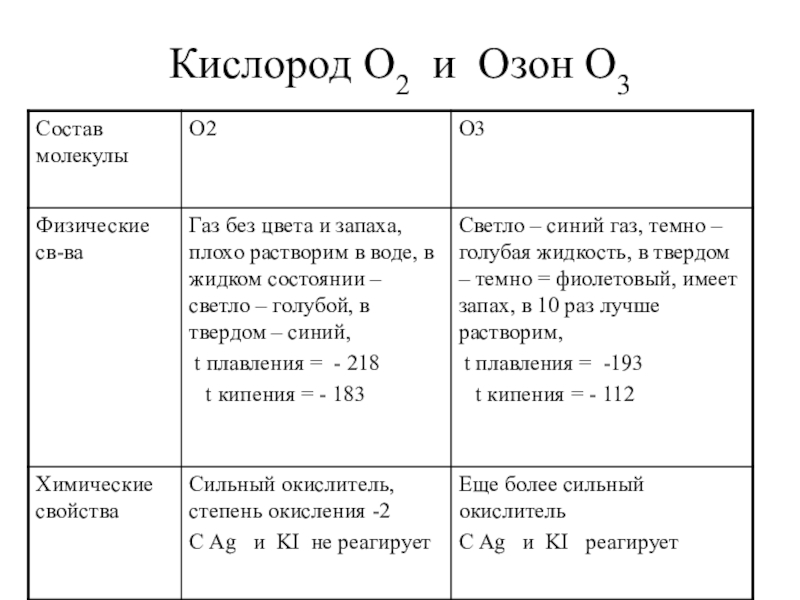
Озон- O3
(от греч. «озон» — «пахнущий») (Шёнбейн)
при н.у. озон -
жидкость цвета ………( -112°)
кристаллы практически чёрного цвета с ……..отблеском(-193°)
Запах?
Ядовит или не ядовит?
Мощный________________
Жидкий озон
Твердый озон
Открыл в1785 Ван-Марум
О 3 +6Ag + =3Ag 2 O
Слайд 42
Озон- O3
(от греч. «озон» — «пахнущий») (Шёнбейн)
при н.у. озон -
жидкость цвета индиго ( -112°)
кристаллы практически чёрного цвета с фиолетовым отблеском
(-193°)
резкий специфический запах
ядовит
мощный окислитель
Жидкий озон
Твердый озон
Открыл в1785 Ван-Марум
О 3 +6Ag + =3Ag 2 O
Слайд 44
недолговечен — он живет не
более получаса, вновь
распадаясь на кислород
Озон
O3
образуется в природных условиях из кислорода под воздействием ультрафиолета и электрических разрядов
Слайд 46Применение медицинского озона
Особенно эффективно его применение при сосудистых заболеваниях : стенокардии,
Успешно используется в хирургии для лечения гнойных ран, трофических язв, перитонита, сепсиса и т.д..
Омоложение, коррекция мимических морщин
Слайд 47
Применение Ozone DTA- генератора озона
генератор Ozone DTA
При лечении кариеса
Проникнув в зубные ткани, он способен полностью уничтожить кариесогенные микроорганизмы без повреждения здоровых клеток. Обработанные озоном зубы укрепляются специальным составом, а пломба ставится только при наличии обширных кариозных процессов
Слайд 48Доказана высокая эффективность озонотерапии в лечении ожирения, диабета и их осложнений.
Озон в медицине
Слайд 49снижение цветности и повышение прозрачности воды;
удаление привкусов и запахов
ионов железа, марганца
окисление и разложение фенольных соединений;
нефтепродуктов и СПАВ
стерилизация и дезинфекция
Обработка озоном воды позволяет достичь следующих результатов:
В Париже вся вода проходит обработку озоном
Слайд 50Озонирование воздуха в помещении позволяет избавиться от вредных микроорганизмов, бытовых клещей,
Озонатор для озонирования воздуха в помещениях
Слайд 51Беление полотна, вместо беления на солнце, значительно выигрывается время
(7 часов
Применение озона
Обработка озоном дерева увеличивает его способность звучать, что применяется при выделке роялей.
Слайд 52беление полотна, вместо беления на солнце, значительно выигрывается время (7 часов
Применение озона