учитель химии МОУ «Лучистовская школа» города Алушты МустафаеваЛ.З
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы.
Содержание
- 1. Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы.
- 2. Цель работыОхарактеризовать серу в свете трёх форм
- 3. Физические свойства серыТвёрдое кристаллическое вещество желтого цвета,
- 4. Нахождение серы в природеСера является на 16-м
- 5. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 6. Пирит – «огненный камень» (соединение серы в природе)
- 7. Сера входит в состав белков. Особенно много
- 8. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 9. Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и
- 10. Слайд 10
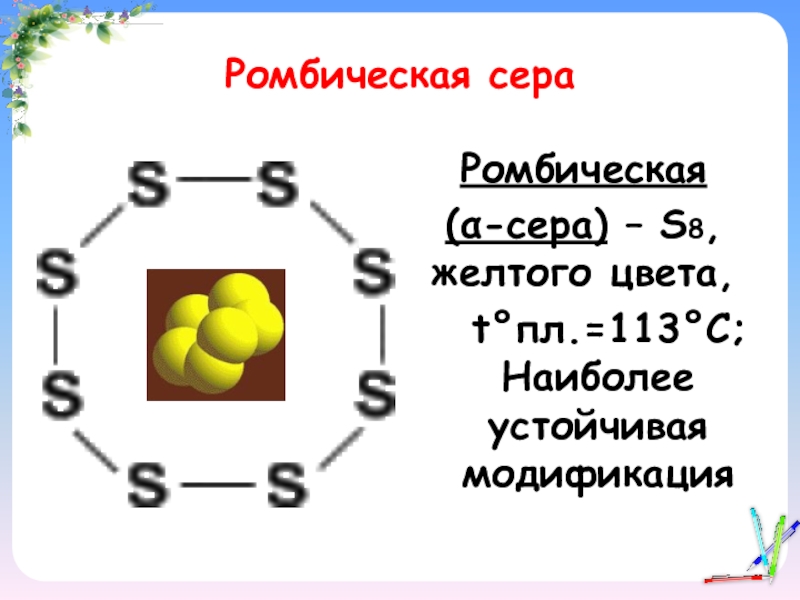
- 11. Ромбическая сераРомбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
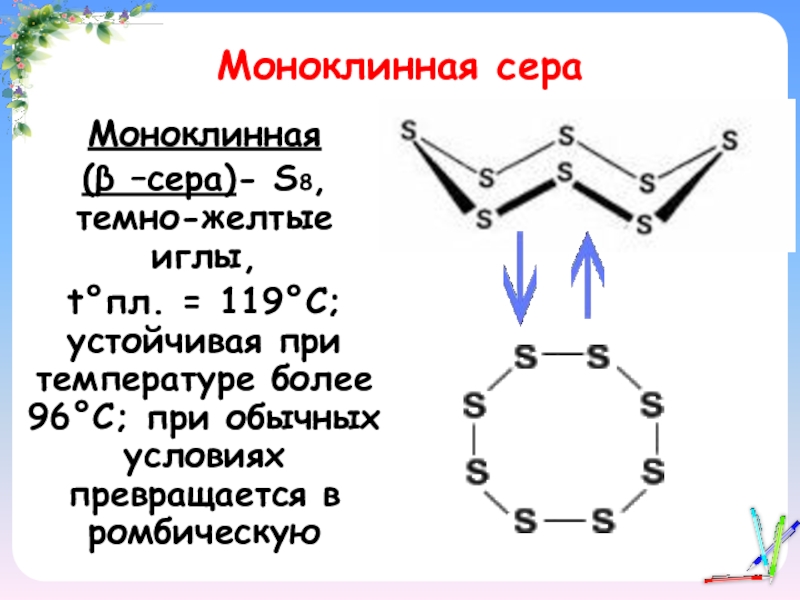
- 12. Моноклинная сераМоноклинная (β –сера)- S8, темно-желтые иглы,t°пл.
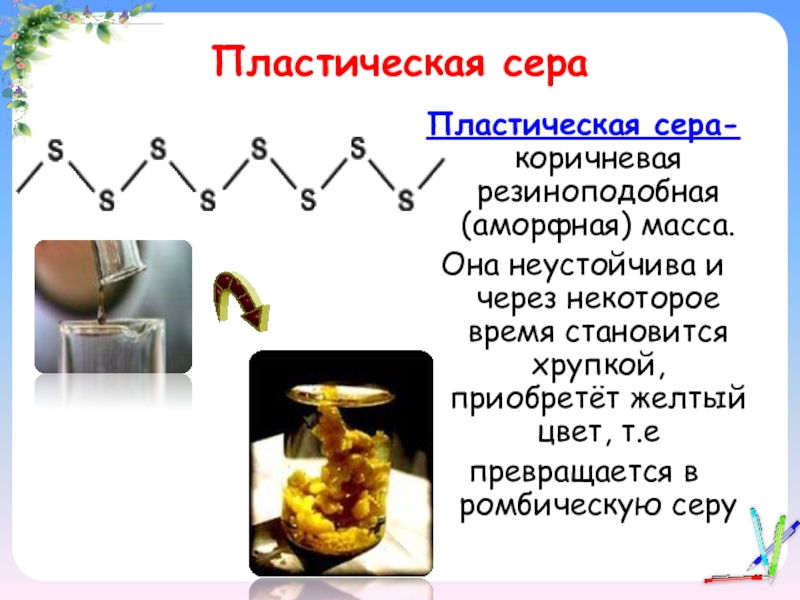
- 13. Пластическая сераПластическая сера- коричневая резиноподобная (аморфная) масса.Она
- 14. Химические свойства серы (восстановительные)Сера проявляет в реакциях
- 15. Химические свойства серы (окислительные)S0 + 2ē
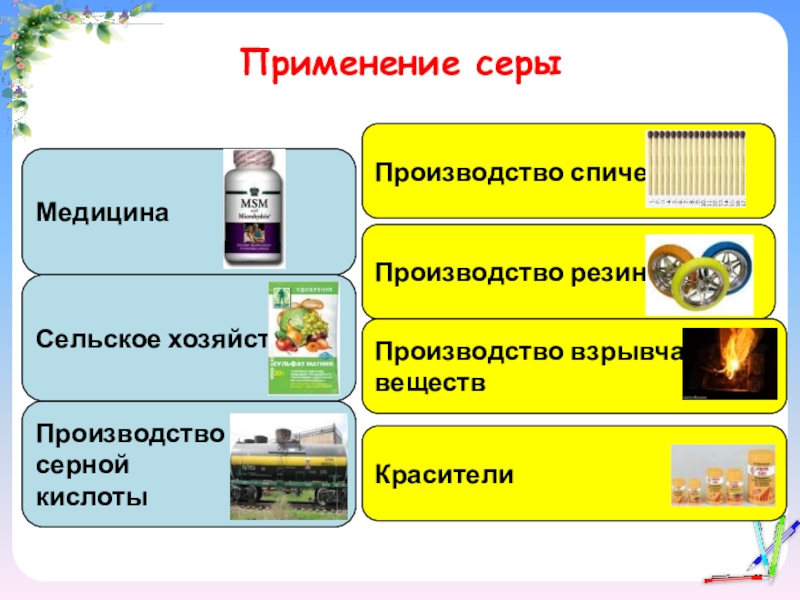
- 16. Применение серы МедицинаПроизводствосернойкислотыСельское хозяйство Производство спичекПроизводство резиныПроизводство взрывчатых веществ Красители
- 17. Спасибо за внимание!
Цель работыОхарактеризовать серу в свете трёх форм существования элемента: в форме атомов, простых веществ (аллотропия), а также некоторых соединений серы.Химические свойства серы рассмотреть в свете ОВР.
Слайд 1Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы.
Подготовила презентацию
Слайд 2Цель работы
Охарактеризовать серу в свете трёх форм существования элемента: в форме
атомов, простых веществ (аллотропия), а также некоторых соединений серы.
Химические свойства серы рассмотреть в свете ОВР.
Химические свойства серы рассмотреть в свете ОВР.
Слайд 3Физические свойства серы
Твёрдое кристаллическое вещество желтого цвета, без запаха
Плохо проводит теплоту
и не проводит электрический ток
Сера в воде практически не растворяется
Температура плавления 1200С
Сера в воде практически не растворяется
Температура плавления 1200С
Слайд 4Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной
коре. Встречается в свободном (самородном) состоянии и связанном виде.
Слайд 7Сера входит в состав белков. Особенно много серы в белках волос,
рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.
Сера в природе
Слайд 9Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того же химического элемента в виде
двух и более простых веществ, различных по строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.
Слайд 11Ромбическая сера
Ромбическая
(α-сера) – S8, желтого цвета,
t°пл.=113°C; Наиболее устойчивая
модификация
Слайд 12Моноклинная сера
Моноклинная
(β –сера)- S8, темно-желтые иглы,
t°пл. = 119°C; устойчивая при
температуре более 96°С; при обычных условиях превращается в ромбическую
Слайд 13Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое
время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу
превращается в ромбическую серу
Слайд 14Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S
- 2ē S+2; S - 4ē S+4; S - 6ē S+6
1) C кислородом:
S + O2 t S+4O2
2S + 3O2 t;Рt 2S+6O3
2) С галогенами (кроме йода)
S + Cl2 S+2Cl2
3) С кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
1) C кислородом:
S + O2 t S+4O2
2S + 3O2 t;Рt 2S+6O3
2) С галогенами (кроме йода)
S + Cl2 S+2Cl2
3) С кислотами - окислителями:
S + 2H2SO4(конц) 3S+4O2 + 2H2O
S + 6HNO3(конц) H2S+6O4 + 6NO2 + 2H2O
Слайд 15Химические свойства серы (окислительные)
S0 + 2ē S-2
4) Сера реагирует со
щелочными металлами без нагревания:
2Na + S Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S –t Al2S3
Cu + S –t CuS
5) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2
2Na + S Na2S
c остальными металлами (кроме Au, Pt) - при повышенной t:
2Al + 3S –t Al2S3
Cu + S –t CuS
5) С некоторыми неметаллами сера образует бинарные соединения:
H2 + S H2S
2P + 3S P2S3
C + 2S CS2