- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад кислительно- восстановительные реакции в заданиях ОГЭ по химии
Содержание
- 1. ПрезентацияОкислительно- восстановительные реакции в заданиях ОГЭ по химии
- 2. «Никакая деятельность не может быть прочна, если
- 3. Степень окисления - условная величина, показывающая заряд атома в молекуле.Степень окисления
- 4. Степень окисленияСтепень окисления никогда не показывает реальный
- 5. Окислитель - это атом или ион в молекуле, который забирает электроны
- 6. Восстановитель - это атом или ион в молекуле, который отдает электроны
- 7. Окислитель в ходе реакции восстанавливается, а восстановитель наоборот - окисляется!
- 8. активные неметаллы – фтор, хлор, кислородОкислителисоли: KСlO4,
- 9. Восстановителиметаллывещества с минимально возможной (отрицательной) степенью окисления неметалла KI, NaBr, K2Sводородные соединения: NН3, HI, HBr, H2S
- 10. Чтобы определить степень окисления атома в молекуле,
- 11. Составление окислительно-восстановительной реакции (ОВР)Основное правило, которым мы
- 12. Первый вариант заданияСера является окислителем в реакции:H2S
- 13. Распишем первое уравнение:H2S + I2 = S
- 14. Перейдем ко второй реакции: 3S + 2Al
- 15. Третья реакция:2SO2 + О2 = 2SO3Исходные вещества:степень
- 16. Последняя реакция:S + 3NO2 = SO3 +
- 17. В 20 задании ОГЭ по химии необходимо
- 18. Теперь рассмотрим метод электронного баланса на типовом
- 19. Метод электронного балансаМетод электронного баланса - метод
- 20. Алгоритм наших действий выглядит следующим образом:Вычисляем изменение степени
- 21. Используя метод электронного баланса, расставьте коэффициенты в
- 22. Итак, составляем электронный баланс. В данной реакции
- 23. HI–1 + H2S+6O4 → I20 + H2S
- 24. А на экзамене…«Сможешь. Ибо ты обрел знание»
- 25. А на экзамене…Желаю успешной сдачи экзамена!
«Никакая деятельность не может быть прочна, если она не имеет основы в личном интересе» Л.Н. ТолстойHI + H2SO4 → I2 + H2S + H2O
Слайд 1Окислительно - восстановительные реакции в заданиях ОГЭ по химии
Работу выполнила:
учитель химии
МОУ «Кокуйская СОШ №1»
Колесникова Елена Владимировна
Слайд 2«Никакая деятельность не может быть прочна, если она не имеет основы
в личном интересе» Л.Н. Толстой
HI + H2SO4 → I2 + H2S + H2O
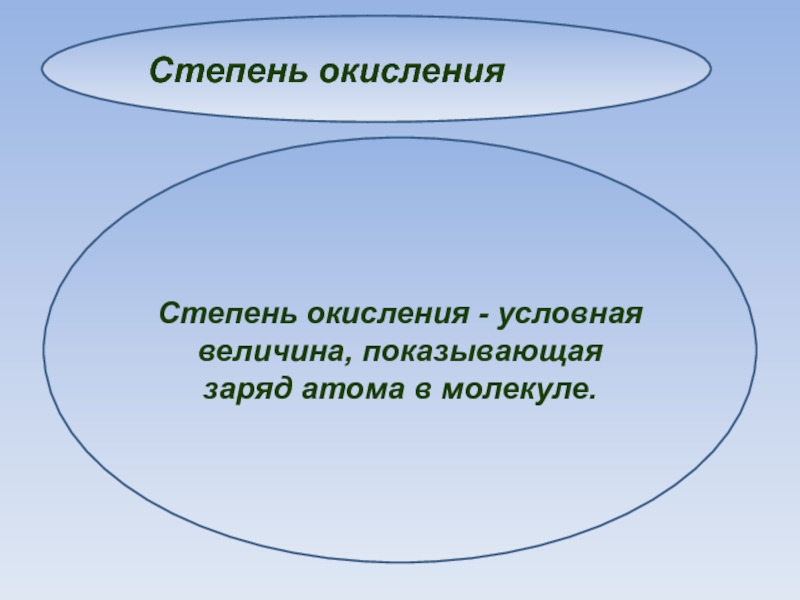
Слайд 4Степень окисления
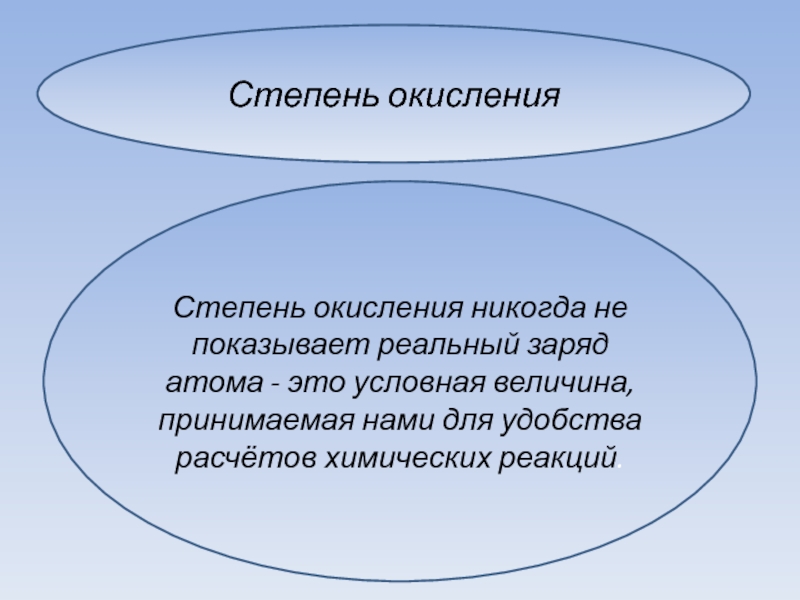
Степень окисления никогда не показывает реальный заряд атома - это
условная величина, принимаемая нами для удобства расчётов химических реакций.
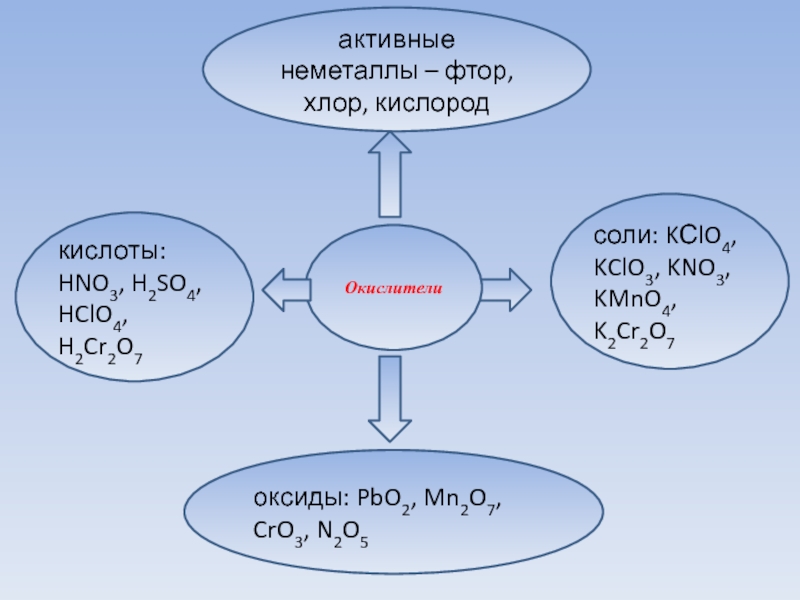
Слайд 8активные неметаллы – фтор, хлор, кислород
Окислители
соли: KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7
кислоты:
HNO3, H2SO4, HClO4, H2Cr2O7
оксиды: PbO2, Mn2O7, CrO3, N2O5
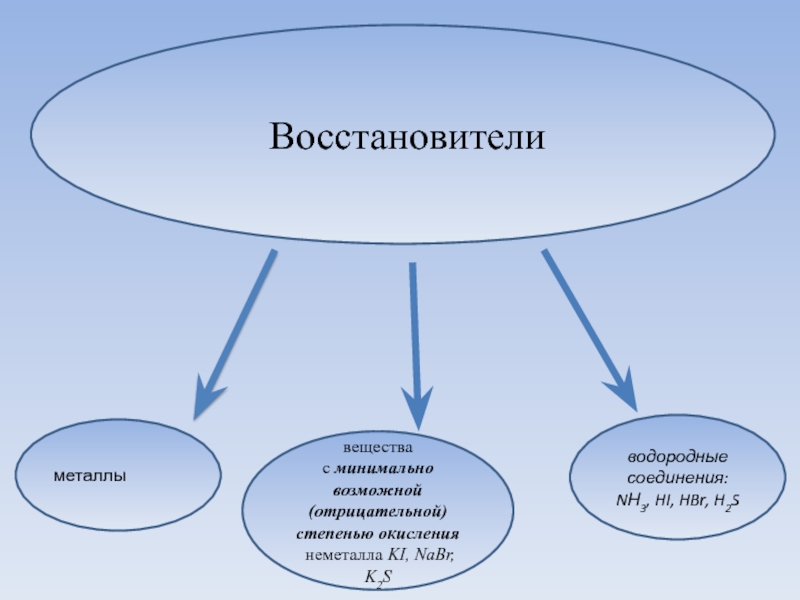
Слайд 9 Восстановители
металлы
вещества с минимально возможной (отрицательной) степенью окисления
неметалла KI, NaBr, K2S
водородные соединения: NН3,
HI, HBr, H2S
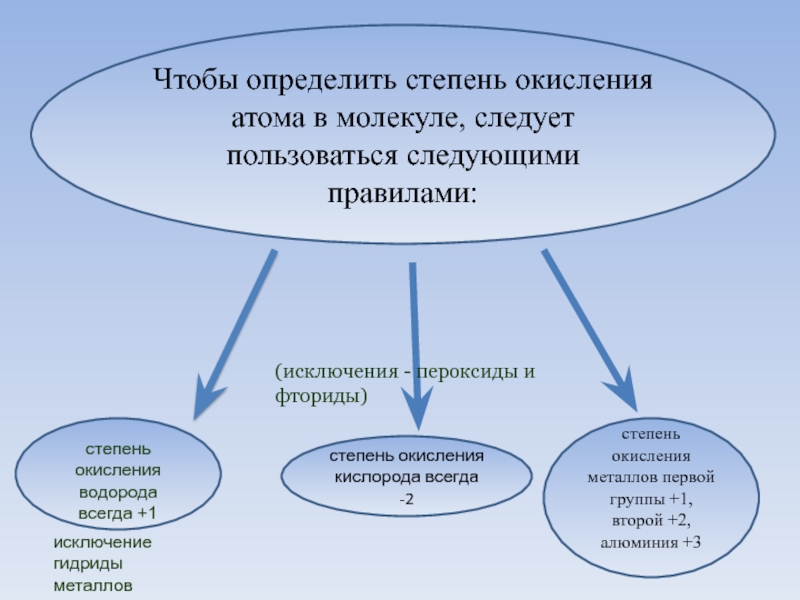
Слайд 10Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
степень
окисления водорода всегда +1
исключение гидриды металлов
исключение гидриды металлов
степень окисления кислорода всегда -2
(исключения - пероксиды и фториды)
степень окисления металлов первой группы +1, второй +2, алюминия +3
Слайд 11Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении
ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.
Слайд 12Первый вариант задания
Сера является окислителем в реакции:
H2S + I2 = S
+ 2HI
3S + 2Al = Al2S3
2SO2 + О2 = 2SO3
S + 3NO2 = SO3 + 3NO
3S + 2Al = Al2S3
2SO2 + О2 = 2SO3
S + 3NO2 = SO3 + 3NO
Слайд 13Распишем первое уравнение:
H2S + I2 = S + 2HI
Исходные вещества:
степень окисления
серы в молекуле сероводорода равен -2, так как водород всегда +1
степень окисления йода 0, так как это простое вещество
Продукты реакции:
степень окисления серы 0, простое вещество
степень окисления йода -1, так как водород +1
Анализируем:
сера поменяла степень окисления с -2 до 0, значит отдала электроны (целых два на один атом :-)) - значит она восстановитель (но сама сера окислилась!)
йод поменял степень окисления с 0 до -1, значит он принял электроны - окислитель (но сам по себе йод восстановился!)
степень окисления йода 0, так как это простое вещество
Продукты реакции:
степень окисления серы 0, простое вещество
степень окисления йода -1, так как водород +1
Анализируем:
сера поменяла степень окисления с -2 до 0, значит отдала электроны (целых два на один атом :-)) - значит она восстановитель (но сама сера окислилась!)
йод поменял степень окисления с 0 до -1, значит он принял электроны - окислитель (но сам по себе йод восстановился!)
Слайд 14Перейдем ко второй реакции: 3S + 2Al = Al2S3 Исходные вещества: степень окисления серы
0, простое вещество
степень окисления алюминия 0, так как это тоже простое вещество
Поскольку реагирует металл и неметалл, то можно сразу понять, что металл восстановитель, а неметалл - окислитель и это верный ответ, но мы продолжим разбор
Продукты реакции:
степень окисления алюминия (из моих правил вверху) +3
степень окисления серы -2
Анализируем:
сера из нулевой степени окисления стала -2, значит забрала электроны и восстановилась, но сама сера - окислитель
алюминий отдал электроны и окислился - он восстановитель
Слайд 15Третья реакция:
2SO2 + О2 = 2SO3
Исходные вещества:
степень окисления серы +4, так как
у кислорода заряд -2, и их два атома
степень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
степень окисления серы +6
степень окисления кислорода -2
Анализируем:
сера отдала последние два электрона и окислилась, являясь восстановителем
кислород забрал электроны и восстановился, являясь окислителем
степень окисления кислорода 0, так как это простое вещество
Поскольку реагирует кислород и образуется оксид, можно догадаться, что сера здесь выступает восстановителем и окисляется, докажем это:
Продукты реакции:
степень окисления серы +6
степень окисления кислорода -2
Анализируем:
сера отдала последние два электрона и окислилась, являясь восстановителем
кислород забрал электроны и восстановился, являясь окислителем
Слайд 16Последняя реакция:
S + 3NO2 = SO3 + 3NO
Исходные вещества:
степень окисления серы 0, так
как это простое вещество
степень окисления азота +4, так как у кислорода -2, и их два атома
Продукты реакции:
степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
степень окисления азота +2, так как у кислорода -2
Анализируем:
сера отдала 6 электронов и окислилась, являясь восстановителем
азот забрал электроны (+4 -> +2) и восстановился, являясь окислителем
Ответ: 2
степень окисления азота +4, так как у кислорода -2, и их два атома
Продукты реакции:
степень окисления серы +6, так как у кислорода степень окисления -2, и их три атома в молекуле
степень окисления азота +2, так как у кислорода -2
Анализируем:
сера отдала 6 электронов и окислилась, являясь восстановителем
азот забрал электроны (+4 -> +2) и восстановился, являясь окислителем
Ответ: 2
Слайд 17В 20 задании ОГЭ по химии необходимо полностью предоставить решение. Решение
20 задания - составление уравнения химической реакции методом электронного баланса.
Слайд 18Теперь рассмотрим метод электронного баланса на типовом примере, но перед этим
вспомним, что это за метод и как им пользоваться.
Слайд 19Метод электронного баланса
Метод электронного баланса - метод уравнивания химических реакций, основанный
на изменении степеней окисления атомов в химических соединениях.
Слайд 20Алгоритм наших действий выглядит следующим образом:
Вычисляем изменение степени окисления каждого элемента в
уравнении химической реакции
Выбираем только те элементы, которые поменяли степень окисления
Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
Находим наименьшее общее кратное для переданных электронов
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Выбираем только те элементы, которые поменяли степень окисления
Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
Находим наименьшее общее кратное для переданных электронов
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Слайд 21Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI
+ H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
Определите окислитель и восстановитель.
Слайд 22Итак, составляем электронный баланс. В данной реакции меняют степени окисления сера и йод.
Сера находилась
в степени окисления +6, а в продуктах - -2.
Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
Слайд 23HI–1 + H2S+6O4 → I20 + H2S –2+ H2O
1 | S+6 +
8ē → S –2
4 | 2I–1 – 2ē → I20
Сера приняла 8 электронов, а йод отдал только два – наименьшее общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать,
что сера в степени окисления +6 является окислителем,
а иод в степени окисления –1 – восстановителем.
Сера приняла 8 электронов, а йод отдал только два – наименьшее общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать,
что сера в степени окисления +6 является окислителем,
а иод в степени окисления –1 – восстановителем.