бесконечно» - Пьер-Симон Лаплас.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме Химические свойства кислот
Содержание
- 1. Презентация по теме Химические свойства кислот
- 2. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТТЕМА УРОКА
- 3. ЗАДАЧИ УРОКА Рассмотреть общие и особые свойства
- 4. ЗАДАНИЯ Что такое кислоты? По каким признакам
- 5. ОТВЕТ НА ЗАДАНИЕ №1:Кислоты – сложные вещества, молекулы которых состоят из атома водорода и кислотного остатка.
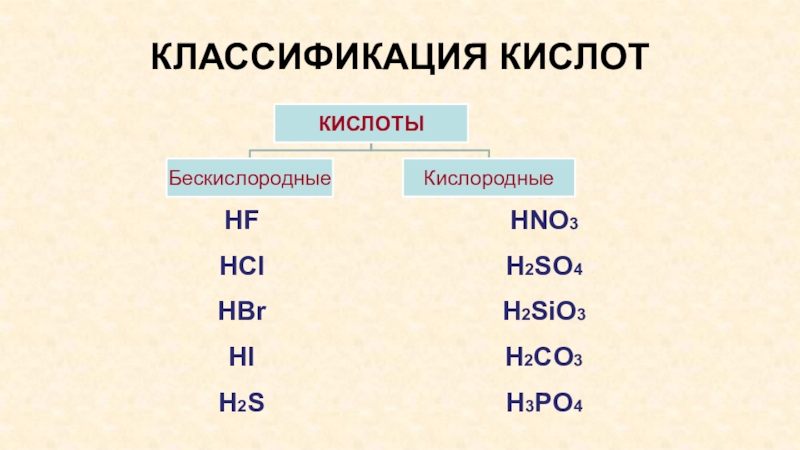
- 6. КЛАССИФИКАЦИЯ КИСЛОТHFHClHBrHIH2SHNO3H2SO4H2SiO3H2CO3H3PO4
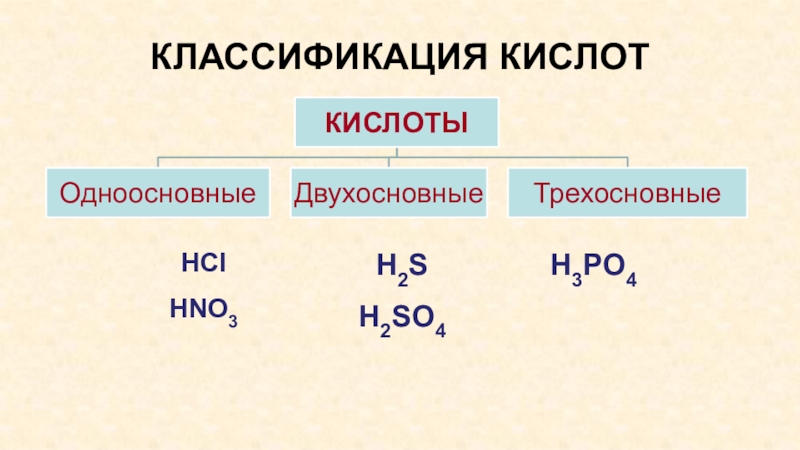
- 7. КЛАССИФИКАЦИЯ КИСЛОТHClHNO3H3PO4Н2SH2SO4
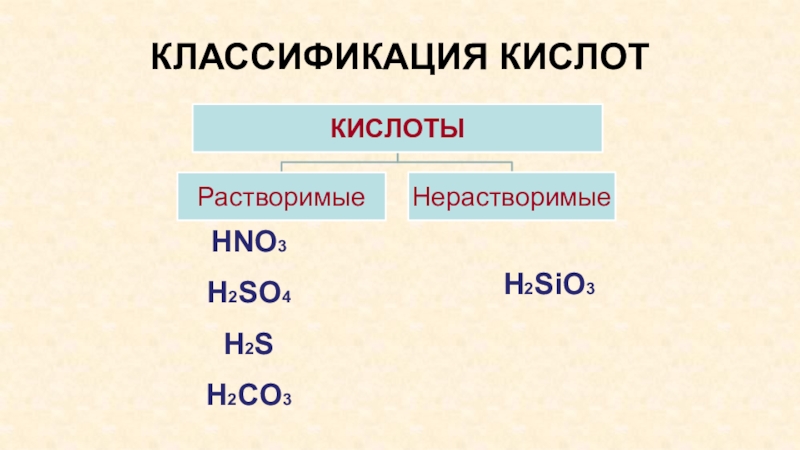
- 8. КЛАССИФИКАЦИЯ КИСЛОТH2SiO3HNO3H2SO4H2SH2CO3
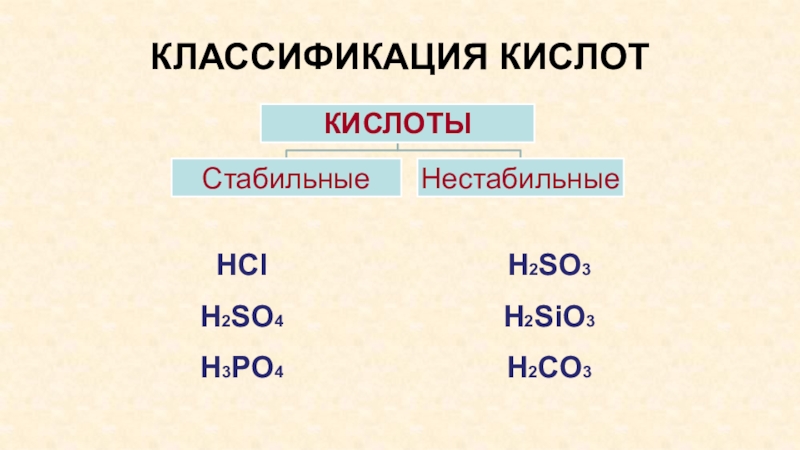
- 9. КЛАССИФИКАЦИЯ КИСЛОТHClH2SO4H3PO4H2SO3H2SiO3H2CO3
- 10. ОТВЕТ НА ЗАДАНИЕ №3: H2SO4 – кислородсодержащая, двухосновная, растворимая, стабильная.
- 11. ОТВЕТ НА ЗАДАНИЕ №4:HCl – так как она является бескислородной.
- 12. ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ: При попадании кислоты на
- 13. ИНДИВИДУАЛЬНЫЕ (ГРУППОВЫЕ) ЗАДАНИЯ:Действие кислот на индикаторы;Взаимодействие кислот
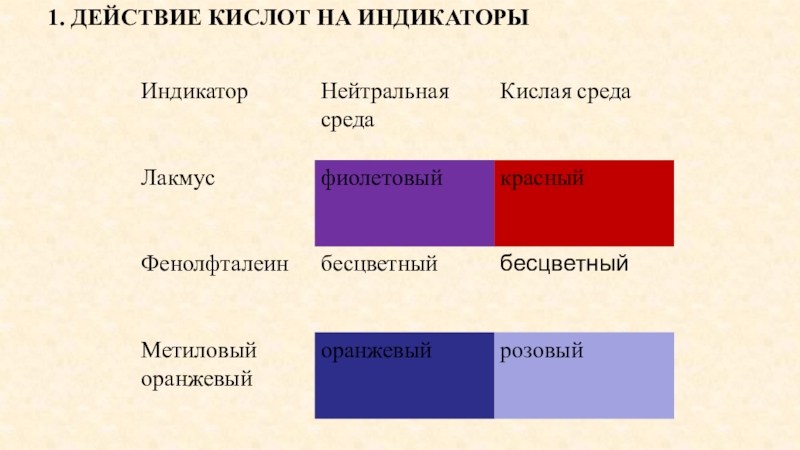
- 14. 1. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
- 15. 2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ (с кислотами
- 16. 3. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С
- 17. 4. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С РАСТВОРИМЫМИ ОСНОВАНИЯМИ
- 18. 5. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С НЕРАСТВОРИМЫМИ ОСНОВАНИЯМИ
- 19. 6. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ
- 20. ЗАКРЕПЛЕНИЕ ЗНАНИЙ С какими из перечисленных веществ
- 21. ОТВЕТ НА ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯKOH, Fe(OH)3,CaO, Mg, Na2SO3
- 22. ДОМАШНЕЕ ЗАДАНИЕ:§ 38 + творческое задание (по
- 23. "Ни один сосуд не вмещает больше своего
- 24. СПАСИБО ЗА ВНИМАНИЕ!
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТТЕМА УРОКА
Слайд 3ЗАДАЧИ УРОКА
Рассмотреть общие и особые свойства кислот;
Продолжить учиться составлять
уравнения химических реакций;
Повторить классы веществ и типы химических реакций.
Повторить классы веществ и типы химических реакций.
Слайд 4ЗАДАНИЯ
Что такое кислоты?
По каким признакам можно классифицировать кислоты?
Классифицируйте
по всем признакам серную кислоту.
Укажите кислоту, которая не соответствует признаку объединяющему две другие:
HNO3
H2SO4
HCl
Укажите кислоту, которая не соответствует признаку объединяющему две другие:
HNO3
H2SO4
HCl
Слайд 5ОТВЕТ НА ЗАДАНИЕ №1:
Кислоты – сложные вещества, молекулы которых состоят из
атома водорода и кислотного остатка.
Слайд 12ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ:
При попадании кислоты на кожу или одежду промыть
проточной водой;
Обработать 5-ти процентным раствором питьевой соды;
При разбавлении концентрированной серной кислоты сначала вливают воду, затем – кислоту.
Обработать 5-ти процентным раствором питьевой соды;
При разбавлении концентрированной серной кислоты сначала вливают воду, затем – кислоту.
Слайд 13ИНДИВИДУАЛЬНЫЕ (ГРУППОВЫЕ) ЗАДАНИЯ:
Действие кислот на индикаторы;
Взаимодействие кислот с металлами;
Взаимодействие кислот с
оксидами металлов;
Взаимодействие кислот с растворимыми основаниями – щелочами;
Взаимодействие кислот с нерастворимыми основаниями;
Взаимодействие кислот с солями.
Взаимодействие кислот с растворимыми основаниями – щелочами;
Взаимодействие кислот с нерастворимыми основаниями;
Взаимодействие кислот с солями.
Слайд 152. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ
(с кислотами взаимодействуют металлы, стоящие в
ряду напряжений до Н)
Кислота + металл = соль + Н2
Zn + H2SO4 = ZnSO4 + H2↑ - реакция замещения
Cu + H2SO4 ↛
Запомните!
При взаимодействии металлов с H2SO4(конц.) и HNO3 (любой концентрации) водород не выделяется.
Кислота + металл = соль + Н2
Zn + H2SO4 = ZnSO4 + H2↑ - реакция замещения
Cu + H2SO4 ↛
Запомните!
При взаимодействии металлов с H2SO4(конц.) и HNO3 (любой концентрации) водород не выделяется.
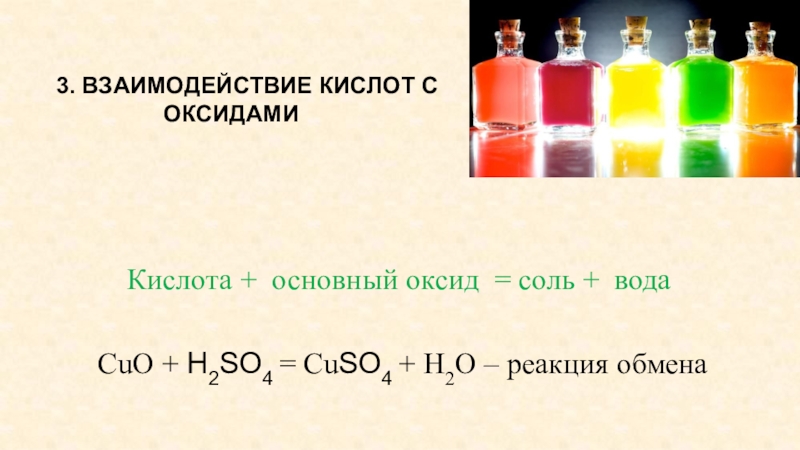
Слайд 16 3. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОКСИДАМИ
Кислота + основный оксид
= соль + вода
CuO + H2SO4 = CuSO4 + H2O – реакция обмена
CuO + H2SO4 = CuSO4 + H2O – реакция обмена
Слайд 17
4. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С РАСТВОРИМЫМИ ОСНОВАНИЯМИ – ЩЕЛОЧАМИ
Кислота + основание (щёлочь)
= соль + вода
2NaOH + H2SO4 = Na2SO4 + 2H2O – реакция нейтрализации
2NaOH + H2SO4 = Na2SO4 + 2H2O – реакция нейтрализации
Слайд 18
5. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С НЕРАСТВОРИМЫМИ ОСНОВАНИЯМИ
Кислота + нерастворимое основание = соль
+ вода
Cu(OH)2↓+H2SO4=CuSO4+ 2H2O – реакция обмена
Cu(OH)2↓+H2SO4=CuSO4+ 2H2O – реакция обмена
Слайд 19 6. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ (Сильная кислота вытесняет более слабую из
раствора соли)
Кислота + соль = новая кислота + новая соль
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl – реакция обмена
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ - реакция обмена
Запомните: реакция между солью и кислотой протекает в случае когда выпадает осадок или выделяется газ
Слайд 20ЗАКРЕПЛЕНИЕ ЗНАНИЙ
С какими из перечисленных веществ будет реагировать хлороводородная кислота:
SiO2,
KOH, H3PO4, Ag, Fe(OH)3, CaO, Mg, Na2SO3
Слайд 22ДОМАШНЕЕ ЗАДАНИЕ:
§ 38 + творческое задание (по желанию) – приготовьте презентацию
на тему: «Действия кислот на наш организм»
На оценку «3» – упражнения 1;2 (страница 214)
На оценку «4» - упражнения 1;2;4 (страница 214)
На оценку «5» – упражнения 1;2;4;5 (страница 214)
На оценку «3» – упражнения 1;2 (страница 214)
На оценку «4» - упражнения 1;2;4 (страница 214)
На оценку «5» – упражнения 1;2;4;5 (страница 214)
Слайд 23
"Ни один сосуд не вмещает больше своего объёма, кроме сосуда знаний
- он постоянно расширяется" – арабская пословица.