- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Химическая связь (8 класс)
Содержание
- 1. Презентация по химии на тему Химическая связь (8 класс)
- 2. Проверим упр.4 к §8 Атом кремния содержит в
- 3. Вопрос на засыпку:Какую особенность в строении имеют
- 4. Какие разные элементы!Все остальные элементыИмеют завершенные уровни,не
- 5. Атомы элементов - металловЕсли мало электронов на
- 6. Атомы элементов - неметалловЕсли внешний уровень близок
- 7. Итак…Атомы металлов имеют тенденцию к отдаче электронов
- 8. В периодах: Металлические свойства ослабевают, а неметаллические
- 9. СамыйСильный Неметалл!В группах (главных подгруппах):Металлические свойства усиливаются,а
- 10. Если встретились металл с неметаллом: Na0 –
- 11. Ионная химическая связь это связь, образующаяся между положительно и отрицательно заряженными ионами.
- 12. Алгоритм составления схемы образования ионной связи.Разберите алгоритм
- 13. Подведем итоги:1. Какие группы элементов мы выделили
- 14. Задание №1:Сравните металлические свойства элементов, поставив вместо
- 15. Проверьте себя:Сравните металлические свойства элементов, поставив вместо
- 16. Задание №2:Расположите элементы в порядке уменьшения их
- 17. Проверьте себя:Расположите элементы в порядке уменьшения их
- 18. Поставьте себе оценку:Общее количество баллов за 2
- 19. Поставьте на карточках “+”, если вы с этим утверждением согласны: РЕФЛЕКСИЯ:
- 20. Домашнее задание:§10, составьте схемы образования ионной связи
- 21. Тема:
- 22. Проверим ДЗ: №19 – калий К K0 –
- 23. Обсудим:Как называется связь, образующаяся в рассмотренных
- 24. Вопрос на засыпку:Н2Cl2Как может осуществляться связь между атомами неметаллов, имеющих одинаковую тенденцию к присоединению электронов?
- 25. Выход один – создание общих электронных
- 26. Ковалентная связь в молекуле хлораCl2
- 27. Алгоритм составления схемы образования ковалентной связи.Разберите алгоритм
- 28. Ковалентная связь в молекуле кислородаЧисло неспаренных
- 29. Задание:Из приведенных формул выпишите формулы соединений с
- 30. Правильно!Из приведенных формул выпишите формулы соединений с
- 31. Подведем итоги:1. С каким новым видом химической
- 32. Поставьте на карточках “+”, если вы с этим утверждением согласны:РЕФЛЕКСИЯ:
- 33. Домашнее задание:§10, упр.5.Составьте схему образования химической связи для каждого из веществ.СПАСИБО ЗА РАБОТУ!
- 34. Тема:
- 35. Проверим ДЗ: Ионная связь: Li2O KCl CaF2 Ковалентная
- 36. Ковалентная неполярная связьКовалентная связь в простых
- 37. Чем же отличается взаимодействие разных неметаллов?Такая ковалентная
- 38. Как определить направление смещения общей электронной пары?H
- 39. Алгоритм составления схемы образования ковалентной связи.Разберите алгоритм
- 40. Итак…1. Если взаимодействует металл с неметаллом –
- 41. Подведем итоги:1. Вставьте пропущенные слова: «Ковалентная химическая
- 42. Поставьте на карточках “+”, если вы с этим утверждением согласны:РЕФЛЕКСИЯ:
- 43. Домашнее задание:§11, упр.2.Составьте схему образования химической связи для каждого из веществ.СПАСИБО ЗА РАБОТУ!
- 44. Тема:
- 45. Какой вид связи изображен на каждом рисунке? Почему? 1 - …связь2 - …связь3 - …связь
- 46. Крестики - НоликиВыигрышный путь – вещества с ионной связью
- 47. Правильно!Выигрышный путь – вещества с ионной связью
- 48. Крестики - НоликиВыигрышный путь – вещества с ковалентнойнеполярной связью
- 49. Правильно!Выигрышный путь – вещества с ковалентнойнеполярной связью
- 50. Крестики - НоликиВыигрышный путь – вещества с ковалентнойполярной связью
- 51. Правильно!Выигрышный путь – вещества с ковалентнойполярной связью
- 52. Металлическая связь связь в металлах и
- 53. Давайте подумаем!Какие общие и отличительные черты имеют металлическая и ковалентная связь?А металлическая и ионная?
- 54. Задание 1:Сгруппируйте вещества по виду связи в
- 55. Проверьте себя:По 1 баллу за каждое вещество с правильно определённым видом связи (всего 12 баллов)
- 56. Задание 2: (* - по желанию)Составьте электронные формулы предложенных частиц:K+ +19 )2)8)8 *1s22s22p63s23p6F-N-3P+3S+6Si-4O+2
- 57. Задание 2: (*- по желанию)Составьте электронные формулы
- 58. И ещё – кто быстрее?Соотнесите вид химической
- 59. Проверьте себя:Соотнесите вид химической связи и формулы
- 60. Поставьте на карточках “+”, если вы с этим утверждением согласны:РЕФЛЕКСИЯ:
- 61. Домашнее задание:§12, Повторить §§6 -11.Подготовиться к КР.СПАСИБО ЗА РАБОТУ!
Слайд 2
Проверим упр.4 к §8
Атом кремния содержит в ядре 14 протонов и
Схема строения атома кремния: Si +14 )2)8)4
Слайд 3Вопрос на засыпку:
Какую особенность в строении имеют атомы инертных газов (He,
Атомы этих элементов практически не образуют соединений с другими атомами. С чем это может быть связано?
Слайд 4Какие разные элементы!
Все остальные элементы
Имеют завершенные уровни,
не взаимодействуют с
другими атомами
Имеют
свои энергетические уровни
Кто это?
А это кто?
Слайд 5
Атомы элементов - металлов
Если мало электронов на внешнем уровне – атом
Na +11 )2)8)1 Na+ +11 )2)8
атом натрия
ион натрия
Атомы элементов – металлов в ПС учебника обозначены
черным, а также зеленым цветом
Слайд 6
Атомы элементов - неметаллов
Если внешний уровень близок к завершению
(т.е. содержит
Cl +17 )2)8)7 Сl- +17 )2)8)8
атом хлора
ион хлора
Атомы элементов – неметаллов в ПС обозначены красным цветом
Слайд 7Итак…
Атомы металлов имеют тенденцию к отдаче электронов с внешнего уровня
Атомы неметаллов
Слайд 8В периодах:
Металлические свойства ослабевают,
а неметаллические усиливаются, так как:
А) увеличиваются
Б) увеличивается число электронов на внешнем уровне;
В) число энергетических уровней постоянно;
Г) радиус атома уменьшается;
Д) способность к отдаче электронов ослабевает, а способность к принятию недостающих электронов возрастает.
Na Mg Al Si P S Cl
Слайд 9
Самый
Сильный
Неметалл!
В группах (главных подгруппах):
Металлические свойства усиливаются,
а неметаллические ослабевают, так как:
А)
Б) число электронов на внешнем уровне постоянно;
В) увеличивается число энергетических уровней;
Г) увеличивается радиус атома;
Д) способность к отдаче электронов возрастает, а способность к принятию недостающих электронов ослабевает.
Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
Самый
Сильный
Металл!
щелочные
металлы
г
алогены
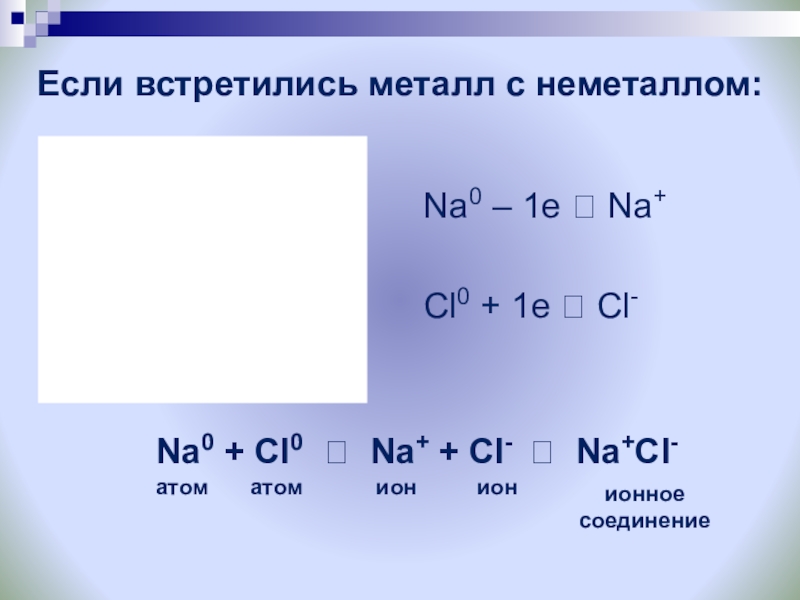
Слайд 10Если встретились металл с неметаллом:
Na0 – 1e ? Na+
Cl0
Na0 + Cl0 ? Na+ + Cl- ? Na+Cl-
атом
атом
ион
ион
ионное
соединение
Слайд 11Ионная химическая связь
это связь, образующаяся между
положительно и отрицательно
заряженными ионами.
Слайд 12Алгоритм составления схемы образования ионной связи.
Разберите алгоритм составления ионной связи на
Пользуясь алгоритмом, составьте схемы образования ионной связи при взаимодействии: а) калия и кислорода; б) лития и хлора; в) магния и фтора.
Слайд 13Подведем итоги:
1. Какие группы элементов мы выделили с точки зрения строения
2. Каким образом атомы металлов завершают свои уровни? А атомы неметаллов?
3. Как называются частицы, в которые превращаются атомы элементов, принимая или отдавая электроны?
4. Что такое ионная химическая связь,
в каком случае она образуется?
Слайд 14Задание №1:
Сравните металлические свойства элементов, поставив вместо ☺ знак «
Na ☺ K; Al ☺ Mg; Rb ☺ Sr; Na ☺ Cs; K ☺ Al
Сравните неметаллические свойства элементов, поставив вместо ☺ знак «<» или «>»:
S ☺ O; F ☺ P; Si ☺ C; P ☺ S; N ☺ O
Слайд 15Проверьте себя:
Сравните металлические свойства элементов, поставив вместо ☺ знак «
Na < K; Al < Mg; Rb > Sr; Na > Cs; K > Al
Сравните неметаллические свойства элементов, поставив вместо ☺ знак «<» или «>»:
S < O; F > P; Si < C; P < S; N < O
Каждый правильно поставленный знак – 1 балл
(всего 10 баллов!)
Слайд 16Задание №2:
Расположите элементы в порядке уменьшения их металлических свойств:
а) Al, Na,
б) Na, Rb, Mg, Ca, Cs, Al
Расположите элементы в порядке уменьшения их неметаллических свойств:
а) C, S, Si, O, P, Cl, F
б) Si, N, P, Cl, Br, As, S
Слайд 17Проверьте себя:
Расположите элементы в порядке уменьшения их металлических свойств:
а) K >
б) Cs > Rb > Ca > Na > Mg > Al
Расположите элементы в порядке уменьшения их неметаллических свойств:
а) F > O > Cl > S > C > P > Si
б) N > Cl > Br > S > P > As > Si
2 балла за каждую полностью правильно
составленную последовательность (всего 8 баллов)
Слайд 18Поставьте себе оценку:
Общее количество баллов за 2 задания – 18;
Подсчитайте набранное
Поставьте «5» за 15 - 18 баллов;
Поставьте «4» за 11 - 14 баллов.
Слайд 20Домашнее задание:
§10, составьте схемы образования ионной связи для элементов с порядковыми
а) 19 и 16; б) 12 и 35.
СПАСИБО ЗА РАБОТУ!
Слайд 22
Проверим ДЗ:
№19 – калий К
K0 – 1e ? K+
S0
2K0 + S0 ? K2+S2-
№12 – магний Mg
Mg0 – 2e ? Mg2+
Br0 + 1e ? Br -
№16 – сера S
№35 – бром Br
НОК = 2
НОК = 2
Mg0 + 2Br0 ? Mg2+Br2 -
Слайд 23 Обсудим:
Как называется связь, образующаяся в рассмотренных примерах: K2S и MgBr2?
Почему
Какие частицы называют ионами?
Какими характеристиками должны обладать атомы для того, чтобы между ними образовалась ионная связь?
Слайд 24Вопрос на засыпку:
Н2
Cl2
Как может осуществляться связь между
атомами неметаллов, имеющих одинаковую
тенденцию к присоединению электронов?
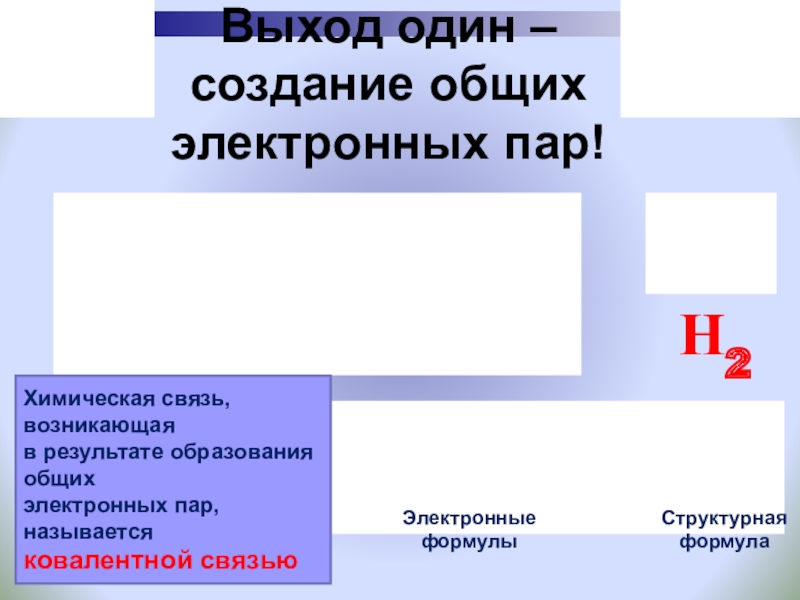
Слайд 25Выход один –
создание общих электронных пар!
Химическая связь, возникающая
в результате
электронных пар, называется
ковалентной связью
Электронные
формулы
Структурная
формула
Н2
Слайд 27Алгоритм составления схемы образования ковалентной связи.
Разберите алгоритм составления ковалентной связи на
на примере молекулы азота.
Пользуясь алгоритмом, составьте схему образования ковалентной связи в молекуле кислорода О2.
Слайд 28Ковалентная связь
в молекуле кислорода
Число неспаренных электронов: 8 – 6 =
2. О + О ? О О
Электронная
формула
Структурная
формула
О
О
В молекуле кислорода двойная связь!
Если ковалентная связь образуется между атомами одного и того же элемента -неметалла, она называется неполярной!
Слайд 29Задание:
Из приведенных формул выпишите формулы соединений с ковалентной неполярной связью:
I2,
Слайд 30Правильно!
Из приведенных формул выпишите формулы соединений с ковалентной неполярной связью:
I2,
Слайд 31Подведем итоги:
1. С каким новым видом химической
2. Какая связь называется ковалентной?
В каком случае ковалентную связь можно назвать неполярной?
3. Как по составу молекулы можно различить ковалентную и ионную связь?
4. Запишите схемы образования химической связи для веществ с формулами: KCl, Cl2.
Определите вид химической связи.
Слайд 33Домашнее задание:
§10, упр.5.
Составьте схему образования химической связи для каждого из веществ.
СПАСИБО
Слайд 35
Проверим ДЗ:
Ионная связь:
Li2O
KCl
CaF2
Ковалентная связь:
N2
O2
H2
По каким признакам
веществ по классам?
2. Какие на ваш взгляд эти виды связей имеют общие и
отличительные признаки?
3. Какими веществами (с точки зрения их
состава) являются вещества: N2, O2, H2?
Слайд 36 Ковалентная неполярная связь
Ковалентная связь в простых веществах
(N2, O2, H2, Сl2,
называется неполярной, т.к. общие электронные пары принадлежат обоим атомам в равной степени и ни на одном из них нет избытка отрицательного заряда, который несут электроны.
Слайд 37Чем же отличается взаимодействие разных неметаллов?
Такая ковалентная связь становится полярной!
H
δ-
δ+
Общая
электронная
пара
смещается в
сторону
одного
из атомов
Слайд 38Как определить направление смещения общей электронной пары?
H P Si
В этом ряду возрастает электроотрицательность (ЭО)–
способность атомов химического элемента смещать
к себе общие электронные пары, участвующие в
образовании химической связи.
ЭО
в периоде возрастает
F
В
под
группе
возрастает
F
O
N
Слайд 39Алгоритм составления схемы образования ковалентной связи.
Разберите алгоритм составления ковалентной связи на
на примере молекулы OF2.
Пользуясь алгоритмом, составьте схему образования ковалентной связи в молекулах метана СН4 и воды Н2О.
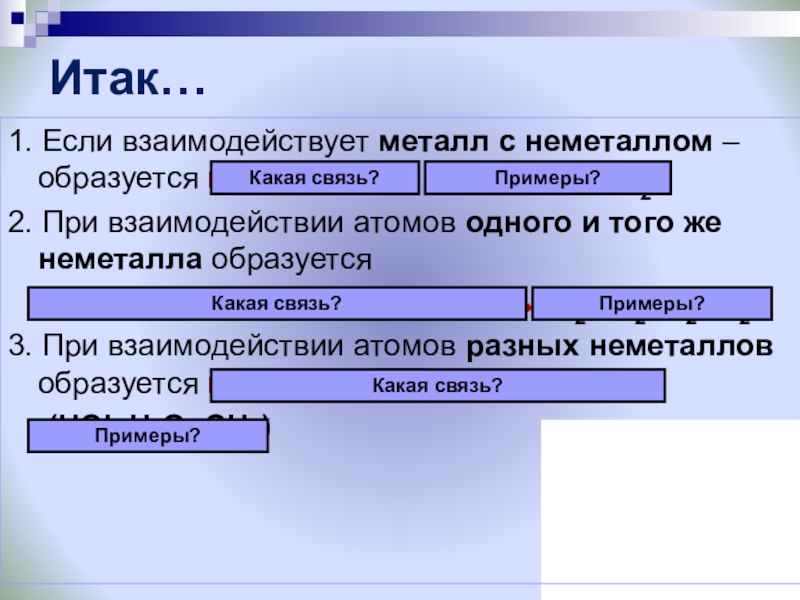
Слайд 40Итак…
1. Если взаимодействует металл с неметаллом – образуется ионная связь (
2. При взаимодействии атомов одного и того же неметалла образуется
ковалентная неполярная связь (H2, Cl2, N2, O2)
3. При взаимодействии атомов разных неметаллов образуется ковалентная полярная связь
(HCl, H2O, CH4)
Примеры?
Какая связь?
Какая связь?
Какая связь?
Примеры?
Примеры?
Слайд 41Подведем итоги:
1. Вставьте пропущенные слова: «Ковалентная химическая связь образуется за счет
По числу общих электронных пар она бывает …………., ………… и ……….. . По электроотрицательности элементов ковалентную связь делят на ……………….. и …………………..».
2. Найдите черты сходства и различия у ковалентной полярной и неполярной связи.
Слайд 43Домашнее задание:
§11, упр.2.
Составьте схему образования химической связи для каждого из веществ.
СПАСИБО
Слайд 52Металлическая связь
связь в металлах и сплавах, которую выполняют относительно
о п+
М — пе М
Сu - медь
Слайд 53Давайте подумаем!
Какие общие и отличительные черты
имеют металлическая и ковалентная связь?
А металлическая
Слайд 54Задание 1:
Сгруппируйте вещества по виду связи в них:
F2, H2O, Al, MgCl2,
Na, Ca3P2.
Слайд 55Проверьте себя:
По 1 баллу за каждое вещество с правильно
определённым
Слайд 56Задание 2: (* - по желанию)
Составьте электронные формулы предложенных частиц:
K+ +19 )2)8)8 *1s22s22p63s23p6
F-
N-3
P+3
S+6
Si-4
O+2
Слайд 57Задание 2: (*- по желанию)
Составьте электронные формулы предложенных частиц:
K+ +19 )2)8)8)0 *1s22s22p63s23p64s0
F- +9
N-3 +7 )2)8
P+3 +15 )2)8)2
S+6 +16 )2)8)0
Si-4 +14 )2)8)8
O+2 +8 )2)4
Добавьте себе по 2 балла
за каждую правильно
записанную строку
(максимально 14 баллов).
Подсчитайте общее количество
баллов за 2 задания.
Поставьте «5» за 22-26 баллов;
Поставьте «4» за 17-21 балла.
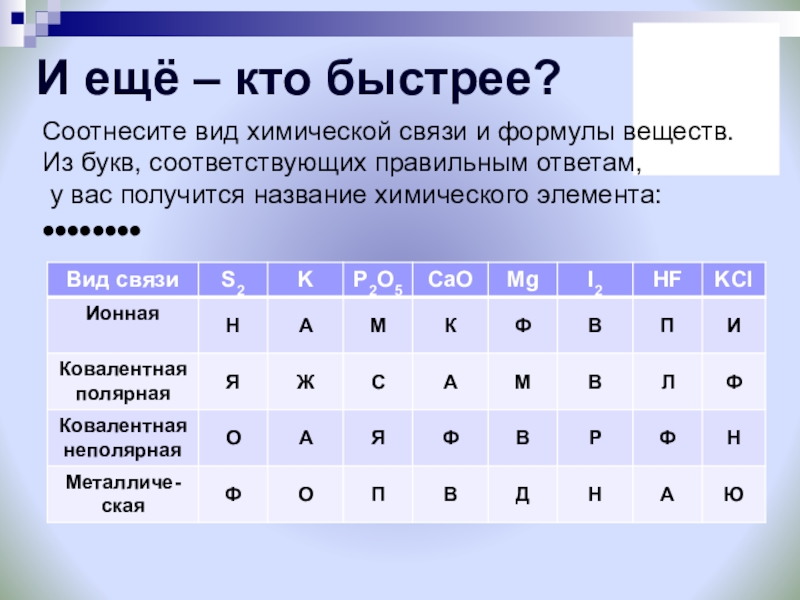
Слайд 58И ещё – кто быстрее?
Соотнесите вид химической связи и формулы веществ.
Из
у вас получится название химического элемента:
••••••••
Слайд 59Проверьте себя:
Соотнесите вид химической связи и формулы веществ.
Из букв, соответствующих правильным
получится название химического элемента:
КИСЛОРОД