- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме: Алюминий
Содержание
- 1. Презентация по теме: Алюминий
- 2. ЦельИзучить физические и химические свойства алюминия и области его применения
- 3. Сами, трудясь, вы сделаете всеи для близких
- 4. План изучения химического элементаХарактеристика элемента алюминия по
- 5. Наполеон I I I В 19 веке
- 6. Алюминий1. Из истории открытияВпервые Al был получен
- 7. АлюминийВставьте пропущенные словаАлюминий - элемент III
- 8. Алюминий2. Электронное строение27Аl+1302e8e3e1s22s22p63s23p1Краткая электронная запись1s22s22p63s23p1Порядок заполнения
- 9. Алюминий3.Строение простого вещества Металл Связь
- 10. Алюминий4. Физические свойства
- 11. Алюминий5. Свойства атома2.1 Степень окисленияAl+3
- 12. Алюминий5. Свойства атома2.2 ВосстановительныеГруппы элементов IIIIIIIVVIIVIVVIII32145MgNaBAlGaЭлектрохимический ряд
- 13. Алюминий6. Химические свойства4Аl + 3O2 = 2Al2O3
- 14. Аl взаимодействует с растворами солей менее активных
- 15. Аl взаимодействует с растворами солей менее активных
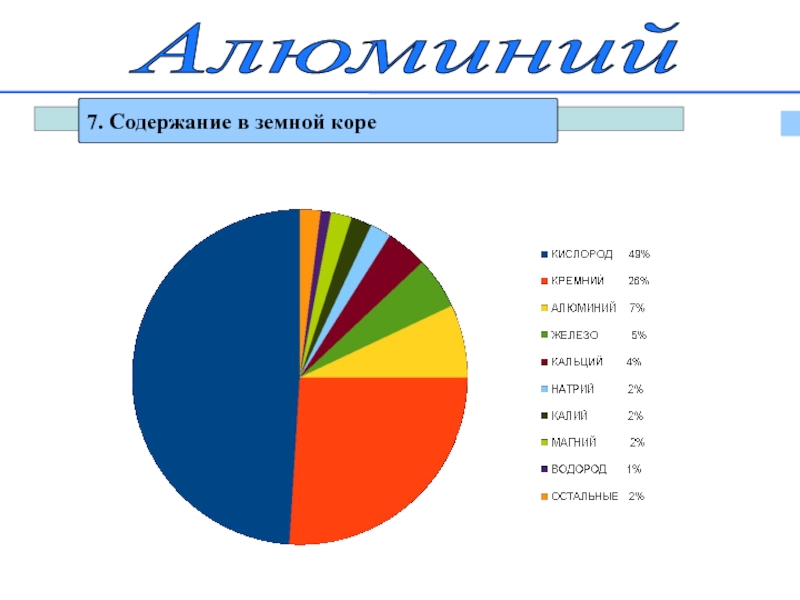
- 16. Алюминий7. Содержание в земной коре
- 17. Белая глина, или каолин Al2O3·2SiO2·2H2O,
- 18. Бокситы Al2O3 • 2H2OВ России месторождения бокситов имеются в Сибири и на Урале.
- 19. Полевой шпатNa2O • Al2O3• 6SiO2НефелинNa2O • Al2O3• 6SiO2Алюмосиликаты
- 20. Al3O3 КорундРубин Сапфир Лунный каменьТопаз Гранат Драгоценные и полудрагоценные камниТанзанит
- 21. Получение алюминияОткрытие электролиза
- 22. Современный способ получения алюминия был открыт в 1886 молодым американским исследователем Чарлзом Мартином Холлом.
- 23. Чарлз Мартин ХоллАмериканский инженер-химик. Родился 6.12.1863г в
- 24. Приоритет открытия и получения металлического алюминия, который
- 25. Ханс Кристиан ЭрстедРодился 14 августа 1777 г.
- 26. Получение алюминияЧтобы получить алюминий, Эрстед нагревал безводный
- 27. В 1827 г. немецкому химику Ф.Велеру (1800–1882)
- 28. Алюминий8. Получение
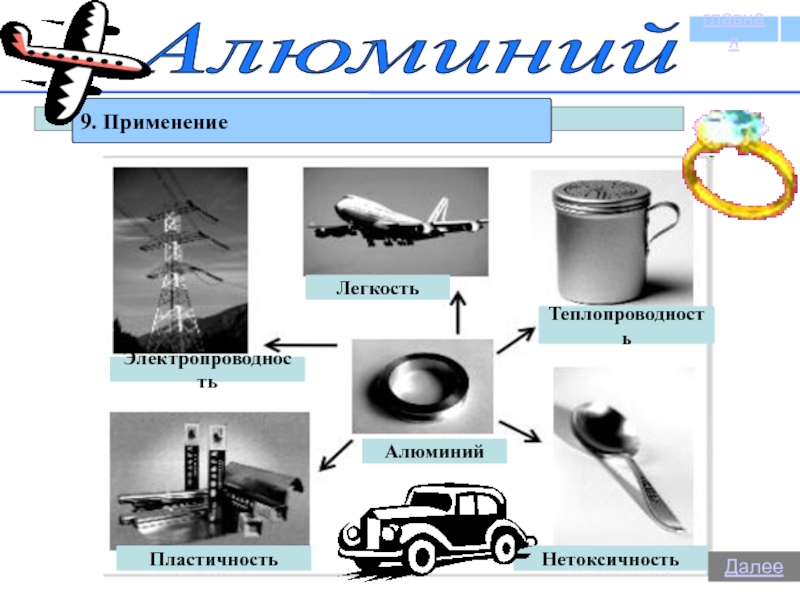
- 29. Алюминий9. ПрименениеглавнаяДалее
- 30. Алюминий играет в организме важную физиологическую роль,
- 31. Знаете ли вы что...
- 32. Академия наук вручила Ф.Вёлеру алюминиевую медаль.Англичане так
- 33. Из золота, алюминия и драгоценных камней была
- 34. Алюминий очень хорошо отражает свет. Поэтому его
- 35. Алюмотол, литая смесь тринитротолуола с порошком алюминия,
- 36. Первый советский спутник был выполнен из алюминиевого сплава
- 37. Домашнее задание§ 13 (до соединений алюминия) ,
Слайд 3Сами, трудясь, вы сделаете все
и для близких людей и для себя,
а
неудача – не беда, попробуйте еще.
Д.И.Менделеев
Слайд 4План изучения химического элемента
Характеристика элемента алюминия по положению его в ПСХЭ
Строение
Физические свойства алюминия
Химические свойства алюминия
Нахождение алюминия в природе
Получение алюминия
Применение алюминия
Алюминий в моем организме
Слайд 5Наполеон I I I
В 19 веке алюминий ценился дороже золота
На балу у Наполеона III, особо почетным гостям подавали столовые приборы из алюминия, остальные гости были обижены, так как им доставались приборы из серебра и золота.
Слайд 6Алюминий
1. Из истории открытия
Впервые Al был получен датским физиком Эрстедом Х.
в 1825 г. Название элемента происходит от лат.
алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
Слайд 7Алюминий
Вставьте пропущенные слова
Алюминий - элемент III группы, главной подгруппы.
Заряд
В ядре атома алюминия 13 протонов.
В ядре атома алюминия 14 нейтронов.
В атоме алюминия 13 электронов.
Атом алюминия имеет 3 энергетических уровня.
Электронная оболочка имеет строение 2е, 8е, 3е.
На внешнем уровне в атоме 3 электронов.
Степень окисления атома в соединениях равна +3 .
Простое вещество алюминий является металлом.
Оксид и гидроксид алюминия имеют амфотерный характер.
Слайд 8Алюминий
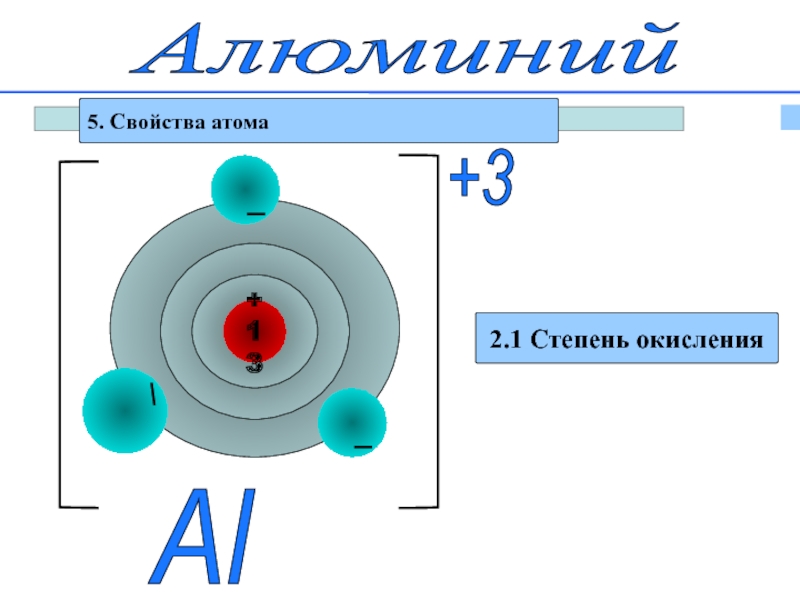
2. Электронное строение
27
Аl
+13
0
2e
8e
3e
1s2
2s2
2p6
3s2
3p1
Краткая электронная запись
1s2
2s2
2p6
3s2
3p1
Порядок заполнения
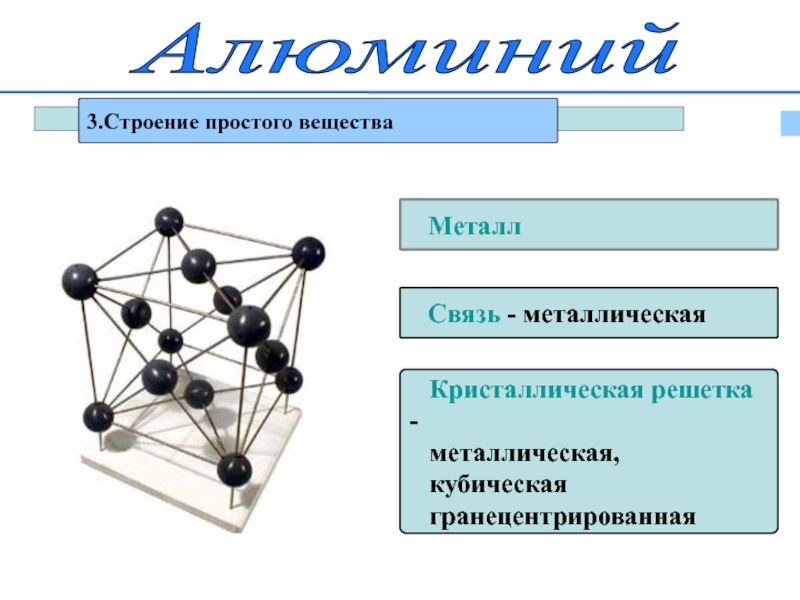
Слайд 9Алюминий
3.Строение простого вещества
Металл
Связь - металлическая
Кристаллическая
металлическая,
кубическая
гранецентрированная
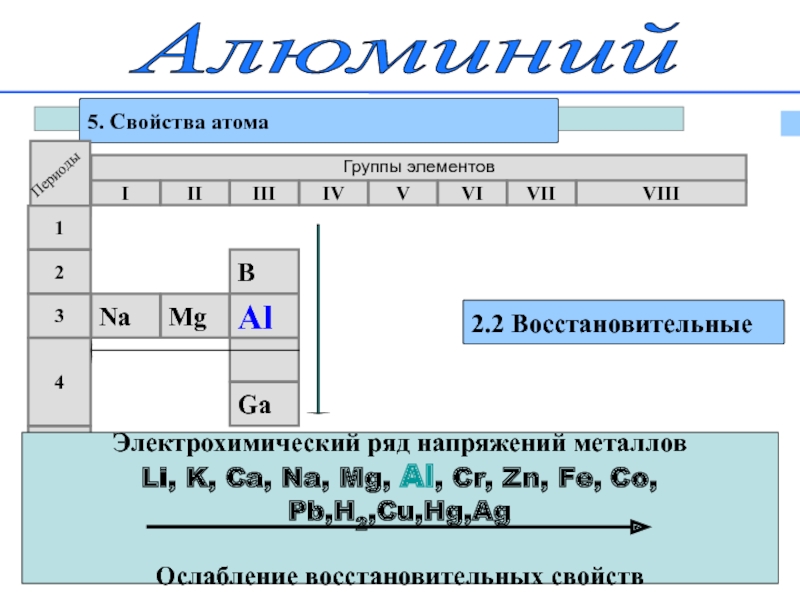
Слайд 12Алюминий
5. Свойства атома
2.2 Восстановительные
Группы элементов
I
II
III
IV
VII
VI
V
VIII
3
2
1
4
5
Mg
Na
B
Al
Ga
Электрохимический ряд напряжений металлов
Li, K, Ca,
Ослабление восстановительных свойств
Слайд 13Алюминий
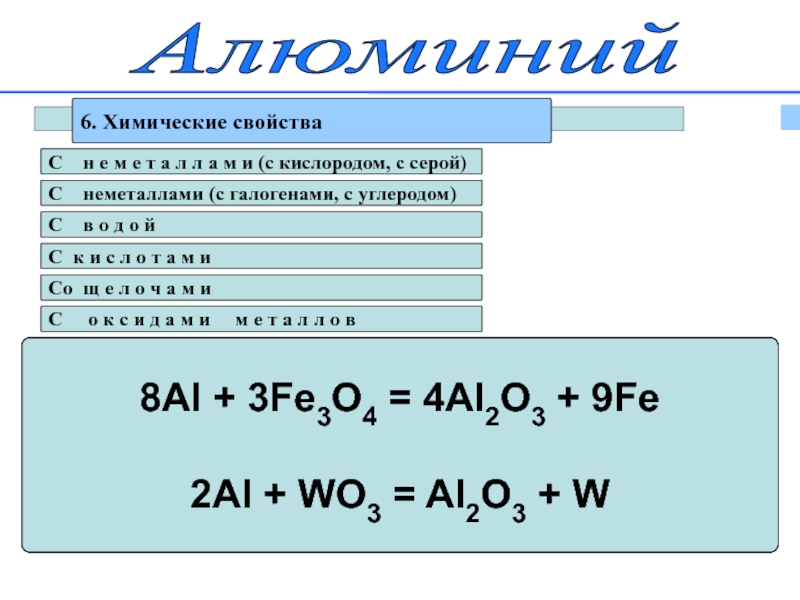
6. Химические свойства
4Аl + 3O2 = 2Al2O3
t
2Al +
C н е м е т а л л а м и (c кислородом, с серой)
2Аl + 3Cl2 = 2AlCl3
4Al + 3C = Al4C3
C неметаллами (c галогенами, с углеродом)
(Снять оксидную пленку)
2Al + 6H2O = 2Al(OH)2 + H2↑
C в о д о й
2Al + 6HCl = 2AlCl3 + H2↑
2Al + 3H2SO4 = Al2(SO4)3 + H2↑
C к и с л о т а м и
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2↑
2Al + 2NaOH + 2H2O =2NaAlO2 +3H2↑
Cо щ е л о ч а м и
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
2Al + WO3 = Al2O3 + W
C о к с и д а м и м е т а л л о в
Слайд 14Аl взаимодействует с растворами солей менее активных металлов:
Al + NiCl2
2
3
2AlCl3 + 3Ni
Li, K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Au
Задание. В тетради напишите уравнение реакции:
Слайд 15Аl взаимодействует с растворами солей менее активных металлов:
Al + NiCl2
2
3
2AlCl3 + 3Ni
Li, K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Au
Задание. В тетради напишите уравнение реакции:
Слайд 20Al3O3
Корунд
Рубин
Сапфир
Лунный камень
Топаз
Гранат
Драгоценные и полудрагоценные камни
Танзанит
Слайд 22Современный способ получения алюминия был открыт в 1886 молодым американским исследователем
Слайд 23Чарлз Мартин Холл
Американский инженер-химик.
Родился 6.12.1863г в Томпсоне,США.
Химией он увлекся
Став в 16 лет студентом, Холл услышал от своего преподавателя, Ф.Ф.Джуэтта, что если кому-нибудь удастся разработать дешевый способ получения алюминия, то этот человек не только окажет огромную услугу человечеству, но и заработает огромное состояние. Это и стало переломным моментом в жизни Холла.
На электролизе расплава Nа3[АlF6] он получил несколько маленьких серебристых шариков.
Слайд 24Приоритет открытия и получения металлического алюминия, который одно время называли «серебром
Слайд 25Ханс Кристиан Эрстед
Родился 14 августа 1777 г. в маленьком
городке Рудкёбинге, расположенном
Его отец был аптекарем, денег в семье не было.
Начальное образование братья Ханс Кристиан и Андерс получали где придётся
С 12 лет Ханс помогает своему отцу в аптеке. Здесь он заинтересовывается естественными науками и решает поступать в университет.
Слайд 26Получение алюминия
Чтобы получить алюминий, Эрстед нагревал безводный хлорид алюминия с амальгамой
AlCl3 + 3Na(Hg) = Al(Hg) + 3NaCl.
Продукты реакции он обработал водой для растворения хлорида натрия, а из остатка, содержащего амальгаму алюминия, удалил нагреванием ртуть.
Слайд 27
В 1827 г. немецкому химику Ф.Велеру (1800–1882) также удалось выделить алюминий,
Nа3[АlF6] + 3K = Аl + 3NaF + 3KF.
Слайд 30Алюминий играет в организме важную физиологическую роль, – он участвует в
Богаты алюминием яблоки
/
Слайд 32Академия наук вручила Ф.Вёлеру алюминиевую медаль.
Англичане так же почтили великого химика
На международном съезде химиков Д.И. Менделееву вручили большую алюминиевую кружку.
За выдающиеся заслуги в области химии
Слайд 33Из золота, алюминия и драгоценных камней была сделана в 1850-х погремушка
Слайд 34Алюминий очень хорошо отражает свет. Поэтому его используют для изготовления зеркал
Слайд 35Алюмотол, литая смесь тринитротолуола с порошком алюминия, – одно из самых
Алюминий нашел также практическое применение в качестве ракетного топлива. Для полного сжигания 1 кг алюминия требуется почти вчетверо меньше кислорода, чем для 1 кг керосина.
Слайд 37Домашнее задание
§ 13 (до соединений алюминия) , з.7 стр.75
Работа с
Подберите коэффициенты методом электронного баланса:
Al + H2SO4= Al2(SO4)3 + SO2 + H2O
Al + HNO3 = Al(NO3)3 + NO2 + H2O