- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по теме алканы
Содержание
- 1. Презентация по теме алканы
- 2. Введение.Алка́ны (также насыщенные алифатические углеводороды, парафины) —
- 3. Общие сведения об алканах и их радикалах.*
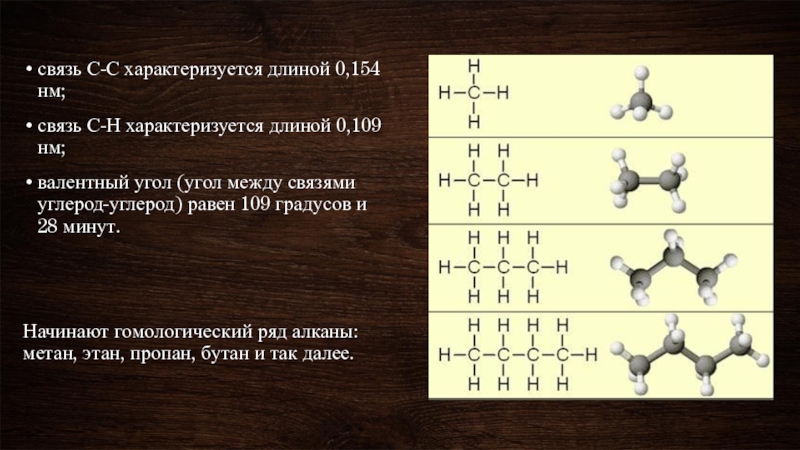
- 4. связь С-С характеризуется длиной 0,154 нм; связь
- 5. Физические свойства алканов.Газообразные алканы способны гореть бледно-голубым
- 6. Химические свойства алканов. Данные соединения являются малоактивными
- 7. Реакции нитрования.Алканы взаимодействуют только с азотной кислотой
- 8. Реакции горения.Предельные углеводороды очень часто применяются как
- 9. Реакции окисленияВ химические свойства алканов также входит
- 10. Отношение к нагреванию.При температурах, не превышающих +150-250°С,
- 11. Реакции галогенирования.Такие реакции заключаются во введении в
- 12. Реакции сульфохлорирования.Химические свойства алканов также дополняются реакцией
- 13. Спасибо за внимание!
Слайд 2Введение.
Алка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг.
Слайд 3Общие сведения об алканах и их радикалах.
* Их формула: СnР2n+2, здесь
* Молярная масса вычисляется по формуле: М = 14n + 2.
* Характерная особенность: окончания в их названиях - «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R.
* Общая формула одновалентных алифатических радикалов: СnР2n+1, здесь n больше или равно 1.
* Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1.
* Характерная особенность алифатических радикалов: окончания в названиях «-ил».
Слайд 4связь С-С характеризуется длиной 0,154 нм;
связь С-Н характеризуется длиной 0,109
валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.
Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Слайд 5Физические свойства алканов.
Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при
Алканы – это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются.
Слайд 6Химические свойства алканов.
Данные соединения являются малоактивными в химическом плане, что
Слайд 7Реакции нитрования.
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо
Слайд 8Реакции горения.
Предельные углеводороды очень часто применяются как топливо, что обосновано их
Слайд 9Реакции окисления
В химические свойства алканов также входит их способность к окислению.
2СН4 (окисление кислородом) = 2СН3ОН (спирт – метанол).
СН4 (окисление кислородом) = СН2О (альдегид – метаналь или формальдегид) + Н2О.
2СН4 (окисление кислородом) = 2НСООН (карбоновая кислота – метановая или муравьиная) + 2Н2О.
Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Слайд 10Отношение к нагреванию.
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора,
2СН4 = С2Н4 (этен) + 2Н2.
2СН4 = С2Н2 (этин) + 3Н2.
С7Н16 (нормальный гептан) = С6Н5 – СН3 (толуол) + 4Н2.