- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Вычисление массовой доли химического элемента в веществе 8 класс
Содержание
- 1. Вычисление массовой доли химического элемента в веществе 8 класс
- 2. Мr(СН4) = Аr(С) + Аr(Н)·4Относительная атомная масса
- 3. Слайд 3
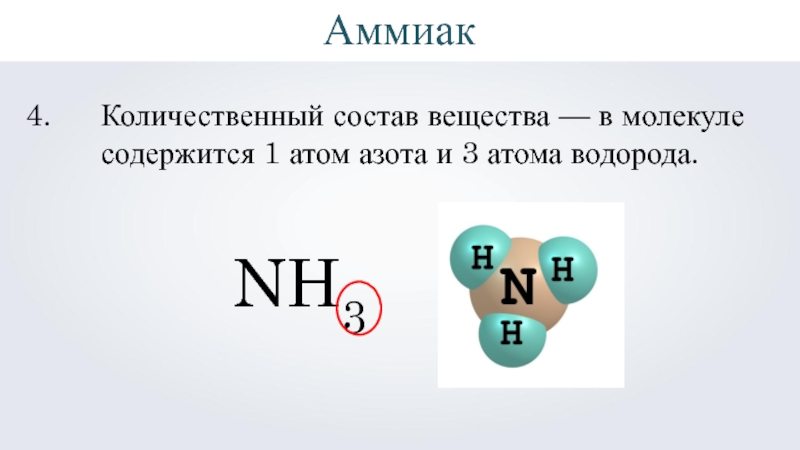
- 4. NH3 Вещество аммиак.Аммиак
- 5. NH3Качественный состав — состоит из двух элементов: азота и водорода.N — азотH — водородАммиак
- 6. NH3Тип вещества — сложное вещество.ПростыеСложныеВеществав состав молекулы
- 7. NH3Количественный состав вещества — в молекуле содержится 1 атом азота и 3 атома водорода.Аммиак
- 8. NH3АммиакОтносительная молекулярная масса равна сумме атомной массы
- 9. Массовая доля химического элемента ω(Э)Массовая доля химического
- 10. Рассчитаем в процентах долю азота и водорода в аммиаке (NH3): NH3 ω(N)82%ω(H) 18%
- 11. NaСlO2ω(Э)Cl2Н2OSiO2Известны массовые доли химических элементов ω(Э), однако
- 12. Известно, что вещество состоит из:0,4 массовой доли
- 13. Вычисление массовой доли химического элемента в веществе
Слайд 1SiO2
NaСl
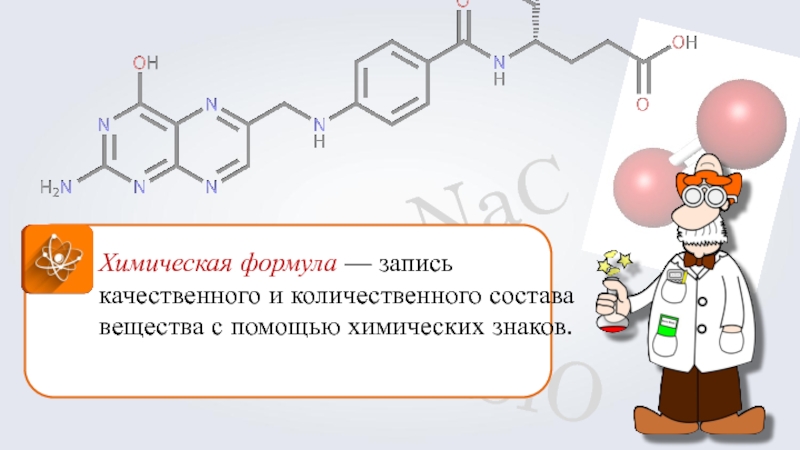
Химическая формула — запись качественного и количественного состава вещества с помощью
Слайд 2Мr(СН4) = Аr(С) + Аr(Н)·4
Относительная атомная масса (Ar)
показывает, во сколько раз
Относительная молекулярная масса (Mr) рассчитывается на основании атомных масс атомов, входящих в состав молекулы.
Слайд 5NH3
Качественный состав — состоит из двух элементов: азота и водорода.
N —
H — водород
Аммиак
Слайд 6NH3
Тип вещества — сложное вещество.
Простые
Сложные
Вещества
в состав молекулы вещества входит один вид
молекула вещества состоит из нескольких видов атомов
Аммиак
Слайд 7NH3
Количественный состав вещества — в молекуле содержится 1 атом азота и
Аммиак
Слайд 8NH3
Аммиак
Относительная молекулярная масса равна сумме атомной массы азота и атомной массы
Mr(NH3) = 14 + 1· 3 = 17
Слайд 9
Массовая доля химического элемента
ω(Э)
Массовая доля химического элемента рассчитывается как частное
Слайд 11NaСl
O
2
ω(Э)
Cl
2
Н
2
O
SiO2
Известны массовые доли химических элементов ω(Э), однако неизвестны формулы вещества.
Для этого
Формулу вычисления можно создать, зная массовые доли.
Слайд 12Известно, что вещество состоит из:
0,4 массовой доли кальция (Са)
0,12 массовой доли
0,48 массовой доли кислорода (О)
= 40%;
= 12%;
= 48%.
0,4/40 (Са) : 0,12/12 (С) : 0,48/16 (О) = 0,01 : 0,01 : 0,03 = 1 : 1 : 3
40/40 (Са) : 12/12 (С) : 48/16 (О) = 1 : 1 : 3
CaCO3
— карбонат кальция
известняк
мрамор
мел
скорлупа яиц
Слайд 13
Вычисление массовой доли химического элемента в веществе производится по его химической