несколькими группами ОН.
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Основания (8 класс)
Содержание
- 1. Презентация по химии Основания (8 класс)
- 2. Запомни: 1) Гидроксогруппа
- 3. Запомни:4)
- 4. Соответствие ОКСИД -
- 5. По отношению к воде все основания делят
- 6. Водный раствор гидроксида калия
- 7. Пример нерастворимого основания – Сu(OH)2
- 8. Отдельные представители щелочейNaOH - твердое белое вещество,
- 9. Гидроксид натрия
- 10. Гидроксид калия КОН – едкое калиТвердое белое
- 11. Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они очень гигроскопичны.
- 12. Все щёлочи называют едкими, т. к. они разрушают бумагу, ткани, древесину.
- 13. Гидроксид калия повреждает ткань
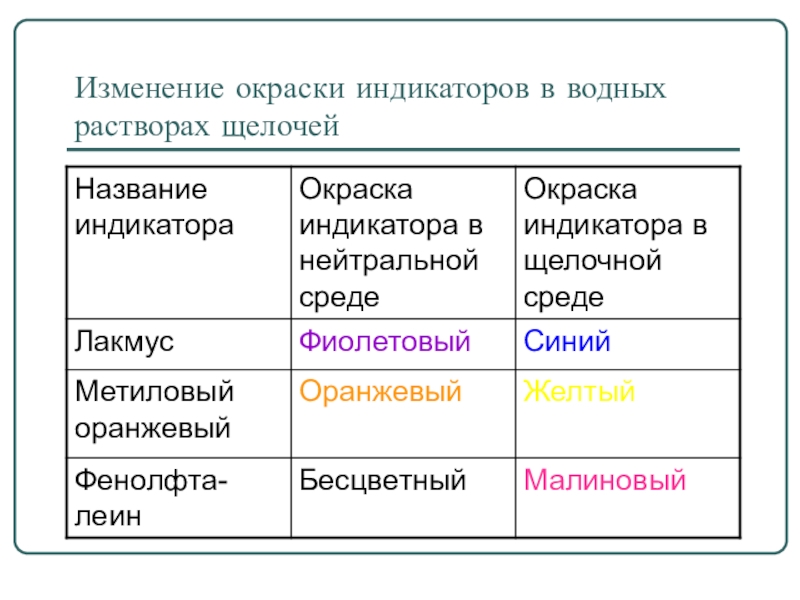
- 14. Изменение окраски индикаторов в водных растворах щелочей
- 15. Щёлочи изменяют окраску индикатора фенолфталеина (бесцветный – малиновый) фенолфталеиновый в щелочах всегда малиновый.
- 16. Получение основанийРастворимые основания получают 2 способами:1) Активный
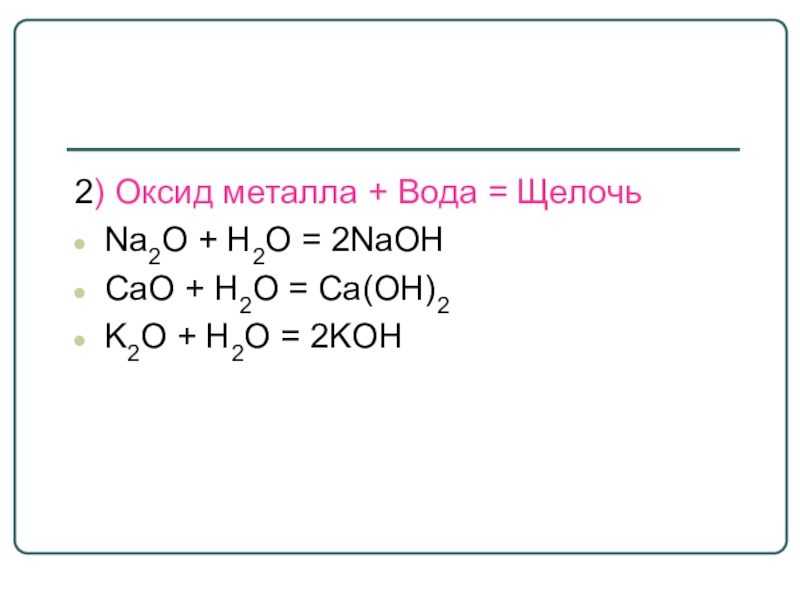
- 17. 2) Оксид металла + Вода = ЩелочьNa2O
- 18. Получение нерастворимых основанийРаствор соли + раствор щелочи
- 19. Химические свойстваСвойства щелочей:1) Реагируют с кислотами с
- 20. 2) Реагируют с растворами солей (если в
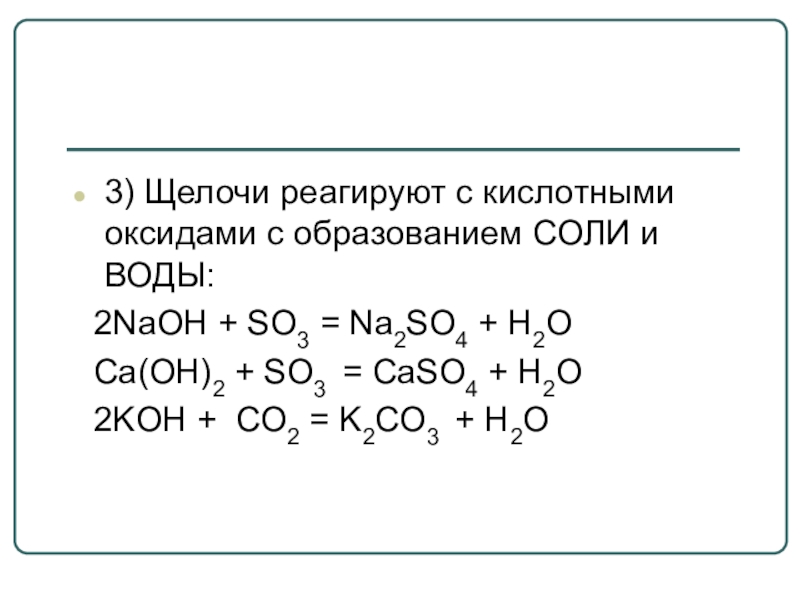
- 21. 3) Щелочи реагируют с кислотными оксидами с
- 22. Нерастворимые основания1) Реагируют с кислотами с образованием
- 23. 2) Разлагаются при нагревании c образованием оксида
- 24. Решите
Запомни: 1) Гидроксогруппа ОН – гидроксильная группа, имеет валентность I.2) Общая формула оснований Меn (ОН)n, где n – это валентность металла.3) Количество групп ОН зависит валентности металла:NaOH, Ca(OH)2 , Al(OH)3 , CuOH
Слайд 2 Запомни:
1) Гидроксогруппа ОН – гидроксильная группа,
имеет валентность I.
2) Общая формула оснований Меn (ОН)n, где n – это валентность металла.
3) Количество групп ОН зависит валентности металла:
NaOH, Ca(OH)2 , Al(OH)3 ,
CuOH , Fe(OH)3 , Ba(OH)2
2) Общая формула оснований Меn (ОН)n, где n – это валентность металла.
3) Количество групп ОН зависит валентности металла:
NaOH, Ca(OH)2 , Al(OH)3 ,
CuOH , Fe(OH)3 , Ba(OH)2
Слайд 3 Запомни:
4) По формуле основания можно
определить валентность металла:
Ni(OH)3 , Fe(OH)2 , KOH , Cu(OH)2.
5) Название состоит из:
«гидроксид» + металла»(валентность,
если она переменная).
Ni(OH)3 , Fe(OH)2 , KOH , Cu(OH)2.
5) Название состоит из:
«гидроксид» + металла»(валентность,
если она переменная).
Слайд 4Соответствие ОКСИД - ГИДРОКСИД
NaOH
–> Na2O оксид натрия
Cu(OH)2 –> CuO оксид меди(II)
Fe(OH)3 –> Fe2O3 оксид железа(III)
Al(OH)3 –> Al2O3 оксид алюминия
Fe(OH)2 –> FeO оксид жепеза (II)
CuOH –> Cu2O оксид меди (I)
Главное соответствие – валентность металла.
Cu(OH)2 –> CuO оксид меди(II)
Fe(OH)3 –> Fe2O3 оксид железа(III)
Al(OH)3 –> Al2O3 оксид алюминия
Fe(OH)2 –> FeO оксид жепеза (II)
CuOH –> Cu2O оксид меди (I)
Главное соответствие – валентность металла.
Слайд 5По отношению к воде все основания делят на две группы:
1) Растворимые
– щелочи- это гидроксиды металлов главной подгруппы I и II группы
NaOH LiOH
Ca(OH)2 Ba(OH)2
KOH
(можно определить по таблице растворимости)
NaOH LiOH
Ca(OH)2 Ba(OH)2
KOH
(можно определить по таблице растворимости)
2) Нерастворимые – гидроксиды всех остальных металлов
Cu(OH)2 Fe(OH)3
Al(OH)3 Mn(OH)2
Pb(OH)2 Fe(OH)2
Cu(OH) Be(OH)2
Н – нерастворимое
Р – растворимое
Слайд 8Отдельные представители щелочей
NaOH - твердое белое вещество, гигроскопичное, хорошо растворимое в
воде. Раствор мылкий на ощупь, очень едкий и разъедает кожу , ткани, бумагу и другие материалы, его называют едкий натр.
Его применяют в мыловарении, кожевенной и фармацевтической промышленности.
Его применяют в мыловарении, кожевенной и фармацевтической промышленности.
Слайд 10Гидроксид калия КОН – едкое кали
Твердое белое вещество, хорошо растворимое в
воде. Применяют в качестве добавки в производстве мыла и тугоплавкого стекла.
Гидроксид кальция Са(ОН)2 – гашеная известь, применяют в строительстве при кладке и штукатурке стен, для получения хлорной извести, которая является дезинфицирующим средством.
Гидроксид кальция Са(ОН)2 – гашеная известь, применяют в строительстве при кладке и штукатурке стен, для получения хлорной извести, которая является дезинфицирующим средством.
Слайд 11Гранулы гидроксидов калия и натрия расплываются, поглощая влагу из воздуха. Они
очень гигроскопичны.
Слайд 15Щёлочи изменяют окраску индикатора фенолфталеина (бесцветный – малиновый) фенолфталеиновый в щелочах
всегда малиновый.
Слайд 16Получение оснований
Растворимые основания получают 2 способами:
1) Активный металл + вода =
щелочь + водород
2Na + 2HOH = 2NaOH + H2
Ca + 2HOH = Ca(OH)2 + H2
2Li + 2HOH = 2 LiOH + H2
2Na + 2HOH = 2NaOH + H2
Ca + 2HOH = Ca(OH)2 + H2
2Li + 2HOH = 2 LiOH + H2
Слайд 18Получение нерастворимых оснований
Раствор соли + раствор щелочи = нерастворимое основание +
другая соль:
FeCl3 + 3NaOH = Fe(OH)3 + 3 NaCl
CuSO4 +2KOH = Cu(OH)2 + K2SO4
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
FeCl3 + 3NaOH = Fe(OH)3 + 3 NaCl
CuSO4 +2KOH = Cu(OH)2 + K2SO4
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
Слайд 19Химические свойства
Свойства щелочей:
1) Реагируют с кислотами с образованием соли и воды:
KOH + HCl = KCl + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Реакция обмена
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Реакция обмена
Слайд 20
2) Реагируют с растворами солей (если в их состав входит металл,
способный образовывать нерастворимое основание):
3NaOH + FeCl3 = Fe(OH)3 + 3 NaCl
2KOH + CuSO4 = Cu(OH)2 + K2SO4
2NaOH + ZnCl2 = Zn(OH)2 + 2NaCl
3NaOH + FeCl3 = Fe(OH)3 + 3 NaCl
2KOH + CuSO4 = Cu(OH)2 + K2SO4
2NaOH + ZnCl2 = Zn(OH)2 + 2NaCl
Слайд 21
3) Щелочи реагируют с кислотными оксидами с образованием СОЛИ и ВОДЫ:
2NaOH + SO3 = Na2SO4 + H2O
Ca(OH)2 + SO3 = CaSO4 + H2O
2KOH + СО2 = K2CО3 + H2O
Ca(OH)2 + SO3 = CaSO4 + H2O
2KOH + СО2 = K2CО3 + H2O
Слайд 22Нерастворимые основания
1) Реагируют с кислотами с образованием соли и воды:
Fe(OH)3
+ 3HCl = FeCl3 + 3H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Реакция нейтрализации
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Реакция нейтрализации
Слайд 23
2) Разлагаются при нагревании c образованием оксида металла и воды:
2Fe(OH)3
= Fe2O3 + 3H2O
Cu(OH)2 = CuO + H2O
Zn(OH)2 = ZnO + H2O
Cu(OH)2 = CuO + H2O
Zn(OH)2 = ZnO + H2O
Слайд 24 Решите задачи:
Определите какому количеству вещества
соответствует:
А) 7,4 грамма гидроксида кальция;
Б) 80 граммов гидроксида натрия;
В) 9,8 граммов гидроксида меди (II)?
Определите массу:
А) 0,25 моль гидроксида натрия;
Б) 2 моль гидроксида алюминия.
А) 7,4 грамма гидроксида кальция;
Б) 80 граммов гидроксида натрия;
В) 9,8 граммов гидроксида меди (II)?
Определите массу:
А) 0,25 моль гидроксида натрия;
Б) 2 моль гидроксида алюминия.