- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии Оксиды углерода (9 класс)
Содержание
- 1. Презентация по химии Оксиды углерода (9 класс)
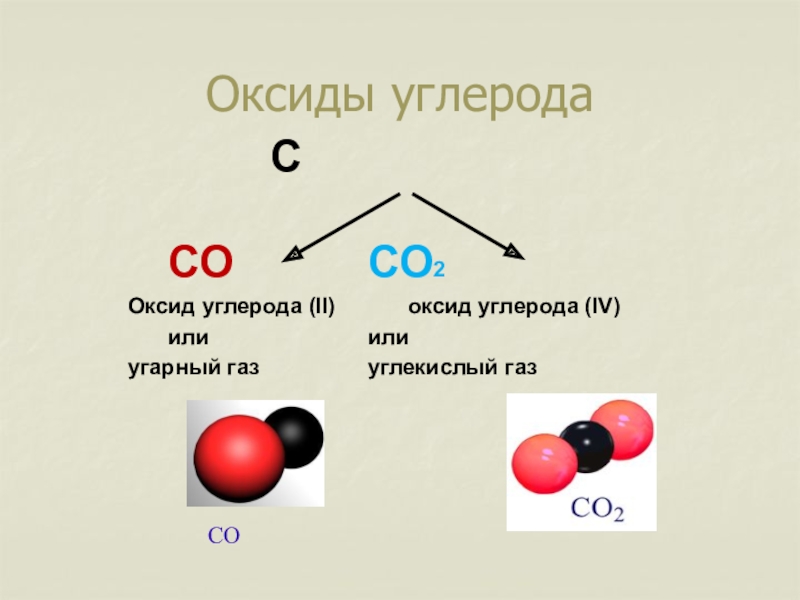
- 2. Оксиды углерода С СО СО2 Оксид углерода (II) оксид углерода (IV) или или угарный газ углекислый газСО
- 3. .
- 4. В сказочном царстве, химическом государстве жил-был граф
- 5. Углерод становился совсем другим, непохожим на самого
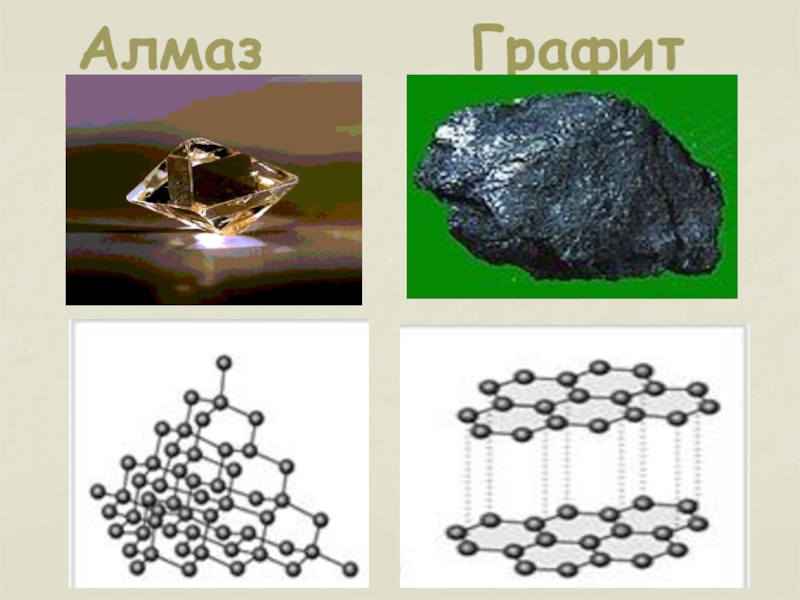
- 6. Алмаз Графит
- 7. Слайд 7
- 8. ХИМИЧЕСКИЙ ДИКТАНТ Выберите из предложенных утверждений
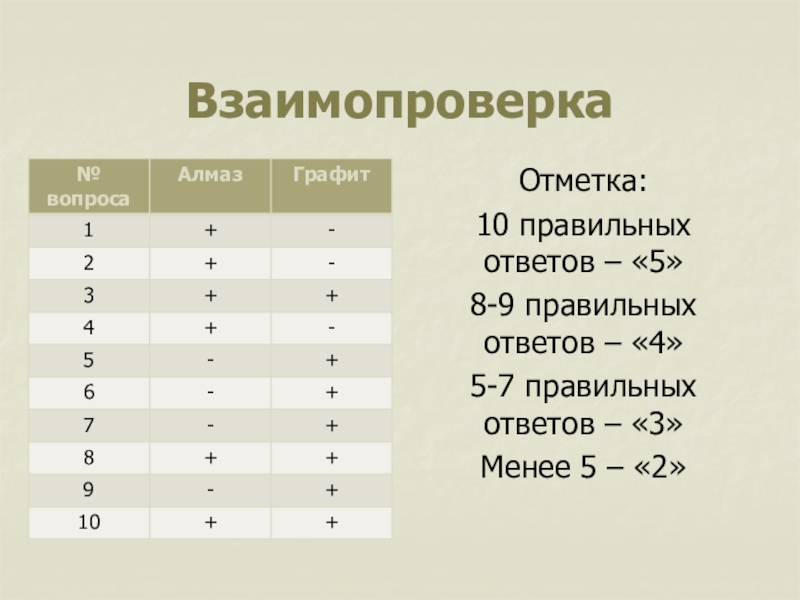
- 9. Взаимопроверка Отметка:10 правильных ответов – «5»8-9 правильных
- 10. Углерод очень любил принимать гостей, проявляя при
- 11. А с друзьями-металлами – карбиды:С+ Са =
- 12. Благодаря восстановительным свойствам было у Углерода два
- 13. Горение угля СО образуется при недостаке
- 14. А также CO2 можно получить восстановление оксида
- 15. ПОЛУЧЕНИЕ СО2 В лаборатории : действием
- 16. Дети росли, а отец радовался глядя на
- 17. Он как и папа, восстановителемвосстанавливал металлы из
- 18. В кислороде он горел голубоватым пламенем давая
- 19. Было у Угарного газа свойство, которое очень
- 20. Углекислый газ (Углекислик) был, как и брат,
- 21. гидрокарбонат натриякарбонат кальция
- 22. СО2 не горит и не поддерживает горение,
- 23. Только Известковая вода не любила Углекислика. Завидев
- 24. Углекислый газ помогал тушить пожары, производить
- 25. Углекислый газ покорил сердце красавицы
- 26. (Демонстрируем получение углекислого газа и его взаимодействие с известковой водой).
- 27. Дитя было бесцветное и слабое. Но,
- 28. Угольная Кислота, хотя и была очень
- 29. .
- 30. Графический диктант.Ф.И._______________________
- 31. Взаимопроверка Отметка:10 правильных ответов – «5»8-9 правильных
- 32. Дом.задание:& 23, упр.1 (письменно), заполните таблицу в графе « применение».
- 33. Слайд 33
- 34. Влияние СО на человека:Соединяясь с гемоглобином красных
- 35. Симптомы отравления угарным газомПри содержании 0,08% СО
- 36. Угарный газ содержится в табачном дыме!Содержание карбоксигемоглобина
- 37. Интересные факты:При сжигании 1 000 л топлива
- 38. Оказывает на человека наркотическое действие, раздражает кожу
- 39. «Крестики – нолики»Вещества, имеющие одинаковое значение степени окисления углерода:
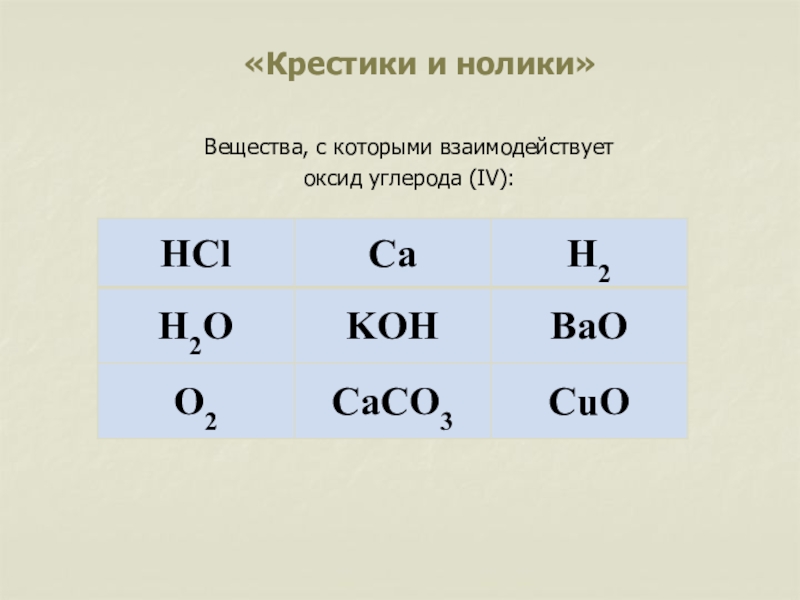
- 40. «Крестики и нолики»Вещества, с которыми взаимодействует оксид углерода (IV):
- 41. Слайд 41
- 42. Применяется оксид углерода (II) при производстве чугуна и метанола
- 43. Демонстрация реакции восстановления оксида меди (II) с водородом
Слайд 2Оксиды углерода
С
СО СО2
Оксид углерода (II) оксид углерода (IV)
или или
угарный газ углекислый газ
СО
Слайд 4В сказочном царстве, химическом государстве жил-был граф Углерод. Он был очень
Слайд 5Углерод становился совсем другим, непохожим на самого себя: очень твердым, бесцветным,
Граф был мягким и равнодушным, но, когда случалось вступать с кем-то в спор, когда на него оказывали давление и доводили его «до белого каления»,
В такой момент он был необычайно хорош и привлекал внимание всех красавиц сказочного государства.
Слайд 8 ХИМИЧЕСКИЙ ДИКТАНТ Выберите из предложенных утверждений только те, которые справедливы:
Прозрачный, бесцветный.
Очень твердый.
Ковалентная неполярная связь.
Не проводит электрический ток.
Используют как добавку в смазке.
Непрозрачный, серого цвета, с металлическим блеском.
Электропроводен.
Атомная кристаллическая решетка.
Легко расслаивается на отдельные мельчайшие пластинки.
При обычных условиях химически инертен, при высокой температуре становится активным.
Слайд 9Взаимопроверка
Отметка:
10 правильных ответов – «5»
8-9 правильных ответов – «4»
5-7 правильных
Менее 5 – «2»
Слайд 10Углерод очень любил принимать гостей, проявляя при этом свои окислительные способности.
С
C + 2Н2 = СН4
метан
Слайд 12Благодаря восстановительным свойствам было у Углерода два сына: Угарный газ (Угарик)
СО
И Углекислый газ (Углекислик)
СО2
Оксид углерода(II)
Слайд 13
Горение угля
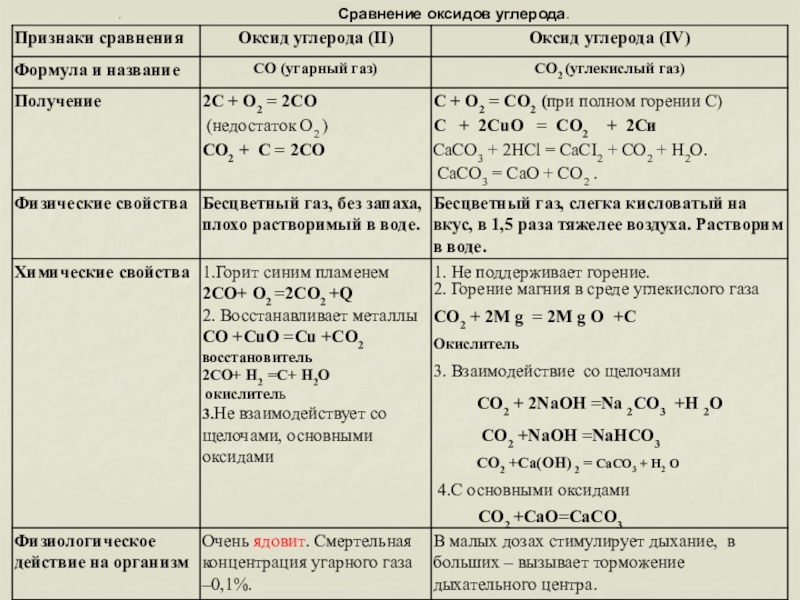
СО образуется при недостаке О2 т.е.при неполном сгорании топлива
образует углекислый газ
С + О2 = СО2
При нагревании С соединяется с О2, т.е при полном сгорании
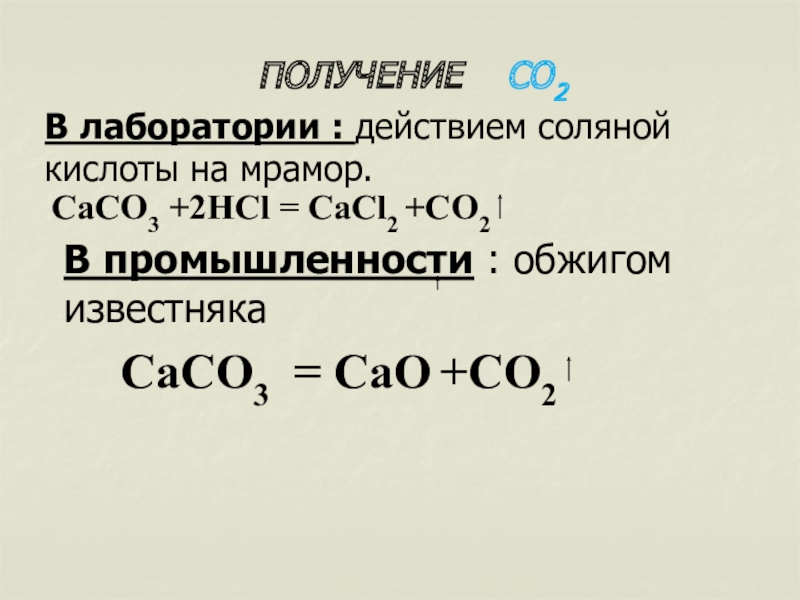
Слайд 15ПОЛУЧЕНИЕ СО2
В лаборатории : действием соляной кислоты на мрамор.
В промышленности : обжигом известняка
СаСО3 = CaО +CO2
СаСО3 +2НСl = CaCl2 +CO2
Слайд 16Дети росли, а отец радовался глядя на них. Угарный газ был
Слайд 17
Он как и папа, восстановителем
восстанавливал металлы
из их оксидов:
СО + Си+2О
В этой реакции углерод повышает свою степень окисления с 0 до +4, поэтому он является восстановителем, а медь понижает свою степень окисления с +2 до 0, поэтому медь – окислитель.
Восстановительное свойство оксида углерода (II) позволяет человечеству получать миллионы тонн чугуна и стали.
Слайд 18В кислороде он горел голубоватым пламенем давая много тепла
2C+2O + O2
СО – активный восстановитель
Слайд 19Было у Угарного газа свойство, которое очень огорчало отца: Угарик ни
СО – Яд!
Слайд 20Углекислый газ (Углекислик) был, как и брат, бесцветен, но в 1,5
воздуха, не поддерживает горение,
дыхание. Он был совсем не похож на отца, характер у него был добрый, он имел много друзей: вода, щелочи, основные оксиды,с которыми он образовывал соли, - основания и основные оксиды:
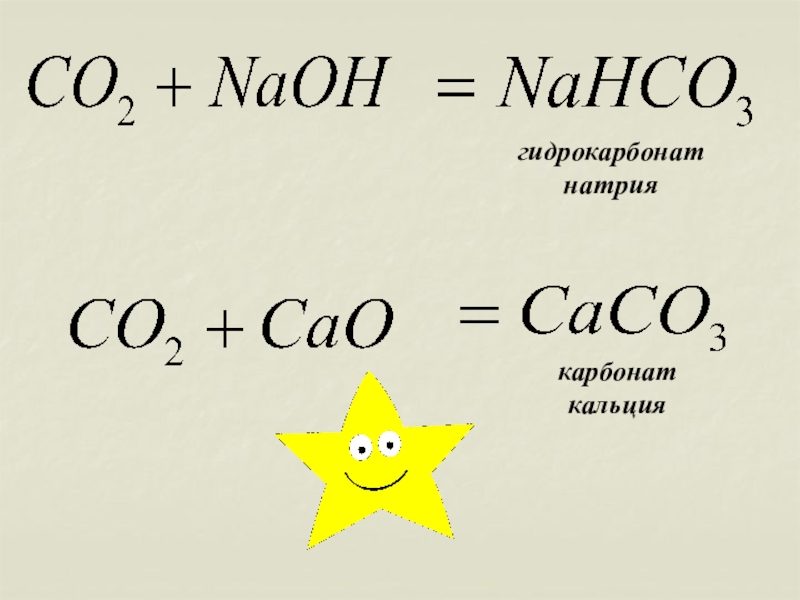
СО2 +2 NаОН = Nа2СО3 +Н2О
карбонат натрия
Слайд 22СО2 не горит и не поддерживает горение, однако магний горит в
С+4О2 +2Мg0 =2Мg+2О +С0
С+4 + 4е С0 окислитель
Мg0 - 2е Мg+2 восстановитель
СО2 - окислитель
Слайд 23Только Известковая вода не любила Углекислика. Завидев его, она начинала нервничать,
карбонат
кальция
Качественная реакция на карбонат- ион СО3 2-. Помутнение известковой воды:
Слайд 24 Углекислый газ помогал тушить пожары, производить сахар, соду, стекло и
другое. Углекислый газ умел превращаться в «сухой лед», чем очень гордился.
Однажды старый граф Углерод и его дети поехали на бал в Водное царство. Их встретила принцесса Вода. Она была так прекрасна в своем ослепительно-голубом наряде, что Углекислый газ сразу влюбился в нее и весь вечер танцевал только с принцессой.
Слайд 25 Углекислый газ покорил сердце красавицы Воды. Вскоре Вода и
Слайд 27 Дитя было бесцветное и слабое. Но, когда ребенка окропили раствором
Слайд 28 Угольная Кислота, хотя и была очень слабой, все же обладала
Металлы выделяли из нее водород:
Слайд 30 Графический диктант.
Ф.И._______________________
Группа II (С02).
Ставим "+", если это относится к вам.
1.Бесцветный газ, без запаха. Тяжелее воздуха.
2.Бесцветный газ, без запаха. Легче воздуха.
3. Проявляет кислотные свойства.
4.Проявляет окислительные свойства.
5. Проявляет восстановительные свойства.
6. Ядовит.
7. Соединяется с гемоглобином крови.
8. Получается размножением карбонатов.
9. Горюч.
10. Используется для тушения пожаров.
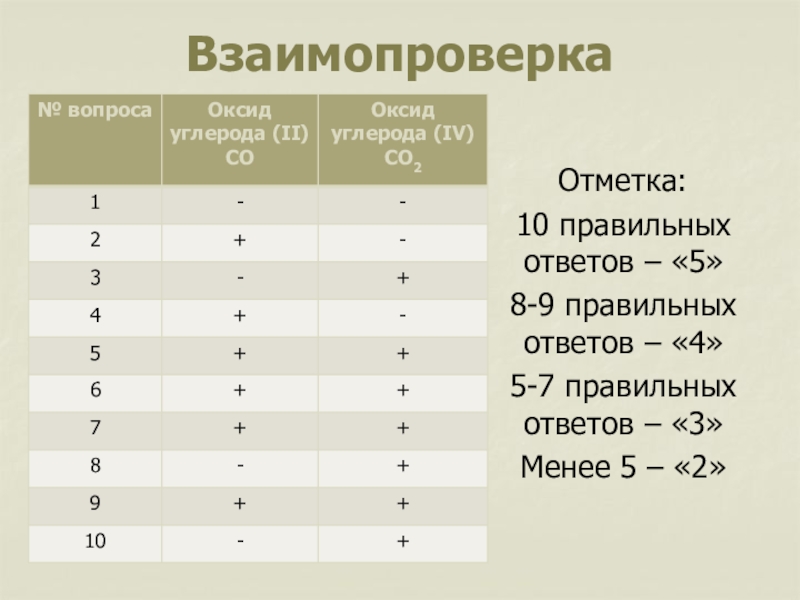
Слайд 31Взаимопроверка
Отметка:
10 правильных ответов – «5»
8-9 правильных ответов – «4»
5-7 правильных
Менее 5 – «2»
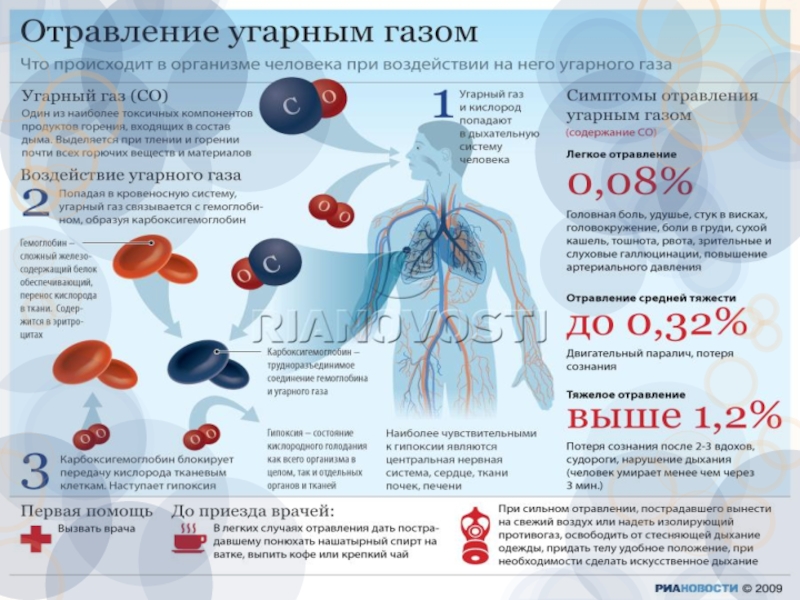
Слайд 34Влияние СО на человека:
Соединяясь с гемоглобином красных кровяных телец, переносчиков кислорода
Слайд 35Симптомы отравления угарным газом
При содержании 0,08% СО во вдыхаемом воздухе человек
При повышении концентрации СО до 0,32% возникает паралич и потеря сознания (смерть наступает через 30 минут).
При концентрации выше 1,2% сознание теряется после 2-3 вдохов, человек умирает менее чем через 3 минуты.
Слайд 36Угарный газ содержится в табачном дыме!
Содержание карбоксигемоглобина в крови у некурящих
у курильщиков отмечается до 25% дефицита кислорода, циркулирующего в крови;
все органы курильщика страдают от гипоксии. Постепенно развивается омертвление тканей (гангрена). Огромное количество людей потеряли ноги из-за курения;
чтобы компенсировать нехватку кислорода, сердце и легкие вынуждены работать с большей нагрузкой, что вызывает проблемы с кровообращением.
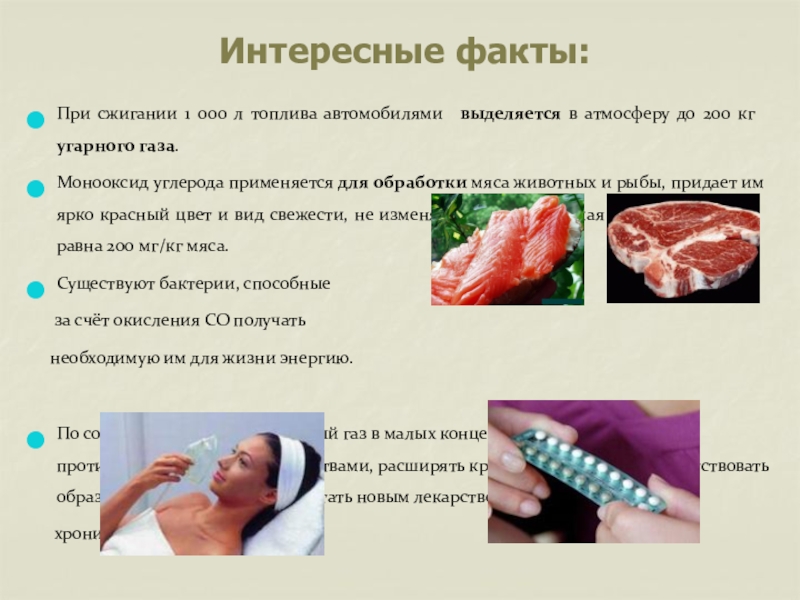
Слайд 37Интересные факты:
При сжигании 1 000 л топлива автомобилями выделяется в атмосферу
Монооксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса. Допустимая концентрация CO равна 200 мг/кг мяса.
Существуют бактерии, способные
за счёт окисления СО получать
необходимую им для жизни энергию.
По современным данным, угарный газ в малых концентрациях может обладать противовоспалительными свойствами, расширять кровеносные сосуды, препятствовать образованию тромбов и может стать новым лекарством от астмы и
хронического бронхита.
Слайд 38Оказывает на человека наркотическое действие, раздражает кожу и слизистые оболочки, оказывает
Влияние СО2 на человека: