- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Комплексные соединения (11 класс, профильный уровень)
Содержание
- 1. Презентация Комплексные соединения (11 класс, профильный уровень)
- 2. Решить задачуКрасная кровяная соль: М= 329г/моль, ω(К)
- 3. K3FeC6N6если это соль, то соль HCN –
- 4. К. Прутков«…многие вещи нам непонятны не потому,
- 5. Вы узнаете на уроке:Координационная теория;Строение комплексных соединений;Номенклатура
- 6. Координационная теория Альфреда Вернера (1893)Координационная теория использует понятия:комплексные соединения;атом – комплексообразователь;лиганды;координационное число;внутренняя сфера;внешняя сфера.
- 7. Большой вклад в развитие теории К.С. внесли российские ученые: А.А. ГринбергЛ.А.ЧугаевИ.И.Черняев
- 8. Строение комплексного соединения по Вернеру:
- 9. Строение комплексного соединения
- 10. Слайд 10
- 11. Слайд 11
- 12. Форма комплексного иона
- 13. Упражнение №1:Получите комплексные соединения:I вариант: гидроксида меди
- 14. В полученных К.С. укажите:ион – комплексообразователь;
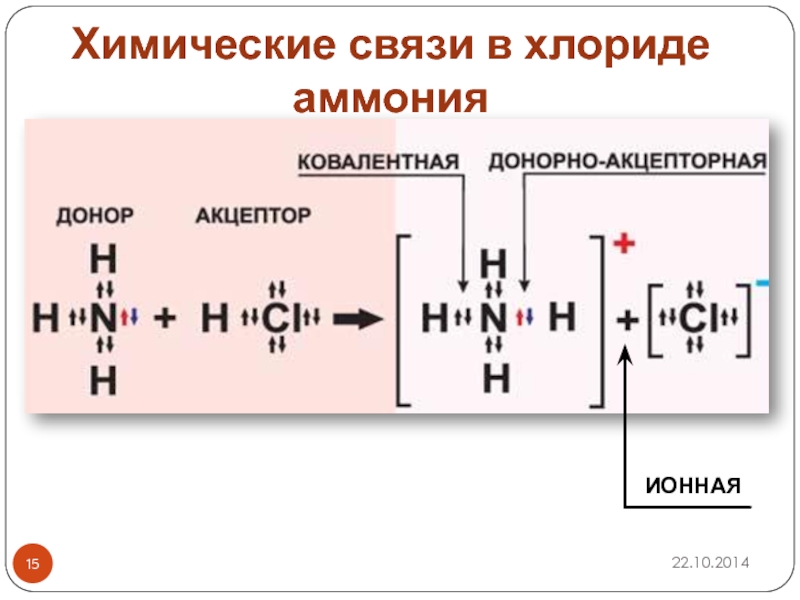
- 15. ИОННАЯХимические связи в хлориде аммония
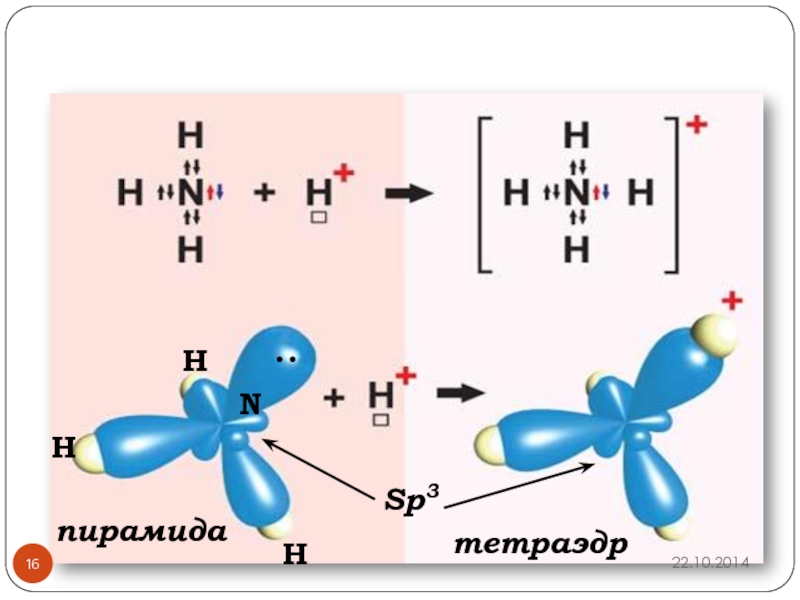
- 16. N• •HHHSp3пирамидатетраэдр
- 17. Заданиенапишите электронные формулы атома Fe и иона Fe3+покажите распределение валентных электронов по атомным орбиталям
- 18. 4S3dАтом Fe0:
- 19. Пространственное строение [Fe(CN)6]3- 3d4S4p •• ••
- 20. Связь между внешней и внутренней сферой –
- 21. Упражнение №2: I вариант
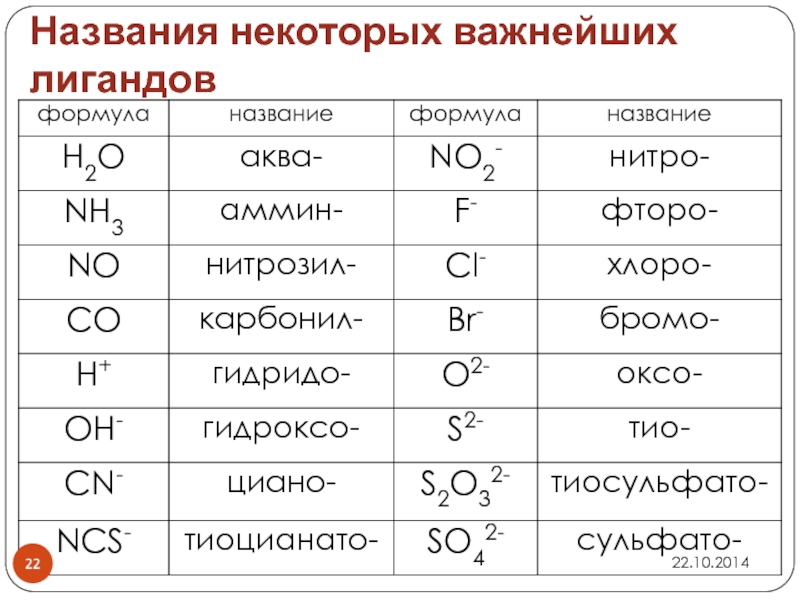
- 22. Названия некоторых важнейших лигандов
- 23. Номенклатура соединений с комплексным аниономK3[Fe(CN)6]
- 24. Номенклатура соединений с комплексным катионом[Cu(NH3)4]SO4
- 25. Упражнение №3:
- 26. Классификация комплексных соединенийПо заряду комплексной частицы:
- 27. Классификация комплексных соединенийПо природе лиганда:Аквакомплексы: [Al(H2O)6]Cl3, [Cu(H2O)4]SO4•H2O,
- 28. Медный купорос CuSO4•5H2O FeSO4•7H2O ― [Fe(H2O)6]SO4•H2O,AlCl3•6H2O ― [Al(H2O)6]Cl3,CuSO4•5H2O ― [Cu(H2O)4]SO4•H2OSO42―• H2Oвнешняя сферавнутренняя сфералигандыцентральный ион
- 29. Классификация комплексных соединений:По природе внешней сферы: а)кислоты
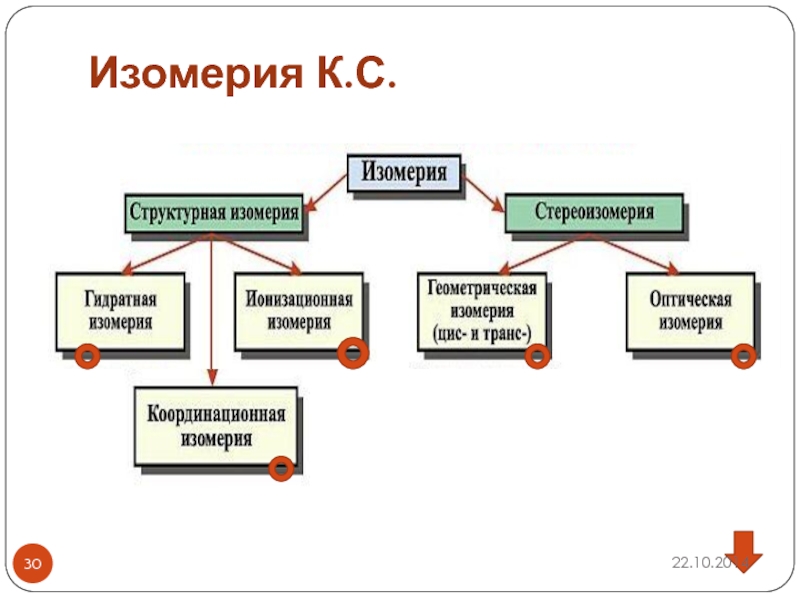
- 30. Изомерия К.С.
- 31. Структурная (гидратная) изомерия
- 32. Структурная ионизационная изомерия –связана с различным распределением ионов между внешней и внутренней сферой
- 33. Структурная координационная изомерия- обмен лигандами между комплексными анионами и катионом
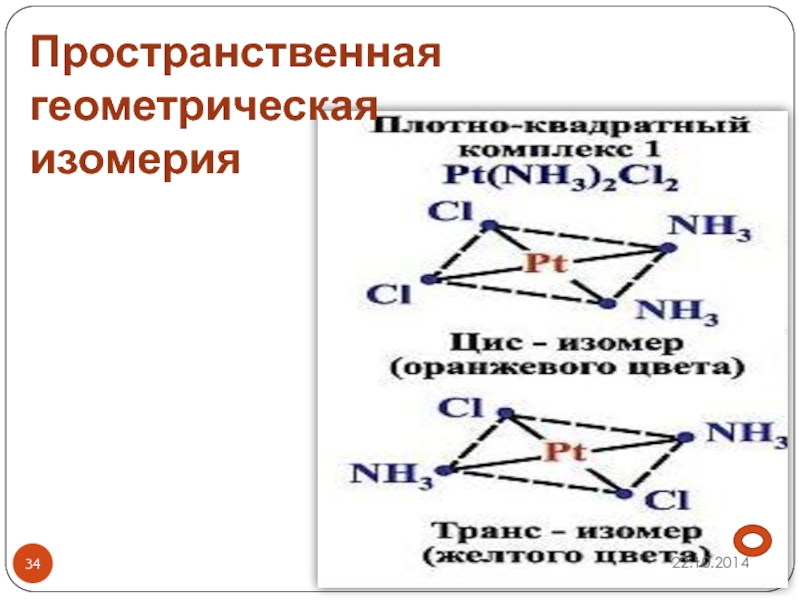
- 34. Пространственная геометрическая изомерия
- 35. Пространственная оптическая изомерияВозможна у тетраэдрических комплексов с 4 разными лигандами, либо у октаэдрических комплексов.
- 36. Упражнение №4:
- 37. Химические свойства К.С.диссоциация: [Cu(NH3)4]SO4
- 38. Константа нестойкости К.С.[Cu(NH3)4]2+
- 39. Химические свойства К.С.2.реакции по внешней сфере:FeCl3+K4[Fe(CN)6]→
- 40. Химические свойства К.С.3. реакции с участием лигандов:[Cu(NH3)4]SO4+4HCl→
- 41. Химические свойства К.С.4. Реакции по центральному иону:обменные:
- 42. Гемоглобин
- 43. Фрагменты молекул важнейших природных К.С.:небелковая часть молекулы гемоглобина, которую называют гемомгемоглобин
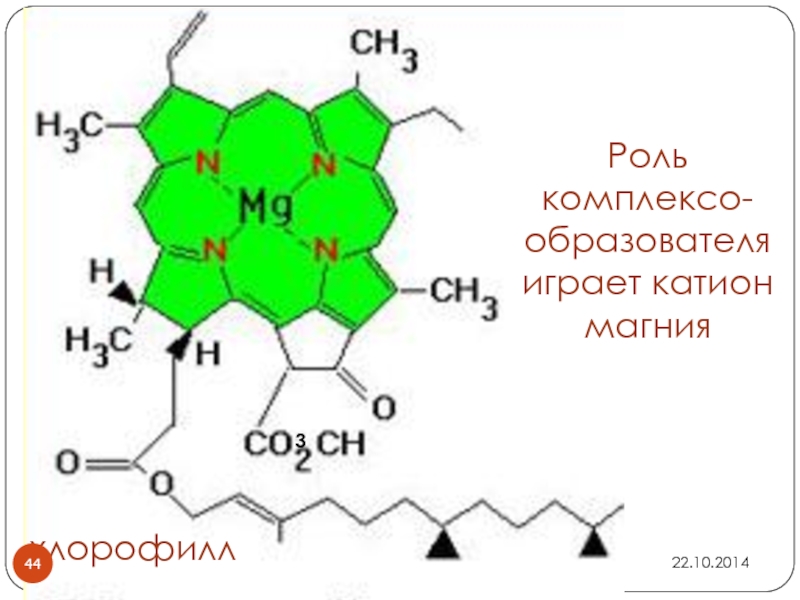
- 44. Роль комплексо-образователяиграет катион магния3хлорофилл
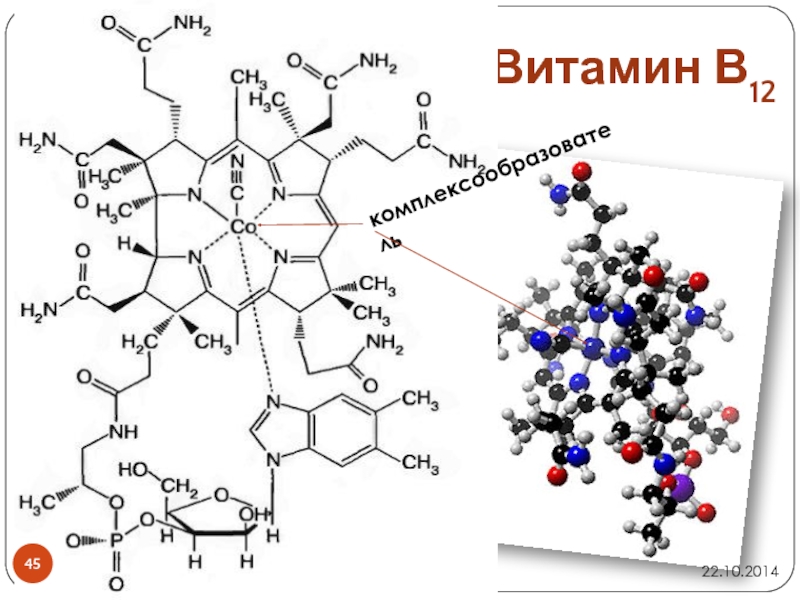
- 45. Витамин В12комплексообразователь
- 46. Применение К.С.извлечение металлов из руд, разделение и
- 47. Применение К.С. Fe3+ +K4[Fe(CN)6] = KFe
- 48. Применение К.С.2CoCl2+K4[Fe(CN)6]=Co2[Fe(CN)6]↓+4KCl;
- 49. Получение К.С.1750 г М.В.Ломоносов:3K4[Fe(CN)6]+2Fe2(SO4)3→Fe4[Fe(CN)6]3+6K2SO4 желтая кровяная соль
Решить задачуКрасная кровяная соль: М= 329г/моль, ω(К) = 35,56%ω (Fe) = 17,02%ω(C) = 21,88%ω(N) остальноеМолекулярная формула______?
Слайд 2Решить задачу
Красная кровяная соль:
М= 329г/моль,
ω(К) = 35,56%
ω (Fe) =
17,02%
ω(C) = 21,88%
ω(N) остальное
Молекулярная формула______?
ω(C) = 21,88%
ω(N) остальное
Молекулярная формула______?
Слайд 3
K3FeC6N6
если это соль,
то соль HCN – синильной кислоты
3 KCN •
Fe(CN)3
3 KCN•Fe(CN)3 3K++Fe3++6CN-
3 KCN•Fe(CN)3 3K++Fe3++6CN-
Слайд 4К. Прутков
«…многие вещи нам непонятны не потому, что наши понятия слабы,
но потому, что сии вещи не входят в круг наших понятий»
Слайд 5Вы узнаете на уроке:
Координационная теория;
Строение комплексных соединений;
Номенклатура комплексных соединений;
Классификация комплексных соединений;
Изомерия
комплексных соединений;
Химические свойства комплексных соединений;
Применение комплексных соединений;
Получение комплексных соединений;
Химические свойства комплексных соединений;
Применение комплексных соединений;
Получение комплексных соединений;
Слайд 6Координационная теория
Альфреда Вернера (1893)
Координационная теория использует понятия:
комплексные соединения;
атом – комплексообразователь;
лиганды;
координационное
число;
внутренняя сфера;
внешняя сфера.
внутренняя сфера;
внешняя сфера.
Слайд 7
Большой вклад в развитие теории К.С. внесли российские ученые:
А.А. Гринберг
Л.А.Чугаев
И.И.Черняев
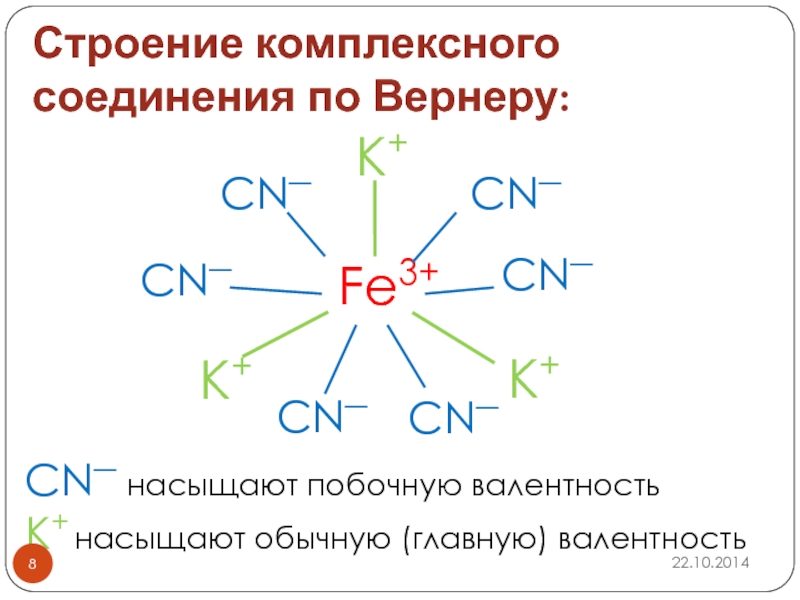
Слайд 8Строение комплексного соединения по Вернеру:
Fe3+
K+
K+
K+
CN―
CN―
CN―
CN―
CN―
CN―
CN― насыщают побочную валентность
K+ насыщают обычную (главную) валентность
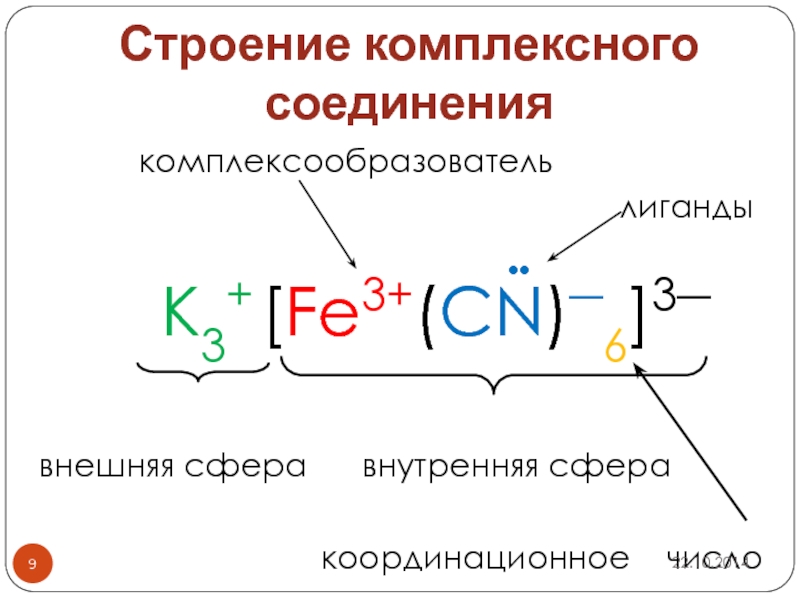
Слайд 9Строение комплексного соединения
комплексообразователь
лиганды
K3+ [Fe3+(CN)―6]3―
внешняя сфера внутренняя сфера
координационное число
••
Слайд 13Упражнение №1:
Получите комплексные соединения:
I вариант: гидроксида меди (II) с водным раствором
аммиака;
II вариант: хлорида серебра с водным раствором аммиака;
Составьте формулы этих соединений
II вариант: хлорида серебра с водным раствором аммиака;
Составьте формулы этих соединений
Слайд 14
В полученных К.С. укажите:
ион – комплексообразователь;
координационное число;
лиганды;
внутреннюю и
внешнюю сферы К.С.
заряды комплексного иона; комплексообразователя, лигандов;
предскажите возможное пространственное строение комплексного иона;
заряды комплексного иона; комплексообразователя, лигандов;
предскажите возможное пространственное строение комплексного иона;
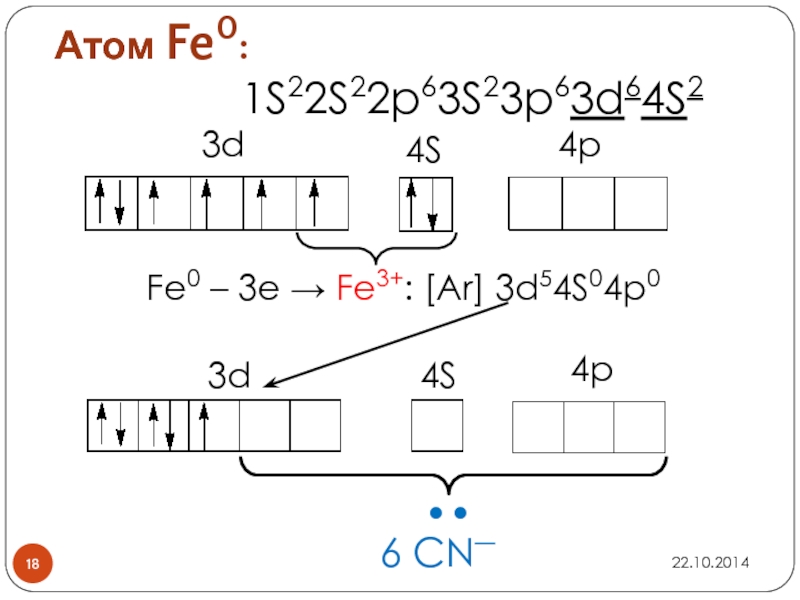
Слайд 17Задание
напишите электронные формулы атома Fe и иона Fe3+
покажите распределение валентных электронов
по атомным орбиталям
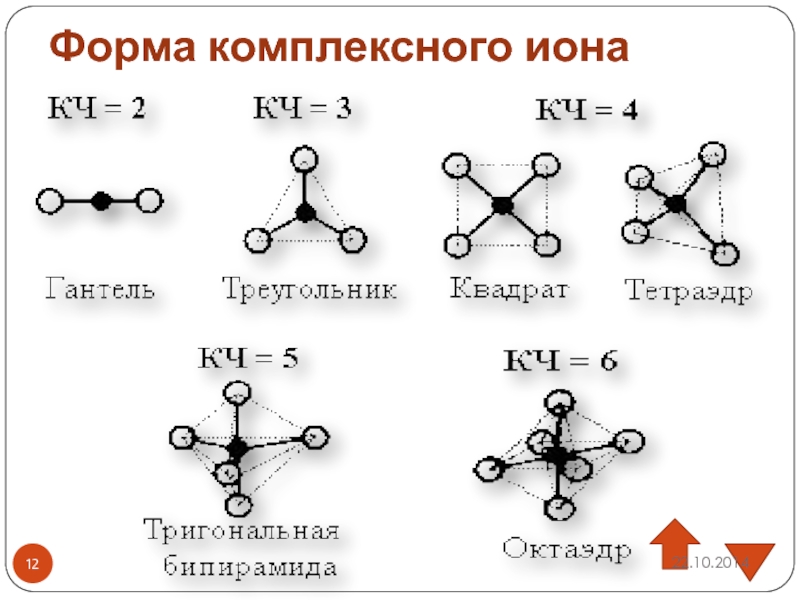
Слайд 19Пространственное строение [Fe(CN)6]3-
3d
4S
4p
•• •• •• ••
•• ••
CN CN CN CN CN CN
CN CN CN CN CN CN
Sp3d2 - гибридизация
октаэдр
Слайд 20Связь между внешней и внутренней сферой – ионная
K3[Fe(CN)6]
[Fe(CN)6]3― + 3K+
при растворении разрушается, поэтому существует ионная проводимость.
при растворении разрушается, поэтому существует ионная проводимость.
Слайд 21Упражнение №2:
I вариант
II вариант
[Cu(NH3)4](OH)2 [Ag(NH3)2]Cl
напишите электронную формулу атомов и ионов – комплексообразователей; составьте графическую схему распределения валентных электронов по орбиталям в центральных ионах;
изобразите образование Д.-А. связи в комплексном ионе. Укажите донор и акцептор;
укажите тип гибридизации А.О., к.ч., предполагаемое пространственное строение комплексного иона.
[Cu(NH3)4](OH)2 [Ag(NH3)2]Cl
напишите электронную формулу атомов и ионов – комплексообразователей; составьте графическую схему распределения валентных электронов по орбиталям в центральных ионах;
изобразите образование Д.-А. связи в комплексном ионе. Укажите донор и акцептор;
укажите тип гибридизации А.О., к.ч., предполагаемое пространственное строение комплексного иона.
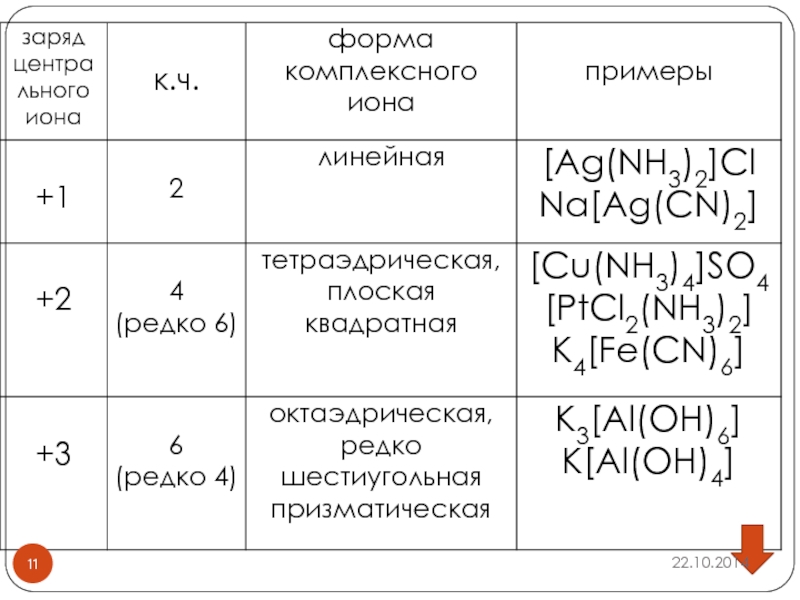
Слайд 26 Классификация комплексных соединений
По заряду комплексной частицы:
а) катионные (комплексный катион)
- [Ag(NH3)2]Cl;
б) анионные (комплексный анион) - K4[Fe(CN)6];
в) катионанионные (комплексные анион и катион) – [Cu(NH3)4][PtCl4];
г) нейтральные
(комплексная группа нейтральна) – [Fe0(CO)05], [Pt2+(NH3)2Cl-2], [Cr(C6H6)2]
б) анионные (комплексный анион) - K4[Fe(CN)6];
в) катионанионные (комплексные анион и катион) – [Cu(NH3)4][PtCl4];
г) нейтральные
(комплексная группа нейтральна) – [Fe0(CO)05], [Pt2+(NH3)2Cl-2], [Cr(C6H6)2]
Слайд 27Классификация комплексных соединений
По природе лиганда:
Аквакомплексы: [Al(H2O)6]Cl3, [Cu(H2O)4]SO4•H2O, [Fe(H2O)6] SO4•H2O;
Аммиакаты: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl,
[PtCl2(NH3)2];
Карбонилы металлов: [Ni(CO)4], [Fe(CO)5];
Гидроксокомплексы: - Na2[Zn(ОН)4(H2O)2];
Ацидокомплексы: - K4[Fe(CN)6]; K2[BeF4].
Карбонилы металлов: [Ni(CO)4], [Fe(CO)5];
Гидроксокомплексы: - Na2[Zn(ОН)4(H2O)2];
Ацидокомплексы: - K4[Fe(CN)6]; K2[BeF4].
Слайд 28Медный купорос CuSO4•5H2O
FeSO4•7H2O ― [Fe(H2O)6]SO4•H2O,
AlCl3•6H2O ― [Al(H2O)6]Cl3,
CuSO4•5H2O ― [Cu(H2O)4]SO4•H2O
SO42―• H2O
внешняя
сфера
внутренняя сфера
лиганды
центральный
ион
Слайд 29Классификация комплексных соединений:
По природе внешней сферы:
а)кислоты – H[AuCl4];
б)основания -
[Ag(NH3)2]OH;
в)соли – Na3[AlF6];
г)неэлектролиты – [Pt(NH3)2Cl2].
в)соли – Na3[AlF6];
г)неэлектролиты – [Pt(NH3)2Cl2].
Слайд 32Структурная
ионизационная изомерия –
связана с различным распределением ионов между внешней и
внутренней сферой
Слайд 33Структурная координационная изомерия
- обмен лигандами между комплексными анионами и катионом
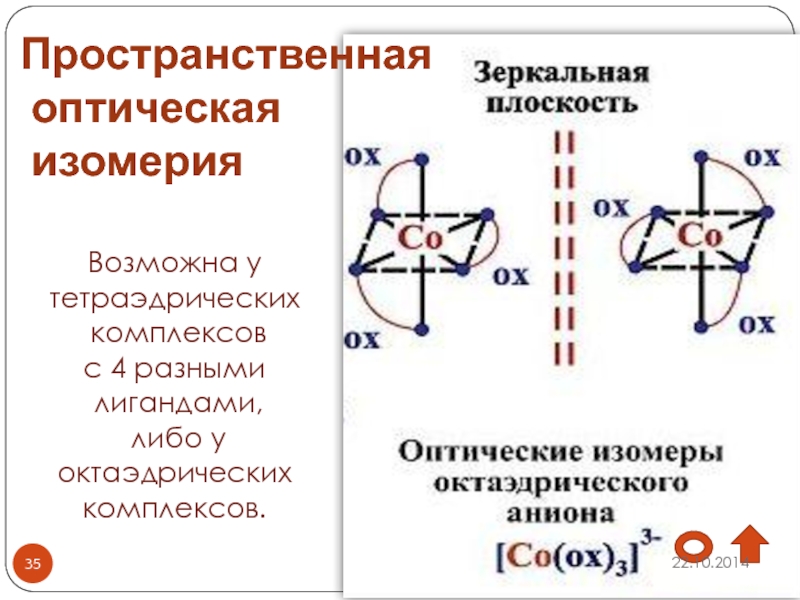
Слайд 35Пространственная
оптическая
изомерия
Возможна у тетраэдрических
комплексов
с 4 разными
лигандами,
либо
у
октаэдрических
комплексов.
октаэдрических
комплексов.
Слайд 37Химические свойства К.С.
диссоциация:
[Cu(NH3)4]SO4 [Cu(NH3)4]2++ SO42-
комплексные ионы
достаточно устойчивы, они - слабые электролиты, способны ступенчато отщеплять в водный раствор лиганды:
[Cu(NH3)4]2+ [Cu(NH3)3]2++ NH3
[Cu(NH3)3]2+ [Cu(NH3)2]2++ NH3
и т.д.
[Cu(NH3)4]2+ [Cu(NH3)3]2++ NH3
[Cu(NH3)3]2+ [Cu(NH3)2]2++ NH3
и т.д.
Слайд 38Константа нестойкости К.С.
[Cu(NH3)4]2+ Cu2+ + 4NH3
Кн=
[Cu(NH3)4]2+: Кн=9,33•10―13
[Cd(NH3)4]2+: Кн=2,75•10―7 –
более прочный комплекс образует катион меди.
[Cu2+]•[NH3]4
[[Cu(NH3)4]2+]
Слайд 39Химические свойства К.С.
2.реакции по внешней сфере:
FeCl3+K4[Fe(CN)6]→
KFe[Fe(CN)6]↓+ 3KCl
[Cu(NH3)4]SO4+BaCl2→
[Cu(NH3)4]Cl2+ BaSO4↓
[Cu(NH3)4]SO4+BaCl2→
[Cu(NH3)4]Cl2+ BaSO4↓
Слайд 41Химические свойства К.С.
4. Реакции по центральному иону:
обменные:
[Ag(NH3)2]Cl + KI→
AgI↓ + KCl + 2NH3
окислительно-восстановительные:
2[Ag(NH3)2]OH+R-CHO →
альдегид →2Ag+RCOONH4+H2O+3NH3
«серебряное зеркало»
окислительно-восстановительные:
2[Ag(NH3)2]OH+R-CHO →
альдегид →2Ag+RCOONH4+H2O+3NH3
«серебряное зеркало»
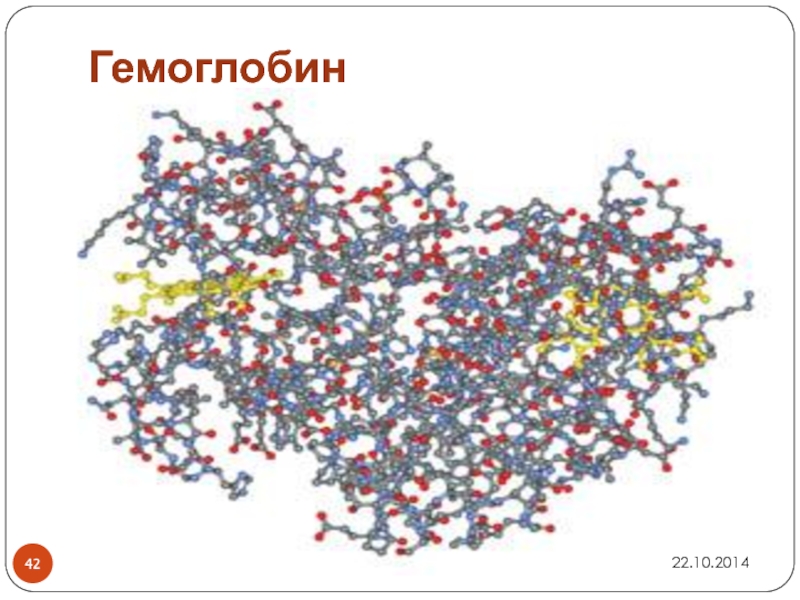
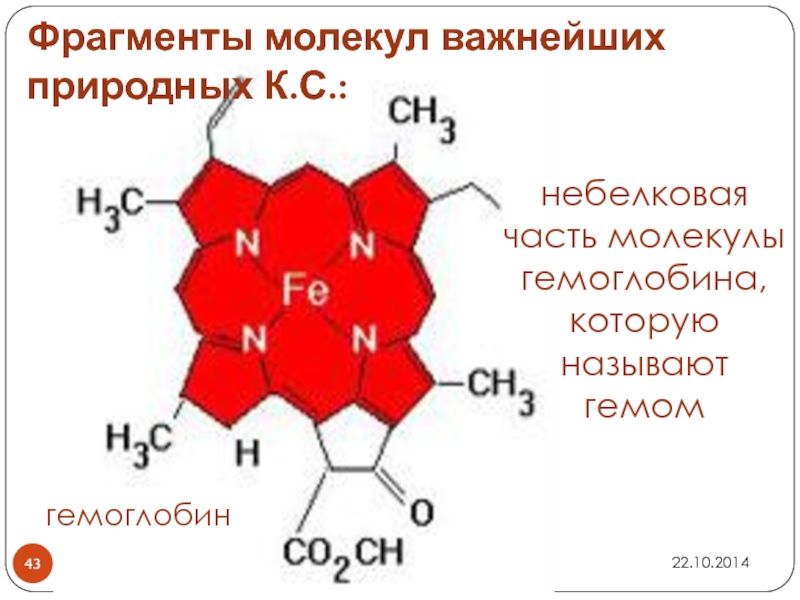
Слайд 43Фрагменты молекул важнейших природных К.С.:
небелковая часть молекулы гемоглобина, которую называют гемом
гемоглобин
Слайд 46Применение К.С.
извлечение металлов из руд, разделение и очистка платиновых и редкоземельных
металлов;
нанесение очень тонких и прочных металлических покрытий (при разложении карбонилов Ме);
умягчение воды;
в качестве катализаторов:
CH2=CH2+½O2 CH3-CHO
в аналитической химии;
нанесение очень тонких и прочных металлических покрытий (при разложении карбонилов Ме);
умягчение воды;
в качестве катализаторов:
CH2=CH2+½O2 CH3-CHO
в аналитической химии;
Слайд 47Применение К.С.
Fe3+ +K4[Fe(CN)6] = KFe [Fe(CN)6]↓;
желтая берлинская лазурь
кровяная соль
Fe2++ K3[Fe(CN)6] = KFe[Fe(CN)6]3↓.
красная турнбулева синь
кровяная соль
кровяная соль
Fe2++ K3[Fe(CN)6] = KFe[Fe(CN)6]3↓.
красная турнбулева синь
кровяная соль
Слайд 48Применение К.С.
2CoCl2+K4[Fe(CN)6]=Co2[Fe(CN)6]↓+4KCl;
коричневый
2NiCl2+K4[Fe(CN)6]=Ni2[Fe(CN)6]↓+4KCl;
зеленый
3CoCl2+2K3[Fe(CN)6]=Co3[Fe(CN)6]↓+6KCl
красный
2NiCl2+2K3[Fe(CN)6]=Ni3[Fe(CN)6]2↓+2KCl
желтый
2NiCl2+K4[Fe(CN)6]=Ni2[Fe(CN)6]↓+4KCl;
зеленый
3CoCl2+2K3[Fe(CN)6]=Co3[Fe(CN)6]↓+6KCl
красный
2NiCl2+2K3[Fe(CN)6]=Ni3[Fe(CN)6]2↓+2KCl
желтый
Слайд 49Получение К.С.
1750 г М.В.Ломоносов:
3K4[Fe(CN)6]+2Fe2(SO4)3→Fe4[Fe(CN)6]3+6K2SO4
желтая кровяная соль берлинская лазурь
1749 г.
на фабриках московских купцов П.Сухарева и И.Беляева животные отбросы спекали вместе с карбонатом калия и железными опилками;
спек обрабатывают горячей водой:
6KCN + FeS → K4[Fe(CN)6] + K2S;
раствор упаривали до начала кристаллизации K4[Fe(CN)6]•ЗН2O.
спек обрабатывают горячей водой:
6KCN + FeS → K4[Fe(CN)6] + K2S;
раствор упаривали до начала кристаллизации K4[Fe(CN)6]•ЗН2O.







![Презентация Комплексные соединения (11 класс, профильный уровень) Координационное число 6 [Fe(CN)6]3― ион Fe3+лиганды CN―Форма иона - октаэдр Координационное число 6 [Fe(CN)6]3― ион Fe3+лиганды CN―Форма](/img/thumbs/cd13e5cd605f8bb57b759ecf90d606cf-800x.jpg)



![Презентация Комплексные соединения (11 класс, профильный уровень) Пространственное строение [Fe(CN)6]3- 3d4S4p •• •• •• •• •• ••CN CN Пространственное строение [Fe(CN)6]3- 3d4S4p •• •• •• •• •• ••CN CN CN](/img/thumbs/460cf153bb5e56ab54d94f8b45158109-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Связь между внешней и внутренней сферой – ионная K3[Fe(CN)6] [Fe(CN)6]3― Связь между внешней и внутренней сферой – ионная K3[Fe(CN)6] [Fe(CN)6]3― + 3K+при растворении разрушается,](/img/thumbs/b8127e9add84eba9b86ebc3e5768d0d5-800x.jpg)

![Презентация Комплексные соединения (11 класс, профильный уровень) Номенклатура соединений с комплексным аниономK3[Fe(CN)6] Номенклатура соединений с комплексным аниономK3[Fe(CN)6]](/img/thumbs/465a3ebcb703f3971a89036b4aedb028-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Номенклатура соединений с комплексным катионом[Cu(NH3)4]SO4 Номенклатура соединений с комплексным катионом[Cu(NH3)4]SO4](/img/thumbs/9394e0fab577c5c9ce7c9355a2d11925-800x.jpg)

![Презентация Комплексные соединения (11 класс, профильный уровень) Классификация комплексных соединенийПо заряду комплексной частицы: а) катионные (комплексный катион) Классификация комплексных соединенийПо заряду комплексной частицы: а) катионные (комплексный катион) - [Ag(NH3)2]Cl;б) анионные (комплексный анион) -](/img/thumbs/ebc0184a1ca219a23e0193099aec1bb3-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Классификация комплексных соединенийПо природе лиганда:Аквакомплексы: [Al(H2O)6]Cl3, [Cu(H2O)4]SO4•H2O, [Fe(H2O)6] SO4•H2O;Аммиакаты: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl, Классификация комплексных соединенийПо природе лиганда:Аквакомплексы: [Al(H2O)6]Cl3, [Cu(H2O)4]SO4•H2O, [Fe(H2O)6] SO4•H2O;Аммиакаты: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl, [PtCl2(NH3)2];Карбонилы металлов: [Ni(CO)4], [Fe(CO)5]; Гидроксокомплексы: -](/img/thumbs/ba3be59df02dad8e3172d3bc9b271ba4-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Медный купорос CuSO4•5H2O FeSO4•7H2O ― [Fe(H2O)6]SO4•H2O,AlCl3•6H2O ― [Al(H2O)6]Cl3,CuSO4•5H2O ― [Cu(H2O)4]SO4•H2OSO42―• H2Oвнешняя сферавнутренняя сфералигандыцентральный ион Медный купорос CuSO4•5H2O FeSO4•7H2O ― [Fe(H2O)6]SO4•H2O,AlCl3•6H2O ― [Al(H2O)6]Cl3,CuSO4•5H2O ― [Cu(H2O)4]SO4•H2OSO42―• H2Oвнешняя сферавнутренняя сфералигандыцентральный ион](/img/thumbs/fd2baff7413b308d64d737123d30fc80-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Классификация комплексных соединений:По природе внешней сферы: а)кислоты – H[AuCl4]; б)основания - Классификация комплексных соединений:По природе внешней сферы: а)кислоты – H[AuCl4]; б)основания - [Ag(NH3)2]OH; в)соли – Na3[AlF6]; г)неэлектролиты –](/img/thumbs/ecaf6768c6c8af08d2b75a5b417e7230-800x.jpg)




![Презентация Комплексные соединения (11 класс, профильный уровень) Химические свойства К.С.диссоциация: [Cu(NH3)4]SO4 [Cu(NH3)4]2++ SO42-комплексные ионы достаточно устойчивы, они Химические свойства К.С.диссоциация: [Cu(NH3)4]SO4 [Cu(NH3)4]2++ SO42-комплексные ионы достаточно устойчивы, они - слабые электролиты,](/img/thumbs/bbd6aa3e6f3068d7d3927234b2aad16c-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Константа нестойкости К.С.[Cu(NH3)4]2+ Cu2+ + 4NH3 Кн= [Cu(NH3)4]2+: Константа нестойкости К.С.[Cu(NH3)4]2+ Cu2+ + 4NH3 Кн= [Cu(NH3)4]2+: Кн=9,33•10―13[Cd(NH3)4]2+: Кн=2,75•10―7 –](/img/thumbs/dc00a0fd4d60018a982a108b436ae46c-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Химические свойства К.С.2.реакции по внешней сфере:FeCl3+K4[Fe(CN)6]→ Химические свойства К.С.2.реакции по внешней сфере:FeCl3+K4[Fe(CN)6]→ KFe[Fe(CN)6]↓+](/img/thumbs/8ee21fc4b6cc0033a412afcaa7ed6854-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Химические свойства К.С.3. реакции с участием лигандов:[Cu(NH3)4]SO4+4HCl→ CuSO4+ 4NH4Cl Химические свойства К.С.3. реакции с участием лигандов:[Cu(NH3)4]SO4+4HCl→ CuSO4+ 4NH4Cl](/img/thumbs/b96a2ffa23346b6c4e819383987d430a-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Химические свойства К.С.4. Реакции по центральному иону:обменные: [Ag(NH3)2]Cl + KI→ Химические свойства К.С.4. Реакции по центральному иону:обменные: [Ag(NH3)2]Cl + KI→](/img/thumbs/21b2d5b2bd1327b2d4ce2db6b3814399-800x.jpg)

![Презентация Комплексные соединения (11 класс, профильный уровень) Применение К.С. Fe3+ +K4[Fe(CN)6] = KFe [Fe(CN)6]↓; Применение К.С. Fe3+ +K4[Fe(CN)6] = KFe [Fe(CN)6]↓;](/img/thumbs/c58c63c925ef21cf6b67486ff7bcdbd9-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Применение К.С.2CoCl2+K4[Fe(CN)6]=Co2[Fe(CN)6]↓+4KCl; Применение К.С.2CoCl2+K4[Fe(CN)6]=Co2[Fe(CN)6]↓+4KCl;](/img/thumbs/926c9fc9a8f0e3f10427d75c1576c506-800x.jpg)
![Презентация Комплексные соединения (11 класс, профильный уровень) Получение К.С.1750 г М.В.Ломоносов:3K4[Fe(CN)6]+2Fe2(SO4)3→Fe4[Fe(CN)6]3+6K2SO4 желтая кровяная соль берлинская лазурь1749 г. на Получение К.С.1750 г М.В.Ломоносов:3K4[Fe(CN)6]+2Fe2(SO4)3→Fe4[Fe(CN)6]3+6K2SO4 желтая кровяная соль берлинская лазурь1749 г. на фабриках московских купцов П.Сухарева и](/img/thumbs/d7543e01dc8784735248b32242f92cfb-800x.jpg)





