- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему: Водород
Содержание
- 1. Презентация по химии на тему: Водород
- 2. План:Водород в природе.Водород как химический элемент.Открытие водорода.Получение водорода.Физические свойства водорода.Химические свойства водорода.Применение водорода.
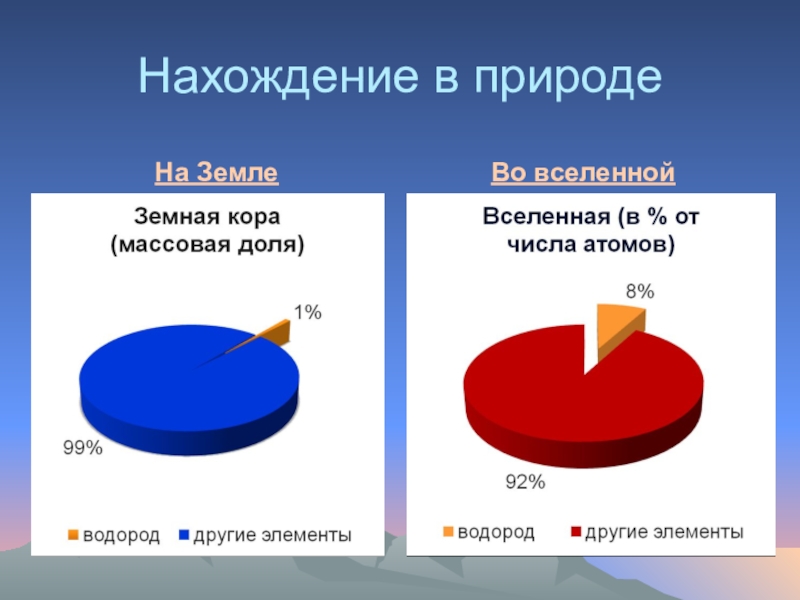
- 3. Нахождение в природеНа ЗемлеВо вселенной
- 4. Водород на Земле
- 5. Распространение на Земле
- 6. На планете Земля по распространенности водород занимает
- 7. Водород в атмосфере
- 8. В составе атмосферного воздуха присутствие водорода менее
- 9. Водород во Вселенной
- 10. Водород - самый распространенный химический элемент во
- 11. Место водорода в Периодической системе химических элементов Д.И.Менделеева
- 12. Водород – химический элемент.Порядковый номер водорода 1.Водород
- 13. Аргументы в пользу помещения водорода в подгруппущелочных
- 14. Свойства атома водорода
- 15. Строение атома водородаАтом водорода состоит из ядра,
- 16. Изотопы водородаВодород имеет три изотопа: протий Н,
- 17. Свойства изотопов водородаВсе изотопные формы водорода обладают
- 18. Открытие водородаВодород был получен еще в первой половине XVI века немецким врачом и естествоиспытателем Т.Парацельсом.
- 19. В 1776 г. Х.Кавендиш (Англия) открыл водород.
- 20. Лишь в 1787 году Антуан Лавуазье доказал,
- 21. Получение водорода в промышленностиМировой уровень промышленного получения
- 22. Электролиз раствора щелочиН₂О Н₂↑ + О₂↑
- 23. Взаимодействие угля с парами водыПропускание паров воды
- 24. Получение из природного газа Современные
- 25. Получение водорода из воды с помощью солнечной энергии
- 26. Получение водорода в лабораторииВ лабораторных условиях для
- 27. Взаимодействие разбавленных кислот с металлами средней активностиМеталлы
- 28. Слайд 28
- 29. Взаимодействие амфотерных металлов с растворами щелочейПолучение водорода
- 30. Слайд 30
- 31. Гидролиз гидридов металловCaH₂ + H₂O = Ca(OH)₂ +H₂↑
- 32. Са+2Н₂О=Са(ОН)₂+Н₂↑Взаимодействие кальция с водой
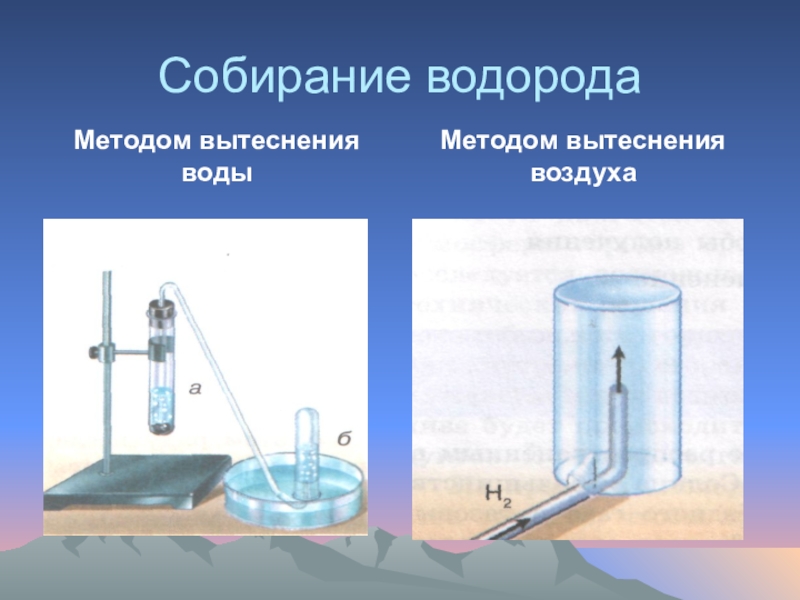
- 33. Собирание водородаМетодом вытеснения водыМетодом вытеснения воздуха
- 34. Техника безопасности при работе с водородомПрежде чем
- 35. Слайд 35
- 36. Физические свойства водородаЛёгкий горючий газ без цвета,
- 37. Водород – простое вещество.Молекула водорода состоит из
- 38. Химические свойства водородаВодород – восстановитель Н₂ -
- 39. Слайд 39
- 40. Слайд 40
- 41. Образование гремучей смесиОбычно лёгок и летуч,Он вдруг
- 42. Слайд 42
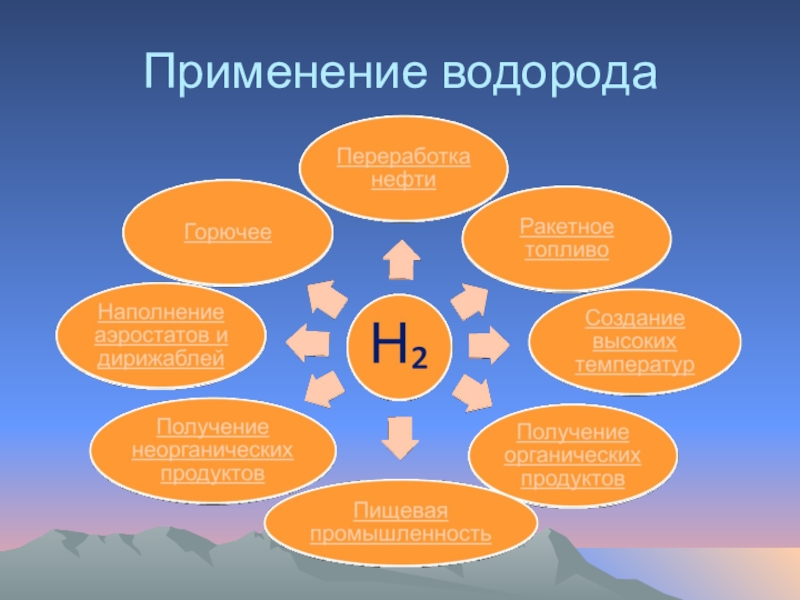
- 43. Применение водорода
- 44. Наполнение аэростатов и дирижаблейВодород как самый легкий
- 45. Применение водорода для создания высоких температур
- 46. Водород в качестве горючегоВодород – автомобильное топливо XXI века.
- 47. Применение водорода в переработке нефтиПриблизительно 12% всего
- 48. Применение водорода в пищевой промышленностиПроизводство маргарина. Водород
- 49. Получение неорганических продуктовПриблизительно 50% получаемого водорода используется
- 50. Слайд 50
- 51. Получение органических продуктовВодород используется в процессе синтеза
- 52. Ракетное топливо Водород является самым эффективным ракетным топливом.
- 53. Применение изотопов водородаИзотопы водорода – дейтерий и
- 54. Андрей Дмитриевич Сахаров 21 мая 1921 г.
- 55. Вопросы:Дайте общую характеристику элемента водорода. (*)Какова распространенность
- 56. Вопросы:Как перелить водород из одного сосуда в
- 57. Какое соединение богаче водородом: H₂O или CH₄
- 58. Переливание водорода из одного сосуда в другой.
- 59. Спасибо за внимание!
Слайд 2План:
Водород в природе.
Водород как химический элемент.
Открытие водорода.
Получение водорода.
Физические свойства водорода.
Химические свойства
Применение водорода.
Слайд 5Распространение на Земле
Водород в природе третий по химической распространенности элемент (после О и Si).16% атомов элементов – это атомы водорода. В свободном состоянии водород встречается крайне редко; он входит в состав газов, выделяемых вулканами. В гидросфере, литосфере и биосфере водород содержится чаще всего в связанном виде. Наиболее важное соединение водорода – вода. Водород входит в состав каменного угля, нефти, минералов, а также во все животные и растительные организмы.
Слайд 6На планете Земля по распространенности водород занимает девятое место.
Содержание его
В природных соединениях дейтерий и протий в среднем содержатся в отношении 1:6800 (по числу атомов). Тритий в природе находится в ничтожно малых количествах.
Водород в земной коре
Слайд 8В составе атмосферного воздуха присутствие водорода менее 0,0001 %.
В атмосфере водород
Слайд 10Водород - самый распространенный химический элемент во Вселенной. Водород составляет более
Водород – прародитель химических элементов. В недрах звезд в результате ядерных реакций водород превращается в гелий, гелий - в литий и т.д.. Именно в звездных ядерных котлах синтезируются ядра атомов всех химических элементов и их изотопов. При чрезмерном ускорении ядерных реакций происходит. Часть массы звезды выбрасывается в межзвездное пространство. Из этой массы формируются планеты.
Слайд 12Водород – химический элемент.
Порядковый номер водорода 1.
Водород расположен в первом периоде,
В одних случаях водород помещают в подгруппу щелочных металлов, в других – в подгруппу галогенов. Некоторые составители периодической таблицы ставят его и в первую, и в седьмую группу.
Слайд 13Аргументы в пользу помещения водорода в подгруппу
щелочных металлов
На внешнем энергетическом уровне
Водород является восстановителем: Н₂ - 2е⁻=2Н⁺ Na – 1e⁻=Na⁺
Образует соединения со степенью окисления +1:
H⁺Cl Na⁺Cl
4. Спектр излучения атомов водорода и щелочных металлов сходен.
галогенов
До завершения внешнего энергетического уровня не хватает одного электрона.
Водород может быть окислителем: Н₂ +2е⁻=2Н⁻ Cl₂ +2e⁻ = 2Cl⁻
Образует степень окисления -1: NaH⁻ NaCl⁻
Простое вещество – двухатомная молекула H₂.
Энергия ионизации атомов водорода и галогенов близка по значениям.
Слайд 15Строение атома водорода
Атом водорода состоит из ядра, представляющего собой один протон,
Слайд 16Изотопы водорода
Водород имеет три изотопа: протий Н, дейтерий D, тритий Т.
В природном водороде содержится 99,985% протия и 0,015% дейтерия.
Протий и дейтерий стабильны, тритий – радиоактивен (период полураспада 12,5 лет).
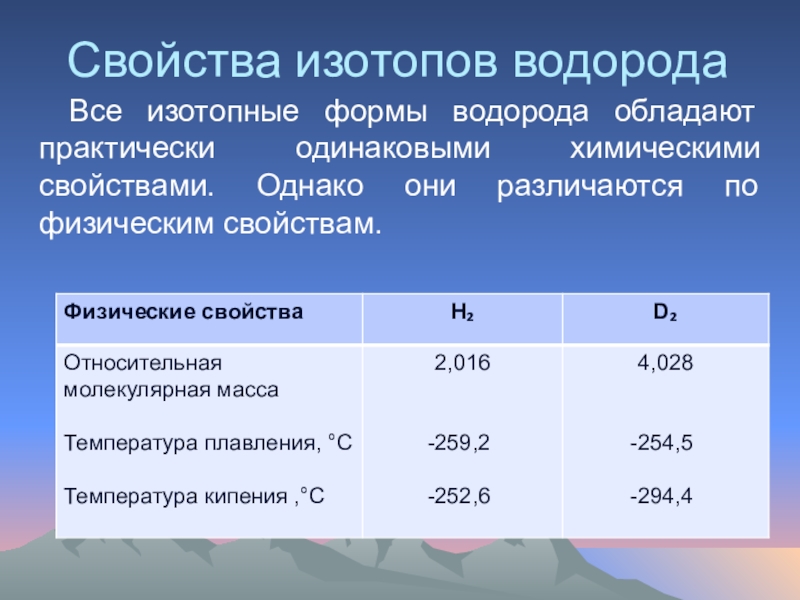
Слайд 17Свойства изотопов водорода
Все изотопные формы водорода обладают практически одинаковыми химическими свойствами.
Слайд 18Открытие водорода
Водород был получен еще в первой половине XVI века немецким
Слайд 19В 1776 г. Х.Кавендиш (Англия) открыл водород. При действии разбавленной серной
Слайд 20Лишь в 1787 году Антуан Лавуазье доказал, что «горючий воздух», открытый
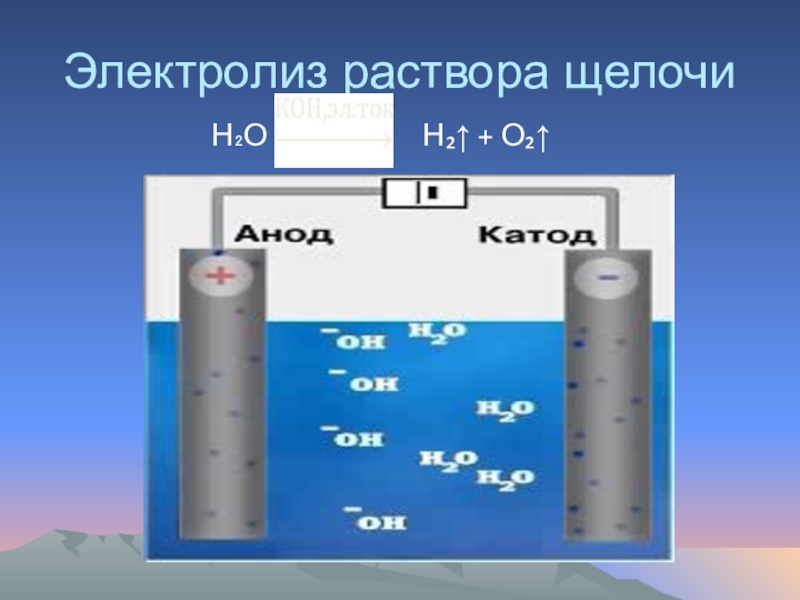
Слайд 21Получение водорода в промышленности
Мировой уровень промышленного получения водорода достигает нескольких миллионов
В промышленности водород получают несколькими способами:
Электролиз водных растворов щелочей;
Взаимодействие угля с парами воды;
Получение из природного газа.
Слайд 23Взаимодействие угля с парами воды
Пропускание паров воды над раскаленным коксом при
Слайд 24Получение из природного газа
Современные методы получения больших количеств
Слайд 26Получение водорода в лаборатории
В лабораторных условиях для получения водорода используют следующие
Электролиз растворов щелочей.
Взаимодействие разбавленных кислот с металлами средней активности.
Взаимодействие амфотерных металлов с растворами щелочей.
Гидролиз гидридов металлов.
Взаимодействие щелочноземельных металлов с водой.
Слайд 27Взаимодействие разбавленных кислот с металлами средней активности
Металлы расположенные в электрохимическом ряду
Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl = ZnCl₂ + H₂↑.
Слайд 29Взаимодействие амфотерных металлов с растворами щелочей
Получение водорода действием щелочей на цинк
2Al + 2NaOH+6H₂O=2Na[Al(OH)₄]+3H₂↑ Zn+2KOH+2H₂O=K₂[Zn(OH)₄]+H₂2Al + 2NaOH+6H₂O=2Na[Al(OH)₄]+3H₂↑ Zn+2KOH+2H₂O=K₂[Zn(OH)₄]+H₂ ↑.
Слайд 34Техника безопасности при работе с водородом
Прежде чем поджигать водород, нужно его
Слайд 36Физические свойства водорода
Лёгкий горючий газ без цвета, запаха и вкуса.
Температура плавления
Температура кипения -252,7
Плохо растворим в воде.
Слайд 37Водород – простое вещество.
Молекула водорода состоит из двух атомов. Возникновение связи
Слайд 38Химические свойства водорода
Водород – восстановитель Н₂ - 2е⁻ = 2Н⁺:
Н₂ +
2H₂ + O₂ 2H₂ + O₂ 2H₂ + O₂ 2H₂O + Q
3H₂ + N₂ 2NH₃
CuO + H₂ = Cu + H₂O
Водород – окислитель Н₂ + 2⁻ = 2Н⁻: 2Li+H₂=2LiH
Ca + H₂ = CaH₂
СaH₂ Ca + H₂
Слайд 41Образование гремучей смеси
Обычно лёгок и летуч,
Он вдруг становится могуч:
Его нагрев
Взорвать в округе всё возможно.
Слайд 44Наполнение аэростатов и дирижаблей
Водород как самый легкий газ, очень удобен для
Слайд 45Применение водорода для создания высоких температур
Кислородно-водородным пламенем режут
Слайд 47Применение водорода в переработке нефти
Приблизительно 12% всего производимого водорода используется на
Слайд 48Применение водорода в пищевой промышленности
Производство маргарина. Водород используется для гидрирования растительных
Слайд 49Получение неорганических продуктов
Приблизительно 50% получаемого водорода используется для синтеза аммиака NH₃.
Водород используется в производстве соляной кислоты HCl.
Он используется для получения металлов (молибдена, вольфрама и др.) из их оксидов.
Слайд 51Получение органических продуктов
Водород используется в процессе синтеза метанола CH3OH. Метанол используется
Слайд 53Применение изотопов водорода
Изотопы водорода – дейтерий и тритий – нашли важное
Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня человек располагает мощнейшим источником энергии, высвобождающейся при реакции:
+ → + + n° + 17,6 Мэв,
которая используется в работе водородной бомбы.
Слайд 54Андрей Дмитриевич Сахаров
21 мая 1921 г. – 14 декабря 1989 г.
Ядерный взрыв
Слайд 55Вопросы:
Дайте общую характеристику элемента водорода. (*)
Какова распространенность и в каком виде
Составьте уравнения реакций, в результате которых можно получить водород. (*)
Как доказать, что водород легче воздуха? (*)
Слайд 56Вопросы:
Как перелить водород из одного сосуда в другой? (*)
Напишите уравнения реакций,
Где применяется водород? (*)
Слайд 57Какое соединение богаче водородом: H₂O или CH₄ ?
Решение:
Мr (H₂O) = 18
Мr
ω ₁(H) = 2/18 = 0,111 (11,1%) в H₂O
ω₂ (H) = 2/16 = 0,25 (25%) в CH₄
25% > 11,1%
Ответ: метан богаче водородом, чем вода.
Слайд 58 Переливание водорода из одного сосуда в другой.
Водородом наполняют небольшой цилиндр
Больший цилиндр ставят на стол, а меньший подносят к огню. Происходит вспышка находящегося в нем водорода. При внесении огня в больший цилиндр вспышки не происходит. Цилиндры необходимо оклеить липкой лентой.