Раменский район Московской области
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома. Изотопы (10 класс)
Содержание
- 1. Презентация по химии на тему Строение атома. Изотопы (10 класс)
- 2. Цель урока:Повторить доказательства сложного строения
- 3. Строение атома Согласно ядерной (планетарной) модели
- 4. Состав атомного ядра
- 5. Двойственная природа электронаСогласно современным представлениям электрон проявляет
- 6. 122
- 7. Характеристика элементарных частиц
- 8. Протонное,нейтронное и массовое числоZ-протонное число,показывает число протонов
- 9. Вычисление числа нейтроновАтомный (порядковый) номер элемента равен
- 10. ИзотопыИзотопы-это атомы одного и того же химического
- 11. Изобары и изотоныИзобары-атомы с различными протонными числами,
- 12. НуклидыНуклид-это атом с определёнными значениями протонного и
- 13. Химический элементХимический элемент- это вид атомов с
- 14. ТЕСТ1. В переводе с греческого «атом» (atomos) означает:А) простейшийБ) главныйВ) неделимыйГ) мельчайший
- 15. ТЕСТ2. Исключите лишнее понятие:А) α-частицыБ) электроныВ) нейтроныГ) протоны
- 16. ТЕСТ3. Соотнесите: Название частицы Заряд Масса
- 17. ТЕСТ4. В ядре атомов отсутствуют частицы:А) протоныБ) нейтроныВ) электроныГ) присутствуют все перечисленные выше частицы
- 18. ТЕСТ5. Учитывая двойственную природу электрона, соотнесите:признак двойственной
- 19. ТЕСТ6. Ядро атома:А) заряжено положительноБ) не имеет зарядаВ) имеет положительный или отрицательный зарядГ) заряжено отрицательно
- 20. ТЕСТ7. Ядро атома 3115Р содержит:А) 15 протонов
- 21. ТЕСТ8. Наука о строении и свойствах микрочастиц,
- 22. Домашнее задание§1, упражнения 1-5.
- 23. Главное квантовое число Состояние орбиталей
- 24. Орбитальное квантовое число Орбитальное квантовое число-ℓ характеризует
- 25. Энергетический подуровень
- 26. Магнитное квантовое число Магнитное квантовое число mℓ
- 27. Спиновое квантовое числоСпиновое квантовое число- ms принимает
- 28. Электронная формула атома
- 29. Электронная формула атома Заполнение электронами уровней и подуровней для атомов элементов малых периодов.
- 30. Составление электронных формул
- 31. Электронная формула атома Заполнение электронами уровней и подуровней для атомов элементов больших периодов.
- 32. Составление электронных формул4 период: 19K 1s22s22p63s2
- 33. Электронно-графическая формула
- 34. Валентные возможности атомов 15Р 1s22s22p63s1 3p3 3d
- 35. Валентные возможности атома серы 16S 1s22s22p63s2 3p43d
- 36. Валентные возможности атома серы16S 1s22s22p63s2 3p3 3d
- 37. Валентные возможности атома серы 16S 1s22s22p63s1 3p3
- 38. Валентные возможности атома кислорода 8О 1s22s22p4-основное состояние
- 39. Строение электронных оболочек атомов элементов ⅠиⅡпериодовЭлектронная оболочка
- 40. Энергетическая схема электронных слоёв
- 41. Максимальное количество электронов на уровне
- 42. Электронная схема атомов I – II периодов.I
- 43. Электронная схема атомов I – II периодов.
- 44. Элементы III – IV периодов.III период
- 45. Элементы III – IV периодов. +⑬
- 46. Элементы III – IV периодов.
- 47. Элементы III – IV периодов. +17○)
- 48. Элементы IV периодa.+19○) ) ) ) 19K
- 49. Классификация химических элементов
- 50. Структура Периодической системы химических элементов Каждому элементу
- 51. Структура Периодической системы химических элементов
- 52. Характеристика элементаМасса Радиус Заряд Общее Число
- 53. Свойства атомовСпособность отдавать
- 54. Закономерности в периодах Li Be
- 55. Закономерности в подгруппахLi (+3) ))
- 56. Домашнее задание §9, упр. 1-4. Знать закономерности.
Цель урока:Повторить доказательства сложного строения атома;Строение атомного ядра и характеристика элементарных частиц(протонов, нейтронов, электронов).Рассмотреть на новом теоретическом уровне понятие «изотопы».
Слайд 1Строение атома. Изотопы
Учитель химии: Шишкова Любовь Викторовна
Ново-Харитоновская СОШ №10 с УИОП
Слайд 2
Цель урока:
Повторить доказательства сложного строения атома;
Строение атомного ядра и
характеристика элементарных частиц(протонов, нейтронов, электронов).
Рассмотреть на новом теоретическом уровне понятие «изотопы».
Рассмотреть на новом теоретическом уровне понятие «изотопы».
Слайд 3Строение атома
Согласно ядерной (планетарной) модели атом состоит из положительно
заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Ядро состоит из нуклонов:
протонов-p (положительные частицы)и
нейтронов-n (частицы,не имеющие заряда).
Протоны и нейтроны удерживаются в ядре ядерными силами,огромными по величине и действующими на малых расстояниях.
Ядро состоит из нуклонов:
протонов-p (положительные частицы)и
нейтронов-n (частицы,не имеющие заряда).
Протоны и нейтроны удерживаются в ядре ядерными силами,огромными по величине и действующими на малых расстояниях.
Слайд 5Двойственная природа электрона
Согласно современным представлениям электрон проявляет двойственную природу,так как является
частицей, но его движение вокруг ядра имеет волновой характер.
Электроны(обозначают ē ) – это частицы с отрицательным зарядом -1 и относительной массой 1/1837 массы протона.
Электроны(обозначают ē ) – это частицы с отрицательным зарядом -1 и относительной массой 1/1837 массы протона.
Слайд 8Протонное,нейтронное и массовое число
Z-протонное число,показывает число протонов в ядре и их
суммарную массу (относительную);
N-нейтронное число, показывает число нейтронов в ядре и их суммарную массу (относительную);
A-массовое(нуклонное)число-это сумма протонов и нейтронов в ядре и их суммарная масса(относительная).
N-нейтронное число, показывает число нейтронов в ядре и их суммарную массу (относительную);
A-массовое(нуклонное)число-это сумма протонов и нейтронов в ядре и их суммарная масса(относительная).
Слайд 9Вычисление числа нейтронов
Атомный (порядковый) номер элемента равен заряду ядра атома, отсюда:
№(Э)=Z (Σ p)= Σ ē;
N=A- Σ p (Z)
Например:
Атомный номер натрия равен 11, отсюда
Z (Σ p)= 11;заряд атома +11; Σ ē=11
N=A(Na)- Z=23-11=12
N=A- Σ p (Z)
Например:
Атомный номер натрия равен 11, отсюда
Z (Σ p)= 11;заряд атома +11; Σ ē=11
N=A(Na)- Z=23-11=12
Слайд 10Изотопы
Изотопы-это атомы одного и того же химического элемента, имеющие одинаковый заряд
ядра(атомный номер), но разные массовые числа.
Например: Массовое число
63Li и 73 Li 105B и 115B
Протонное число
Изотопы водорода: 11H ; 21H(D) ; 31H(T)
протий дейтерий тритий
Название и символы изотопов совпадают с названиями и символами соответствующих элементов.
Например: Массовое число
63Li и 73 Li 105B и 115B
Протонное число
Изотопы водорода: 11H ; 21H(D) ; 31H(T)
протий дейтерий тритий
Название и символы изотопов совпадают с названиями и символами соответствующих элементов.
Слайд 11Изобары и изотоны
Изобары-атомы с различными протонными числами, но с одинаковыми массовыми
числами.
Например:40 18Ar (18p, 22n) и
4019K(19p, 21n).
Изотоны-атомы с одинаковым числом нейтронов.
Например: 136 54 Xe(54p,82n) и
138 56 Ba(56p,82n)
Например:40 18Ar (18p, 22n) и
4019K(19p, 21n).
Изотоны-атомы с одинаковым числом нейтронов.
Например: 136 54 Xe(54p,82n) и
138 56 Ba(56p,82n)
Слайд 12Нуклиды
Нуклид-это атом с определёнными значениями протонного и массового чисел.
Например:
3517 Cl 3517 Cl 3517 Cl
Слайд 13Химический элемент
Химический элемент- это вид атомов с одинаковым протонным числом (зарядом
ядра).
16О; 17О; 18О
Заряд ядра атома кислорода+8
35 Cl 37 Cl
Заряд ядра атома хлора+17
35·0,75+37·0,25=35,5
Относительная атомная масса элемента хлора равна 35,5
16О; 17О; 18О
Заряд ядра атома кислорода+8
35 Cl 37 Cl
Заряд ядра атома хлора+17
35·0,75+37·0,25=35,5
Относительная атомная масса элемента хлора равна 35,5
Слайд 14ТЕСТ
1. В переводе с греческого «атом» (atomos) означает:
А) простейший
Б) главный
В) неделимый
Г)
мельчайший
Слайд 16ТЕСТ
3. Соотнесите:
Название частицы Заряд Масса (а.е.м.)
I) электрон
1) 0 а) 1,0
II) протон 2) –1 б) 5,45*10-3
III) нейтрон 3) +1
II) протон 2) –1 б) 5,45*10-3
III) нейтрон 3) +1
Слайд 17ТЕСТ
4. В ядре атомов отсутствуют частицы:
А) протоны
Б) нейтроны
В) электроны
Г) присутствуют все
перечисленные выше частицы
Слайд 18ТЕСТ
5. Учитывая двойственную природу электрона, соотнесите:
признак двойственной природы:
1) электрон как
волна
2) электрон как частица
характеристика:
А) имеет массу
Б) способен к дифракции
В) способен к интерференции
Г) имеет отрицательный заряд
2) электрон как частица
характеристика:
А) имеет массу
Б) способен к дифракции
В) способен к интерференции
Г) имеет отрицательный заряд
Слайд 19ТЕСТ
6. Ядро атома:
А) заряжено положительно
Б) не имеет заряда
В) имеет положительный или
отрицательный заряд
Г) заряжено отрицательно
Г) заряжено отрицательно
Слайд 20ТЕСТ
7. Ядро атома 3115Р содержит:
А) 15 протонов и 16 нейтронов
Б) 16
протонов и 15 нейтронов
В) 15 протонов и 31 нейтрон
Г) 31 протон и 15 нейтронов
В) 15 протонов и 31 нейтрон
Г) 31 протон и 15 нейтронов
Слайд 21ТЕСТ
8. Наука о строении и свойствах микрочастиц, их превращениях и явлениях,
сопровождающих эти превращения, называется:
А) классической механикой
Б) кинематикой
В) термодинамикой
Г) квантовой механикой
А) классической механикой
Б) кинематикой
В) термодинамикой
Г) квантовой механикой
Слайд 23Главное квантовое число
Состояние орбиталей и электронов в атоме
можно описать набором четырёх квантовых чисел.
Главное квантовое число-n
характеризует энергию электрона данного уровня и определяет размеры орбитали.
n = 1, 2, 3, 4, 5, …, ∞
Главное квантовое число-n
характеризует энергию электрона данного уровня и определяет размеры орбитали.
n = 1, 2, 3, 4, 5, …, ∞
Слайд 24Орбитальное квантовое число
Орбитальное квантовое число-ℓ характеризует энергию электрона данного подуровня
и форму электронного облака.
ℓ = от 0 до(n-1)
Формы s, p, d- орбиталей:
〇 ∞ ✣
s p d
ℓ = от 0 до(n-1)
Формы s, p, d- орбиталей:
〇 ∞ ✣
s p d
Слайд 26Магнитное квантовое число
Магнитное квантовое число mℓ характеризует ориентацию электронного облака
в пространстве и принимает целочисленные значения
от +ℓ через 0 до -ℓ, всего (2ℓ +1)значений
от +ℓ через 0 до -ℓ, всего (2ℓ +1)значений
Слайд 27Спиновое квантовое число
Спиновое квантовое число- ms принимает значения +½ и -½.
Принцип
Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел.
Слайд 28Электронная формула атома
Надо знать:
Порядковый
номер элемента в Периодической системе(он укажет на заряд ядра и число электронов в его атоме)
Номер периода, который укажет на число энергетических уровней.
Номер группы главных подгрупп укажет на число электронов на внешнем уровне(I-II группа–s-элементы, III-VIII-p-элементы), в побочных подгруппах I-VIII групп- d- элементы. Валентные электроны d-элементов находятся на внешнем уровне s -подуровня и на предвнешнем уровне d -подуровня.
Номер периода, который укажет на число энергетических уровней.
Номер группы главных подгрупп укажет на число электронов на внешнем уровне(I-II группа–s-элементы, III-VIII-p-элементы), в побочных подгруппах I-VIII групп- d- элементы. Валентные электроны d-элементов находятся на внешнем уровне s -подуровня и на предвнешнем уровне d -подуровня.
Слайд 29Электронная формула атома
Заполнение электронами уровней и подуровней для атомов элементов
малых периодов.
Слайд 30Составление электронных формул
3 период: 11 Na 1s22s22p63s1
12Mg 1s22s22p63s2
13Al 1s22s22p63s2 3p1
……………………………….
16S 1s22s22p63s2 3p4
18Ar 1s22s22p63s2 3p6
Слайд 31Электронная формула атома
Заполнение электронами уровней и подуровней для атомов элементов
больших периодов.
Слайд 32Составление электронных формул
4 период: 19K 1s22s22p63s2 3p6 4s1
20Ca 1s22s22p63s2 3p6 4s2
21Sc 1s22s22p63s2 3p6 4s23 d1
…………………………………………....
25 Mn 1s22s22p63s2 3p6 4s23 d5
……………………………………………
30Zn 1s22s22p63s2 3p6 4s2 3d10
31Ga 1s22s22p63s2 3p6 4s2 3d10 4 p1
………………………………………………………….
36Kr 1s22s22p63s2 3p6 4s2 3d10 4 p6
21Sc 1s22s22p63s2 3p6 4s23 d1
…………………………………………....
25 Mn 1s22s22p63s2 3p6 4s23 d5
……………………………………………
30Zn 1s22s22p63s2 3p6 4s2 3d10
31Ga 1s22s22p63s2 3p6 4s2 3d10 4 p1
………………………………………………………….
36Kr 1s22s22p63s2 3p6 4s2 3d10 4 p6
Слайд 33Электронно-графическая формула
15Р 1s22s22p63s2 3p3
E d
p
n=3 s
p
n=2 s
n=1 s
Валентность- III
E d
p
n=3 s
p
n=2 s
n=1 s
Валентность- III
Слайд 34Валентные возможности атомов
15Р 1s22s22p63s1 3p3 3d 1
E
d
p
n=3 s
p
n=2 s
n=1 s
Валентность - V
p
n=3 s
p
n=2 s
n=1 s
Валентность - V
Слайд 35Валентные возможности атома серы
16S 1s22s22p63s2 3p43d 0- основное состояние
E
d
p
n=3 s
p
n=2 s
n=1 s
Валентность - II
p
n=3 s
p
n=2 s
n=1 s
Валентность - II
Слайд 36Валентные возможности атома серы
16S 1s22s22p63s2 3p3 3d 1- возбуждённое состояние
E
d
p
n=3 s
p
n=2 s
n=1 s
Валентность - IV
p
n=3 s
p
n=2 s
n=1 s
Валентность - IV
Слайд 37Валентные возможности атома серы
16S 1s22s22p63s1 3p3 3d 2 - возбуждённое
состояние
E d
p
n=3 s
p
n=2 s
n=1 s
Валентность - VI
E d
p
n=3 s
p
n=2 s
n=1 s
Валентность - VI
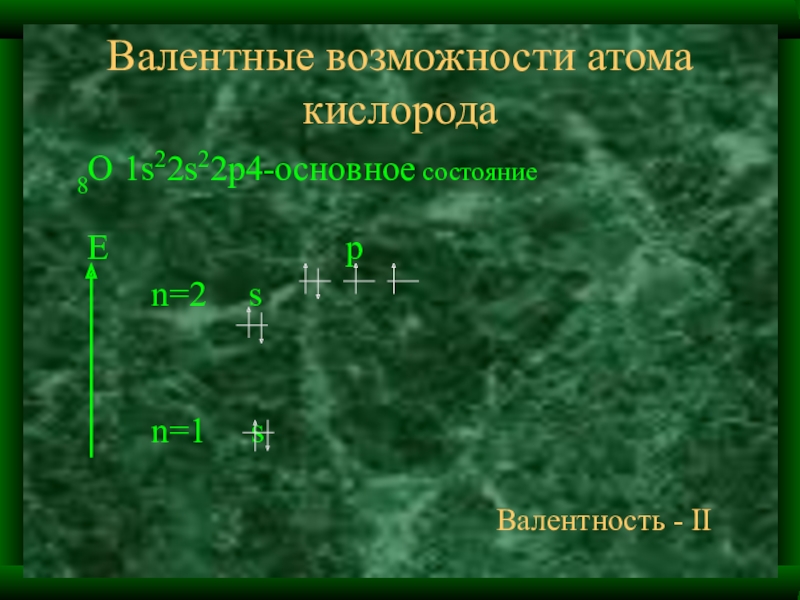
Слайд 38Валентные возможности атома кислорода
8О 1s22s22p4-основное состояние
E
p
n=2 s
n=1 s
Валентность - II
n=2 s
n=1 s
Валентность - II
Слайд 39Строение электронных оболочек атомов элементов ⅠиⅡпериодов
Электронная оболочка атома – это совокупность
всех электронов атома.
Энергетический уровень – это совокупность электронов с близкими значениями энергии(Е).
значение n 1 2 3 4 5 6 7
Энергия электрона и радиус электронного облака возрастают, связь электрона с ядром убывает
Энергетический уровень – это совокупность электронов с близкими значениями энергии(Е).
значение n 1 2 3 4 5 6 7
Энергия электрона и радиус электронного облака возрастают, связь электрона с ядром убывает
Слайд 41Максимальное количество электронов на уровне
n=1 N=2∙12 =2ē
n=2 N=2 ∙22=8ē
n=3 N=2 ∙32=18ē
На внешнем энергетическом уровне может находиться не более 8-ми электронов(на первом-2e).
Уровень с максимально возможным числом электронов называется завершённым.
Слайд 42Электронная схема атомов I – II периодов.
I период
+1○)
1H 1ē
1
+2○) 2He 2ē ; n=1 N=2∙12 =2ē
2 завершён
II период
+3○) ) 3Li 2ē1ē
2 1 незавершён
1
+2○) 2He 2ē ; n=1 N=2∙12 =2ē
2 завершён
II период
+3○) ) 3Li 2ē1ē
2 1 незавершён
Слайд 43Электронная схема атомов I – II периодов.
+⑨ )
) 9F 2ē7ē
2 7 незавершён
+⑩ ) ) 10Ne 2ē8ē
2 8 завершён,т.к.
N=2n2=2⋅22=8ē
2 7 незавершён
+⑩ ) ) 10Ne 2ē8ē
2 8 завершён,т.к.
N=2n2=2⋅22=8ē
Слайд 44Элементы III – IV периодов.
III период
+⑪ ) )
) 11Na 2ē8ē1ē
2 8 1 незавершён
+⑫ ) ) ) 12Mg 2ē8ē2ē
2 8 2 незавершён
2 8 1 незавершён
+⑫ ) ) ) 12Mg 2ē8ē2ē
2 8 2 незавершён
Слайд 45Элементы III – IV периодов.
+⑬ ) ) )
13Al 2ē8ē3ē
2 8 3 незавершён
+⑭) ) ) 14Si 2ē8ē4ē
2 8 4 незавершён
2 8 3 незавершён
+⑭) ) ) 14Si 2ē8ē4ē
2 8 4 незавершён
Слайд 46Элементы III – IV периодов.
+⑮) ) )
15P 2ē8ē5ē
2 8 5 незавершён
+16○) ) ) 16S 2ē8ē6ē
2 8 6 незавершён
2 8 5 незавершён
+16○) ) ) 16S 2ē8ē6ē
2 8 6 незавершён
Слайд 47Элементы III – IV периодов.
+17○) ) )
17Cl 2ē8ē7ē
2 8 7 незавершён
+18○) ) ) 18Ar 2ē8ē8ē
2 8 8 завершён
2 8 7 незавершён
+18○) ) ) 18Ar 2ē8ē8ē
2 8 8 завершён
Слайд 48Элементы IV периодa.
+19○) ) ) ) 19K 2ē8ē8ē1ē
2 8 8 1 незавершён
+20○) ) ) ) 20Ca 2ē8ē8ē2ē
2 8 8 2 незавершён
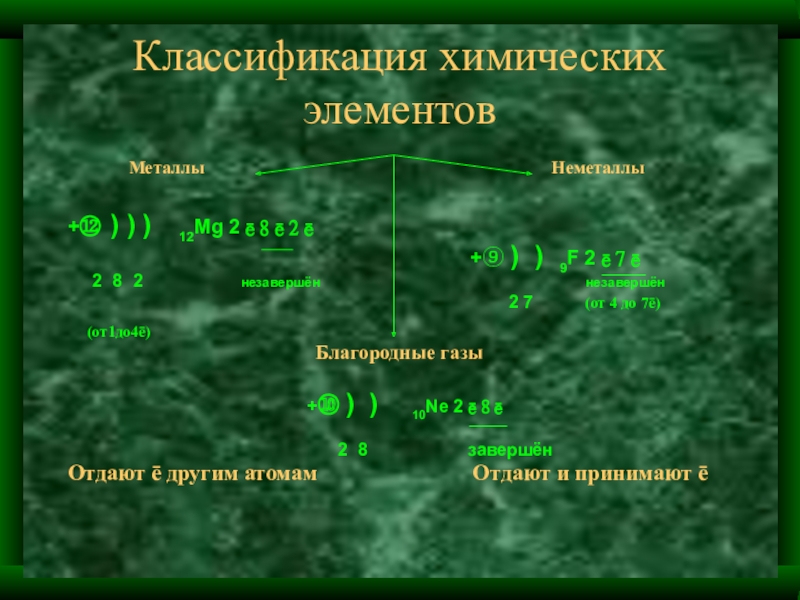
Слайд 49Классификация химических элементов
Металлы Неметаллы
+⑫ ) ) ) 12Mg 2ē8ē2ē
+⑨ ) ) 9F 2ē7ē
2 8 2 незавершён незавершён
2 7 (от 4 до 7ē)
(от1до4ē)
Благородные газы
+⑩ ) ) 10Ne 2ē8ē
2 8 завершён
Отдают ē другим атомам Отдают и принимают ē
+⑫ ) ) ) 12Mg 2ē8ē2ē
+⑨ ) ) 9F 2ē7ē
2 8 2 незавершён незавершён
2 7 (от 4 до 7ē)
(от1до4ē)
Благородные газы
+⑩ ) ) 10Ne 2ē8ē
2 8 завершён
Отдают ē другим атомам Отдают и принимают ē
Слайд 50Структура Периодической системы химических элементов
Каждому элементу присвоен символ и отведена
определённая клетка в системе
8 18 8 2 20
8 Ar 6 О 8 Са
2 39,948 2 15,999 8 40,08
аргон кислород 2 кальций
8 18 8 2 20
8 Ar 6 О 8 Са
2 39,948 2 15,999 8 40,08
аргон кислород 2 кальций
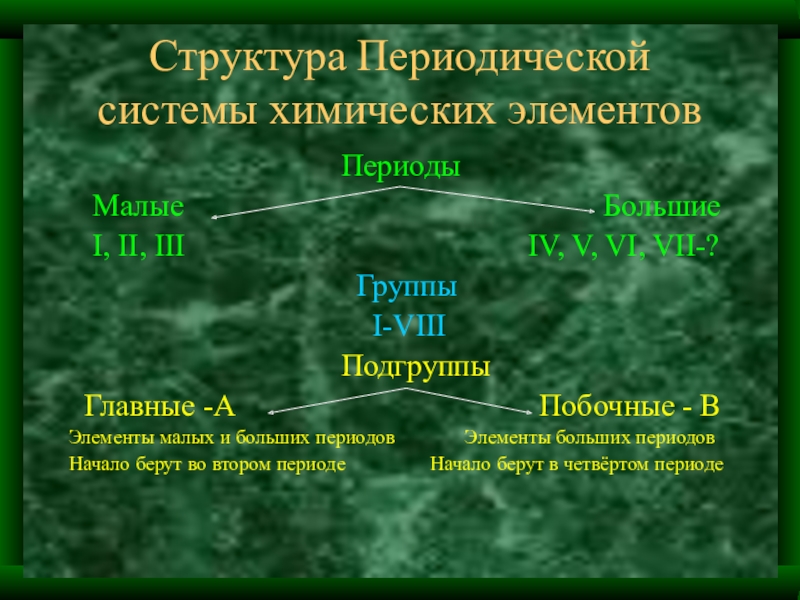
Слайд 51Структура Периодической системы химических элементов
Периоды
Малые Большие
I, II, III IV, V, VI, VII-?
Группы
I-VIII
Подгруппы
Главные -А Побочные - В
Элементы малых и больших периодов Элементы больших периодов
Начало берут во втором периоде Начало берут в четвёртом периоде
Малые Большие
I, II, III IV, V, VI, VII-?
Группы
I-VIII
Подгруппы
Главные -А Побочные - В
Элементы малых и больших периодов Элементы больших периодов
Начало берут во втором периоде Начало берут в четвёртом периоде
Слайд 52Характеристика элемента
Масса Радиус Заряд Общее Число Строение
ядра числоē внешних ē эл. обол.
m (Ar) R q Σē ē +⑨ ) )
2 7
m (Ar) R q Σē ē +⑨ ) )
2 7
Слайд 53Свойства атомов
Способность отдавать Способность
принимать
внешние электроны внешние электроны
↓ ↓
Металлы Неметаллы
Na, Mg, Al S, P, O, N
Атомы, имеющие
завершённый эн. уровень
↓
Инертные
Благородные газы
He, Ne, Ar, Kr, Xe, Rn
внешние электроны внешние электроны
↓ ↓
Металлы Неметаллы
Na, Mg, Al S, P, O, N
Атомы, имеющие
завершённый эн. уровень
↓
Инертные
Благородные газы
He, Ne, Ar, Kr, Xe, Rn
Слайд 54Закономерности в периодах
Li Be B
C N O F Ne
③) ) ⑩))
2 1 28
R (Li) > R (Ne)
1.Увеличивается заряд ядра атомов на 1 – возрастает сила притяжения электронов к ядру, поэтому R атомов уменьшаются(сжимаются), прочность связи с ядром увеличивается, что влияет на способность отдавать ē.
Na Mg Al Si P S Cl Ar
+⑪) ) ) +18○)))
2 8 1 288
③) ) ⑩))
2 1 28
R (Li) > R (Ne)
1.Увеличивается заряд ядра атомов на 1 – возрастает сила притяжения электронов к ядру, поэтому R атомов уменьшаются(сжимаются), прочность связи с ядром увеличивается, что влияет на способность отдавать ē.
Na Mg Al Si P S Cl Ar
+⑪) ) ) +18○)))
2 8 1 288
Слайд 55Закономерности в подгруппах
Li (+3) ))
F )) Ne ))
1 7 8
Na (+11) ))) Cl ))) Ar )))
1 7 8
K (+19) )))) Br )))) Kr ))))
1 7 8
Rb (+37) ))))) I ))))) Xe))))
1 7 8
Cs (+55) )))))) At )))))) Rn ))))))
1 7 8
Fr (+87) )))))))
1 R (Li) < R (Fr)
1 7 8
Na (+11) ))) Cl ))) Ar )))
1 7 8
K (+19) )))) Br )))) Kr ))))
1 7 8
Rb (+37) ))))) I ))))) Xe))))
1 7 8
Cs (+55) )))))) At )))))) Rn ))))))
1 7 8
Fr (+87) )))))))
1 R (Li) < R (Fr)