64 8 класс
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии 8 клас на тему: Основные виды химической связи: ковалентная неполярная, ковалентная полярная..
Содержание
- 1. Презентация по химии 8 клас на тему: Основные виды химической связи: ковалентная неполярная, ковалентная полярная..
- 2. Слайд 2
- 3. Атомы благородных газов имеют завершённый внешний энергетический
- 4. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
- 5. Валентность –
- 6. В образовании химической связи участвуют только валентные
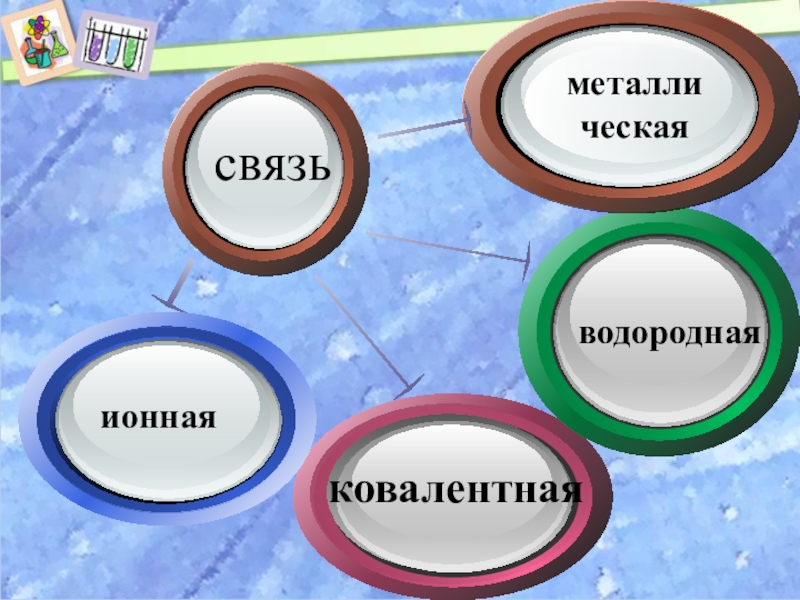
- 7. Click toadd Titlводороднаяметаллическаясвязь
- 8. В образовании
- 9. Слайд 9
- 10. Ковалентная связь – это химическая связь междуатомами, осуществляемая при помощи общих электронных пар.
- 11. Механизм образованияковалентной связиНеспаренные электроныОбщая или поделённаяпара электроновМежду
- 12. Образование ковалентной связив молекуле хлора (Cl2). +17Cl
- 13. структурнаяФормулымолекулэлектроннаяОбщие электронные пары изображаются чёрточкойВалентные электроныизображены точками
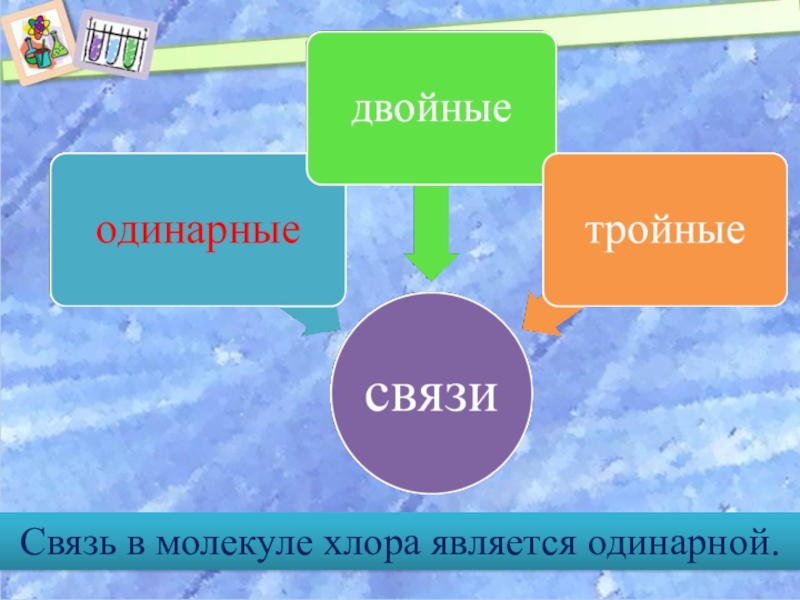
- 14. Связь в молекуле хлора является одинарной.
- 15. Образование молекулыазота (N2).+7N 2е- 5е-В молекуле азота образуется тройная связь, значит атом азота трёхвалентен.
- 16. Образование молекулы хлороводорода (HCl).+1Н 1е-+17Cl
- 17. Выполнение тестовых заданий В-1
1 вариант:1.По данным о распределении валентных электронов назовите элемент:а) 2s1
Слайд 2
1 вариант:
1.По данным о распределении валентных электронов назовите элемент:
а) 2s1 б) 2s22p4
в) 3s23p6 г) 3d104s1
2.Изобразите строение атома азота
2 вариант:
По данным о распределении валентных электронов найдите элемент:
а) 4s24p5 б) 2s22p6
в) 3s23p4 г) 4s24p3
2.Изобразите строение атома серы
1.По данным о распределении валентных электронов назовите элемент:
а) 2s1 б) 2s22p4
в) 3s23p6 г) 3d104s1
2.Изобразите строение атома азота
2 вариант:
По данным о распределении валентных электронов найдите элемент:
а) 4s24p5 б) 2s22p6
в) 3s23p4 г) 4s24p3
2.Изобразите строение атома серы
Слайд 3Атомы благородных газов имеют
завершённый внешний энергетический
уровень. Он наиболее устойчив
и
стабилен, что является причиной
инертности атомов благородных газов.
Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа и перейти в наиболее
устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.
стабилен, что является причиной
инертности атомов благородных газов.
Атомы других элементов пытаются
приобрести конфигурацию ближайшего
благородного газа и перейти в наиболее
устойчивое состояние.
Такое состояние атомы приобретают,
взаимодействуя между собой, в
результате между ними возникает
химическая связь.
Слайд 4Химическая связь – это
силы взаимодействия,
которые соединяют
отдельные атомы в
молекулы, ионы,
кристаллы.
Слайд 5 Валентность –
это способность
атома элемента образовывать
различное число химических
связей с другими атомами.
атома элемента образовывать
различное число химических
связей с другими атомами.
Величина валентности элемента
определяется числом химических связей, которые атом элемента образует с
другими атомами.
Слайд 6В образовании
химической связи
участвуют только
валентные электроны.
У элементов главных подгрупп
это электроны
внешнего энергетического уровня. Они
расположены дальше от ядра и менее прочно
связаны с ним. В зависимости от способа
образования завершённых электронных структур атомов различают несколько видов химической
связи.
внешнего энергетического уровня. Они
расположены дальше от ядра и менее прочно
связаны с ним. В зависимости от способа
образования завершённых электронных структур атомов различают несколько видов химической
связи.
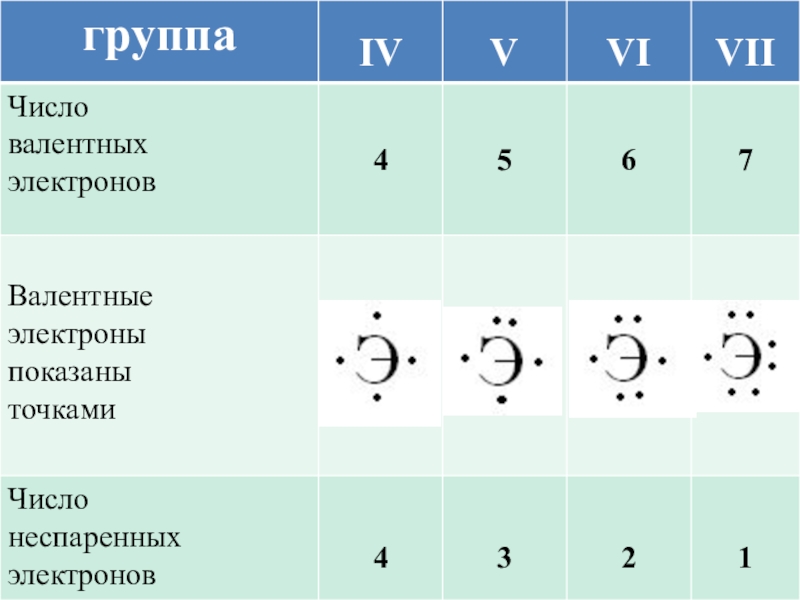
Слайд 8 В образовании ковалентной
связи принимают участие
неспаренные валентные
электроны атома, которые
располагаются на внешнем
уровне по одному.
Число неспаренных электронов =
8 – номер группы элемента
Например, у серы число неспаренных
электронов равно 8 – 6 = 2.
Слайд 10Ковалентная связь – это
химическая связь между
атомами, осуществляемая
при помощи общих
электронных пар.
Слайд 11Механизм образования
ковалентной связи
Неспаренные
электроны
Общая или поделённая
пара электронов
Между ядрами образуется сгущение
отрицательного
заряда, который
притягивает к себе ядра атомов.
притягивает к себе ядра атомов.
Слайд 12Образование ковалентной связи
в молекуле хлора (Cl2).
+17Cl 2е- 8е- 7е-
Для
завершения внешнего слоя каждому атому не
хватает по 1е-.За счёт образования ковалентной
связи каждый атом в молекуле приобретает
завершённый внешний слой.
хватает по 1е-.За счёт образования ковалентной
связи каждый атом в молекуле приобретает
завершённый внешний слой.
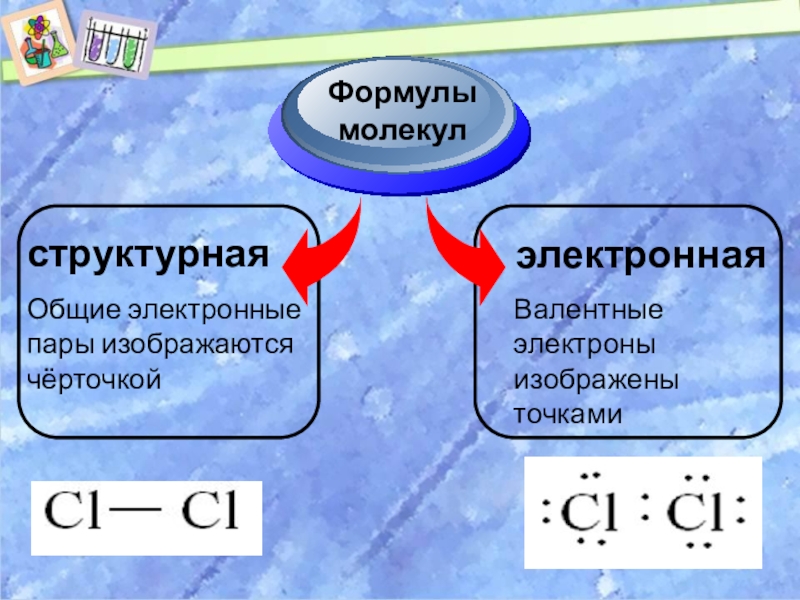
Слайд 13
структурная
Формулы
молекул
электронная
Общие электронные
пары изображаются
чёрточкой
Валентные
электроны
изображены
точками
Слайд 15Образование молекулы
азота (N2).
+7N 2е- 5е-
В молекуле азота образуется тройная связь,
значит атом азота
трёхвалентен.
трёхвалентен.
Слайд 16Образование молекулы
хлороводорода (HCl).
+1Н 1е-
+17Cl 2е- 8е- 7е-
Водород и
хлор в молекуле хлороводорода
одновалентны, так как образуется
одинарная связь.
одновалентны, так как образуется
одинарная связь.
Слайд 17
Выполнение тестовых заданий
В-1
5 баллов
1. В каком ряду находятся вещества только с ковалентной связью – назвать выбранные вещества, указать полярная или неполярная связь:
А) K2O, Na2S, LiCl Б) MgO, H2O, H2S В) H2SO4, CO2, Cl2
2. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) N а) 1
2) S б) 3
3) F в) 2
3. Напишите схему образования химической связи в молекуле Н2S
В-2
1. В каком ряду находятся вещества только с ковалентной связью – назвать выбранные вещества, указать полярная или неполярная связь:
А) F2, Fe , HCl Б) N2, HCl, P2O5 В) NaCl, CaO, K3PO4
2. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) Cl а) 1
2) O б) 4
3) C в) 2
3. Напишите схему образования химической связи в молекуле Н2O
1. В каком ряду находятся вещества только с ковалентной связью – назвать выбранные вещества, указать полярная или неполярная связь:
А) K2O, Na2S, LiCl Б) MgO, H2O, H2S В) H2SO4, CO2, Cl2
2. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) N а) 1
2) S б) 3
3) F в) 2
3. Напишите схему образования химической связи в молекуле Н2S
В-2
1. В каком ряду находятся вещества только с ковалентной связью – назвать выбранные вещества, указать полярная или неполярная связь:
А) F2, Fe , HCl Б) N2, HCl, P2O5 В) NaCl, CaO, K3PO4
2. Найти соответствие между количеством не спаренных электронов и химическим элементом (в основном состоянии):
1) Cl а) 1
2) O б) 4
3) C в) 2
3. Напишите схему образования химической связи в молекуле Н2O