- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад Кремний , строение атома
Содержание
- 1. Презентация Кремний , строение атома
- 2. Кремний – элемент главной подгруппы четвертой группы
- 3. Историческая справкаЧистый элементарный кремний был получен шведским
- 4. Нахождение в природеКремний – второй по распространенности
- 5. Физические свойстваАморфный кремнийКристаллический кремний
- 6. Химические свойстваГорит в кислороде, образуя диоксид кремния:
- 7. Получение кремния Кремний получают, восстанавливая
- 8. Радуга кремнезёма Опал
- 9. Радуга кремнезёмаОксид кремния (IV), или кремнезем
- 10. Применение кремнияSi
- 11. Применение кремнияSiО2
- 12. Использованные источникиО.С.Габриелян. Химия. 9 класс. Базовый уровень.
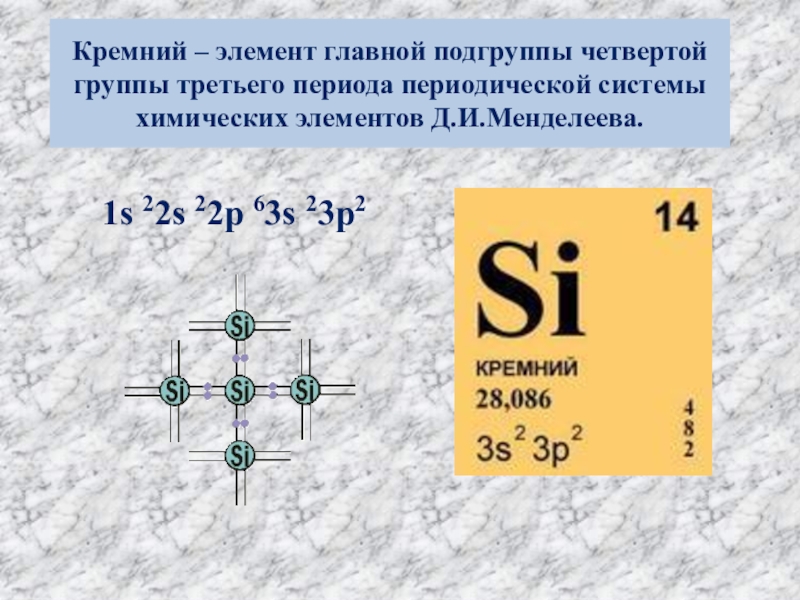
Слайд 2Кремний – элемент главной подгруппы четвертой группы третьего периода периодической системы
1s 22s 22p 63s 23p2
Слайд 3Историческая справка
Чистый элементарный кремний был получен шведским химиком Йенсом Якобом Берцелиусом
Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе с древнегреческого κρημνός — «утес, гора».
Слайд 4Нахождение в природе
Кремний – второй по распространенности после кислорода химический элемент.
Полевой шпат
Кварц
Слюда
K2O*Al2O3*SiO2
Кварц
SiO2
K2O*Al2O3*6SiO2*H2O
Слайд 5Физические свойства
Аморфный кремний
Кристаллический кремний
Мелкий порошок бурого цвета.
Плотность – 2,0 г/см³
Температура плавления – 1400ºС.
Получается путем направленной кристаллизации расплава в тигле, а также методом зонной плавки.
Твердое вещество темно-серого цвета со слабым металлическим блеском.
Полупроводник.
Слайд 6Химические свойства
Горит в кислороде, образуя диоксид кремния:
При нагревании соединяется с
Взаимодействует со щелочами, образуя силикаты и водород:
Силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды:
Силициды разлагаются водой или кислотами, при этом выделяется газообразное водородное соединение кремния – силан:
Si + 2 NaOH + H2O→
→ Na2SiO3 + 2H2↑
SiH4 + 2O2 = SiO2 + 2H2O
Mg2Si + 2H2SO4 → 2MgSO4 + SiH4↑
t
Si + O2 → SiO2
t
Si + 2Mg → Mg2Si
Слайд 7Получение кремния
Кремний получают, восстанавливая его из оксида кремния
t
SiO2 + 2Mg = 2MgO + Si,
t
SiO2 + 2C = Si + 2CO↑.
Слайд 9Радуга кремнезёма
Оксид кремния (IV), или кремнезем SiO2 , как и
Физические свойства:
Твердое и тугоплавкое вещество. Не растворяется в воде и кислотах (кроме плавиковой). Взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты – силикатов.
Химические свойства:
t
SiO2 + 2NaOH = Na2SiO3 + H2O
t
SiO2 + CaO = CaSiO3
t
SiO2 + CaCO3 = CaSiO3 + CO2↑
Слайд 12Использованные источники
О.С.Габриелян. Химия. 9 класс. Базовый уровень. М. Дрофа. 2013.
Поурочные планы по учебнику «Химия. 9 класс» О.С.Габриеляна. Составитель С.В.Бочарова. Волгоград. 2007.
Портрет Й.Я.Берцелиуса
http://allchem.ru/images/biography/Berzelius.jpg
5. Портрет Г.И.Гесса
http://www.top4man.ru/upload/mineral-water-2.jpg