- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад по химии на тему Строение атома (11 класс)
Содержание
- 1. Презентация по химии на тему Строение атома (11 класс)
- 2. Тема?
- 3. Строение атома.Цель урока…..
- 4. Задачи урока:1.Вспомнить строение атома.2. Изучить доказательства сложности строения атома.3. Изучить модели строения атома, предложенные учёными.4.Электронные формулы.
- 5. Что нам известно?
- 6. Что нужно узнать?
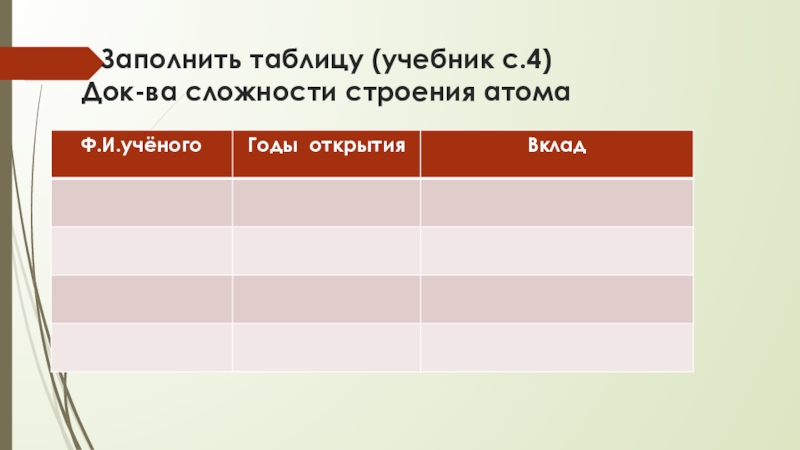
- 7. Заполнить таблицу (учебник с.4) Док-ва сложности строения атома
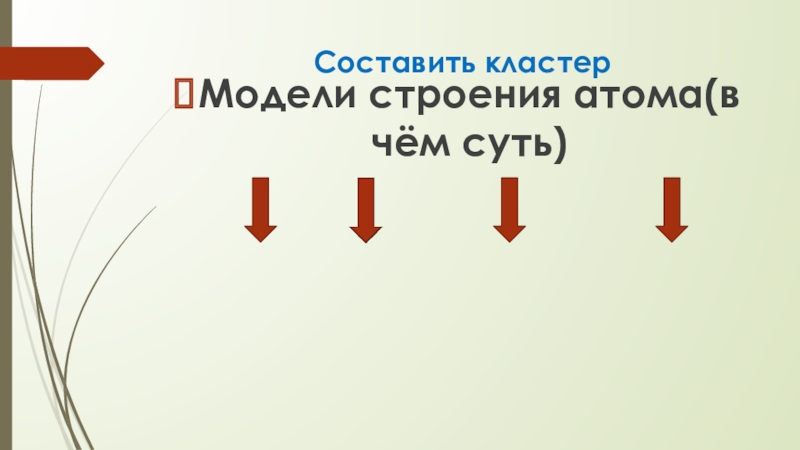
- 8. Составить кластерМодели строения атома(в чём суть)
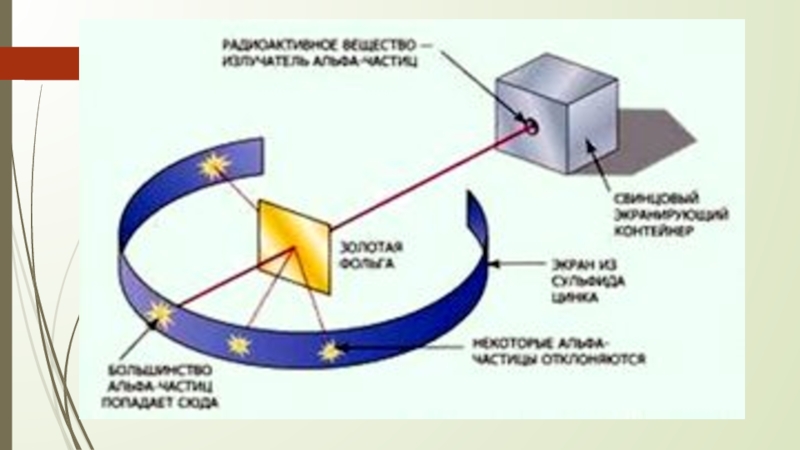
- 9. Какая модель изображена на рисунке?
- 10. Модель Томсона – «пудинговая модель»1904 год
- 11. Слайд 11
- 12. Модель Резерфорда– «Планетарная модель
- 13. Недостатки:
- 14. ………………… модель1913 год
- 15. Слайд 15
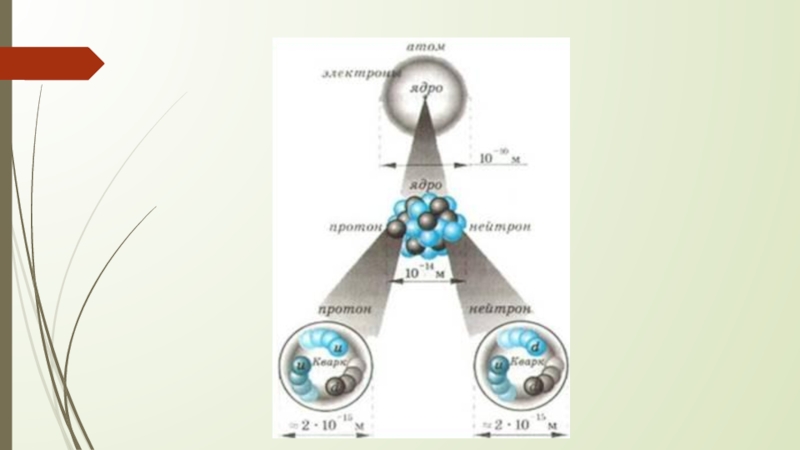
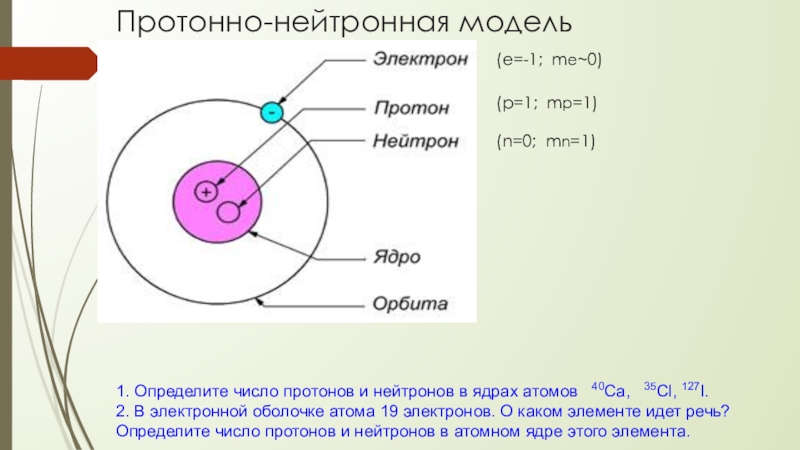
- 16. Протонно-нейтронная модель В 1932 году Иваненко
- 17. Протонно-нейтронная модель1. Определите число протонов и нейтронов
- 18. Слайд 18
- 19. Слайд 19
- 20. Слайд 20
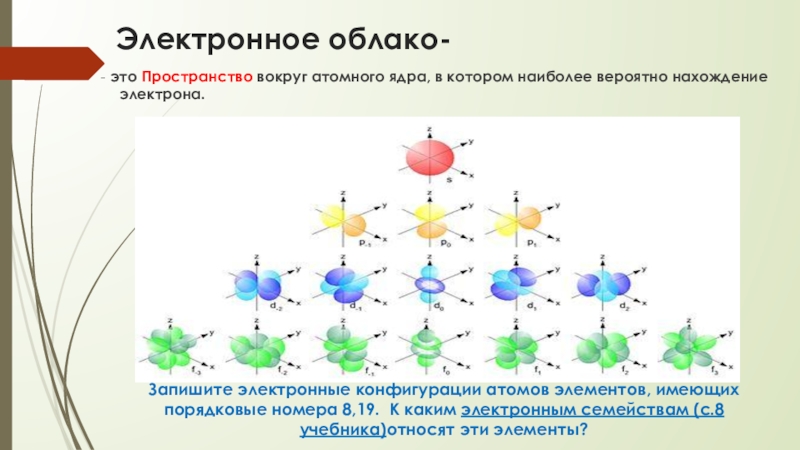
- 21. Электронное облако- - это Пространство вокруг атомного
- 22. Подведение итоговСегодня я узнал…Было интересно…Было трудно…Я научился…У меня получилось…Меня удивило…
- 23. Урок окончен!!
Тема?
Слайд 4Задачи урока:
1.Вспомнить строение атома.
2. Изучить доказательства сложности строения атома.
3. Изучить модели
строения атома, предложенные учёными.
4.Электронные формулы.
4.Электронные формулы.
Слайд 13 Недостатки:
1)Резерфорд не смог объяснить
устойчивости атома.
2)Не объясняла поглощение и излучение энергии.
2)Не объясняла поглощение и излучение энергии.
Слайд 14………………… модель
1913 год
Основные положения он сформулировал
в виде постулатов:
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
I. Электрон может вращаться вокруг ядра по определенным, стационарным круговым орбиталям.
II. Двигаясь по стационарной орбите, электрон не излучает энергию.
III. Излучение электромагнитной энергии (либо ее поглощение) происходит при переходе электрона с одной стационарной орбиты на другую.
Нильс Хе́нрик
Дави́д Бор
(1885-1962)
Слайд 16 Протонно-нейтронная модель
В 1932 году Иваненко предложил протонно-нейтронную модель ядра.
Эту теорию развил Гейзенберг. Эта модель строения атома существует до сих пор, сочетает в себе все предыдущие модели и «исправляет» их недостатки.
Слайд 17Протонно-нейтронная модель
1. Определите число протонов и нейтронов в ядрах атомов
40Ca, 35Cl, 127I.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.
2. В электронной оболочке атома 19 электронов. О каком элементе идет речь? Определите число протонов и нейтронов в атомном ядре этого элемента.
Слайд 21Электронное облако-
- это Пространство вокруг атомного ядра, в котором
наиболее вероятно нахождение электрона.
Запишите электронные конфигурации атомов элементов, имеющих порядковые номера 8,19. К каким электронным семействам (с.8 учебника)относят эти элементы?