- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку Качественные характеристики ЭДС (степень диссоциации и кислотность растворов
Содержание
- 1. Презентация к уроку Качественные характеристики ЭДС (степень диссоциации и кислотность растворов
- 2. Слайд 2
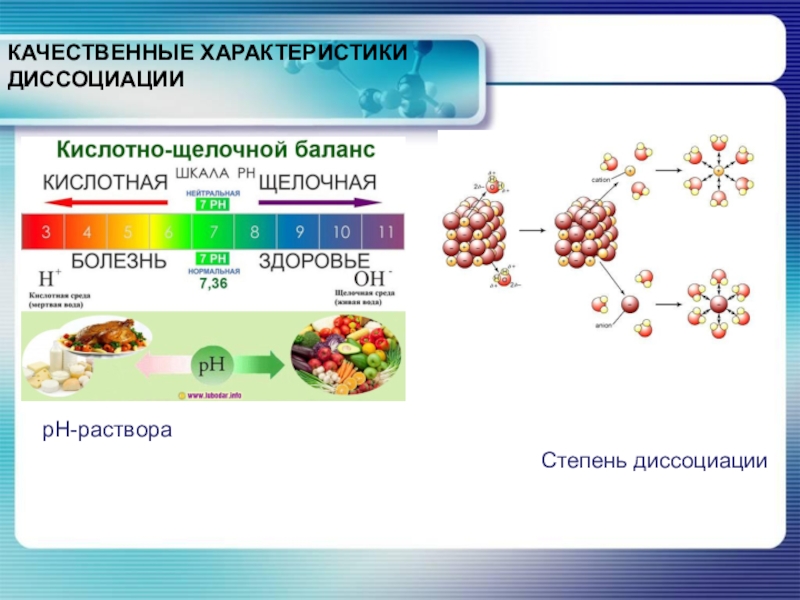
- 3. КАЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДИССОЦИАЦИИрН-раствора
- 4. Степень диссоциации Степень электролитической диссоциации равна отношению
- 5. Сильные электролиты — это такие электролиты, для
- 6. Слабые электролиты — это такие электролиты, для
- 7. К слабым электролитам относятся:1. Слабые кислоты -
- 8. Кислотно-щелочной балансИндикаторы – органические соединения, способные изменять цвет в растворе при изменении кислотности.
- 9. Универсальный индикатор Сильно кислаяСлабо кислаяСлабо щелочнаяСильно щелочнаяНейтральнаяУсиление кислотности средыУсиление основности среды
- 10. Слайд 10
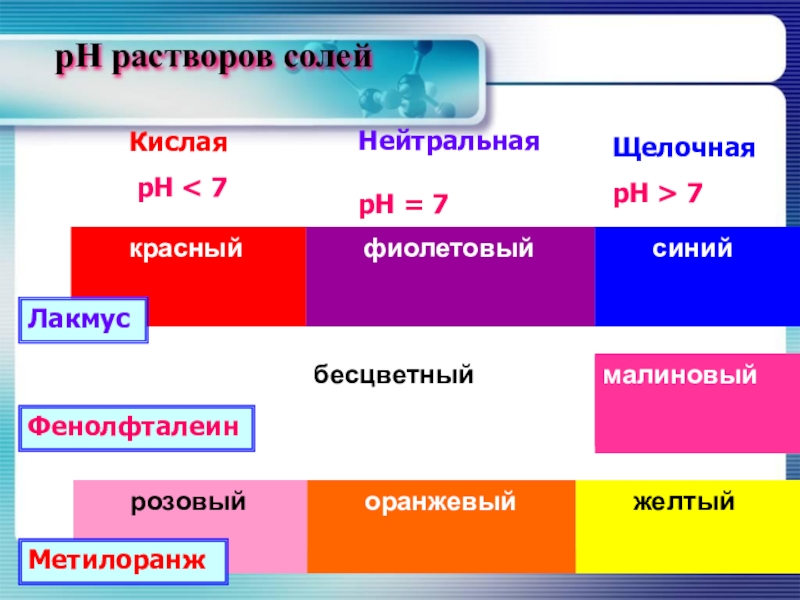
- 11. pH растворов солей ЛакмусФенолфталеинМетилоранжКислая рН < 7НейтральнаярН = 7ЩелочнаярН > 7
- 12. Лабораторный опытИсследование среды водных растворов некоторых веществ.Используя выданные индикаторы исследовать имеющиеся растворы.Данные внести в таблицу.
- 13. Соль сильного основания и сильной кислоты
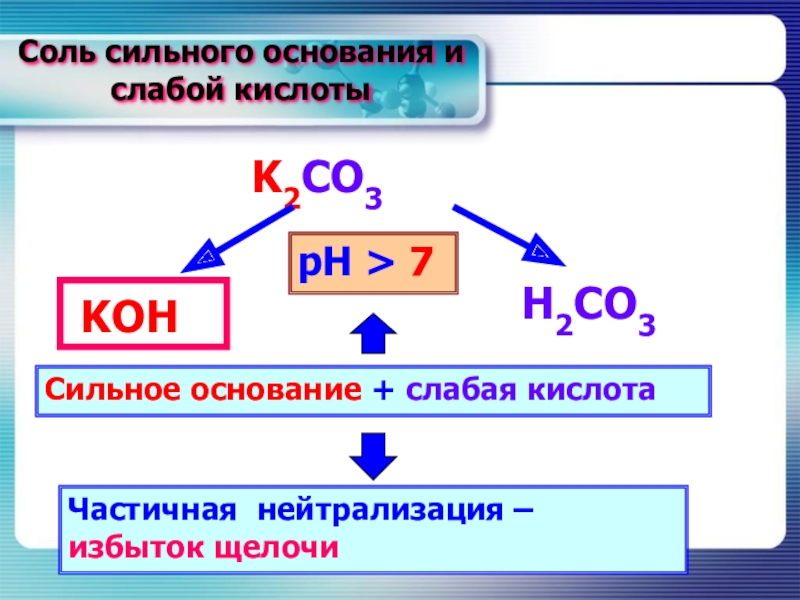
- 14. Соль сильного основания и слабой кислотыK2CO3Н2CO3KОНСильное основание + слабая кислотаЧастичная нейтрализация – избыток щелочирН > 7
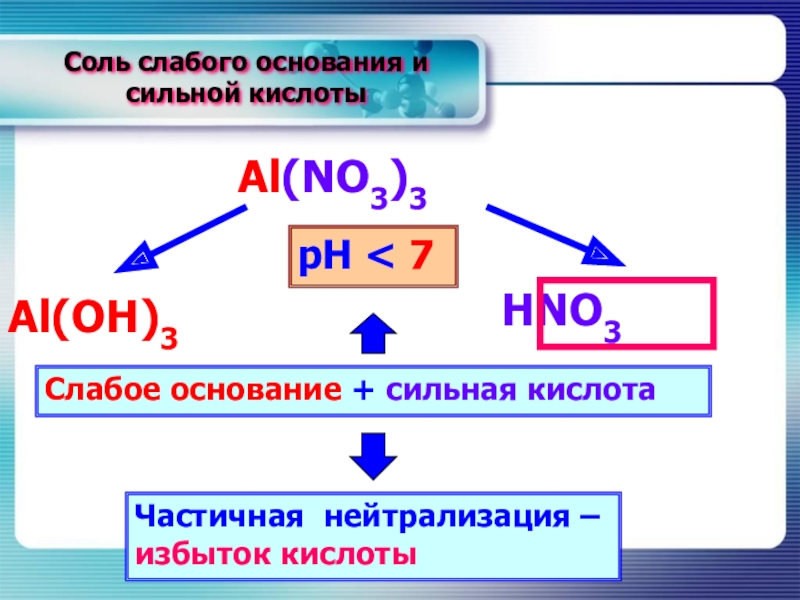
- 15. Соль слабого основания и сильной кислотыAl(NO3)3НNO3Al(OН)3Слабое основание + сильная кислотаЧастичная нейтрализация – избыток кислотырН < 7
- 16. Домашнее заданиеПараграф 11,12
КАЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ ДИССОЦИАЦИИрН-раствора
Слайд 4Степень диссоциации
Степень электролитической диссоциации равна отношению числа молекул, которые распались
на ионы, к общему числу растворенных молекул электролита:
где n - число молекул, распавшихся на ионы;
N - общее число растворенных молекул.
где n - число молекул, распавшихся на ионы;
N - общее число растворенных молекул.
Слайд 5Сильные электролиты — это такие электролиты, для которых степень диссоциации в
водных растворах равна 1 (100%).
К сильным электролитам относятся:
1. Практически все соли;
2. Кислоты - НС1О4, НС1О3, HNO3, H2SO4, HMnO4, H2Cr2О7, HI, HBr, НС1, H2CrО4;
3. Щелочи- LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2 ,Sr(OH)2, Ba(OH)2.
К сильным электролитам относятся:
1. Практически все соли;
2. Кислоты - НС1О4, НС1О3, HNO3, H2SO4, HMnO4, H2Cr2О7, HI, HBr, НС1, H2CrО4;
3. Щелочи- LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2 ,Sr(OH)2, Ba(OH)2.
Сильные электролиты
Слайд 6Слабые электролиты — это такие электролиты, для которых степень диссоциации в
водных растворах меньше
1 (100%).
1 (100%).
Слабые электролиты
Слайд 7К слабым электролитам относятся:
1. Слабые кислоты - НС1О2, НС1О, HNO2, H2CO3,
H2SiО3, H3PO4, HF, H3BO3; CH3COOH, H3S, HCN
2. Слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 Fe(OH)3 Cu(OH)2 Pb(OH)2, A1(OH)3, Cr(OH)3;
3. Вода Н2О.
4. NH4 OH.
2. Слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 Fe(OH)3 Cu(OH)2 Pb(OH)2, A1(OH)3, Cr(OH)3;
3. Вода Н2О.
4. NH4 OH.
Слабые электролиты
Слайд 8Кислотно-щелочной баланс
Индикаторы – органические соединения, способные изменять цвет в растворе при
изменении кислотности.
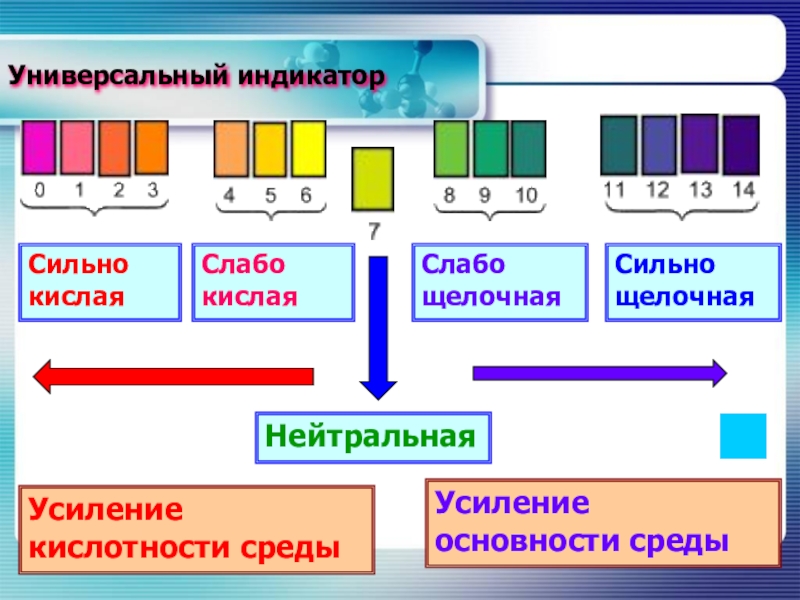
Слайд 9Универсальный индикатор
Сильно кислая
Слабо кислая
Слабо щелочная
Сильно щелочная
Нейтральная
Усиление кислотности среды
Усиление основности среды
Слайд 12Лабораторный опыт
Исследование среды водных растворов некоторых веществ.
Используя выданные индикаторы исследовать имеющиеся
растворы.
Данные внести в таблицу.
Данные внести в таблицу.
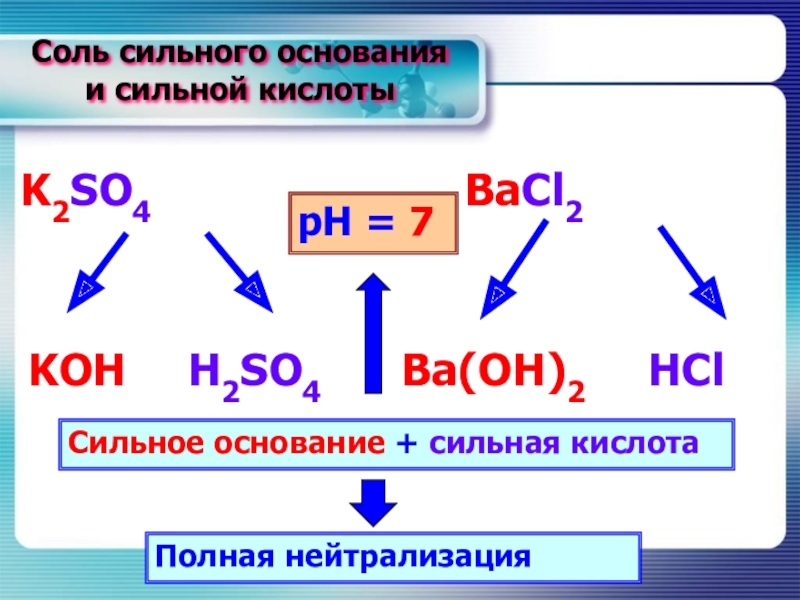
Слайд 13Соль сильного основания
и сильной кислоты
K2SO4
BaCl2
KOH
H2SO4
HCl
Ba(OH)2
Сильное основание + сильная кислота
Полная нейтрализация
рН = 7
Слайд 14Соль сильного основания и слабой кислоты
K2CO3
Н2CO3
KОН
Сильное основание + слабая кислота
Частичная нейтрализация
– избыток щелочи
рН > 7
Слайд 15Соль слабого основания и сильной кислоты
Al(NO3)3
НNO3
Al(OН)3
Слабое основание + сильная кислота
Частичная нейтрализация
– избыток кислоты
рН < 7