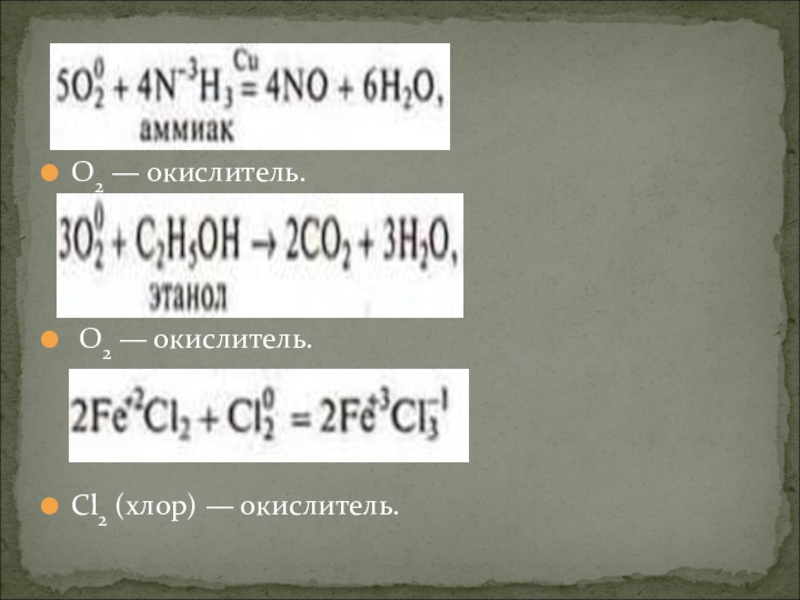- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии по теме Общая характеристика неметаллов
Содержание
- 1. Презентация к уроку химии по теме Общая характеристика неметаллов
- 2. Нет сил удерживать снующие частицы, Что далеки
- 3. Вопрос. Что мы знаем о металлах? Какие
- 4. Нам вечно не хватает электронов, Мы в
- 5. Тема урока Общая характеристика неметаллов.
- 6. систематизировать знания об особенностях неметаллов на
- 7. Неметаллы - химические элементы с типично неметаллическими свойствамиНеметаллы
- 8. Неметаллы занимают правый верхний угол Периодической Системы Химических
- 9. Неметаллы занимают правый верхний угол Периодической Системы Химических
- 10. Слайд 10
- 11. Особенности атомного строения неметаллов. Рассмотрим неметаллы
- 12. В периодах с увеличением заряда ядра атома
- 13. Способность принимать электроны — это проявление окислительных
- 14. Небольшой атомный радиусНа внешнем уровне 4-8 электроновРасполагаются
- 15. Электроотрицательность (ЭО) - это свойство атомов химических
- 16. Максимальное значение электроотрицательности имеет F, оно равно 4.
- 17. Ответьте на
- 18. Сравнивая значения ЭО неметаллов, делаем вывод, что
- 19. Видеоролик «Огненное трио»
- 20. Какой самый сильный окислитель?На основе каких фактов вы это можете подтвердить?Почему его боятся и сейчас?
- 21. У неметаллов преобладают окислительные свойства.В соответствии с
- 22. Химические свойства неметаллов следует рассматривать как окислительно-восстановительные,
- 23. Неметаллы проявляют также восстановительные свойства.Восстановительные свойства постепенно
- 24. Химические свойства неметаллов.
- 25. Слайд 25
- 26. O2 — окислитель. O2 — окислитель. Сl2 (хлор) — окислитель.
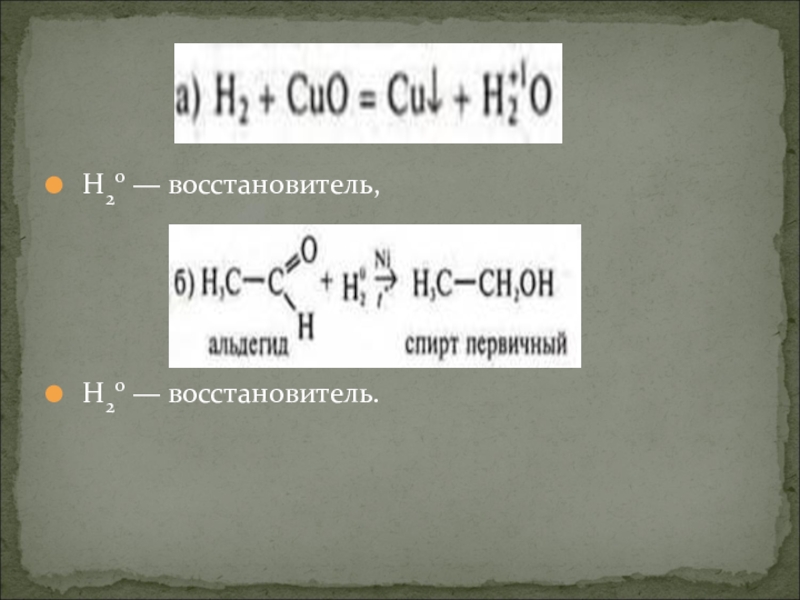
- 27. Видеоролик опыта, характеризующего восстановительные свойства неметаллов:«Восстановление оксида меди (II) водородом»
- 28. Н20 — восстановитель, Н20 — восстановитель.
- 29. Химические свойства неметаллов.
- 30. Атомы-неметаллы образуют молекулы простых веществ, как правило,
- 31. Типы кристаллических решеток
- 32. Физические свойства неметаллов. Агрегатное состояние
- 33. Гораздо богаче у неметаллов чем у металлов
- 34. твёрдые — йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, боржидком состоянии существует бром.
- 35. Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ.Аллотропия
- 36. Различный состав молекул простого вещества (аллотропия состава).Способ
- 37. Кислород (O2)Аллотропия составаОзон (O3)
- 38. Демонстрация видеоролика «Аллотропия кислорода».
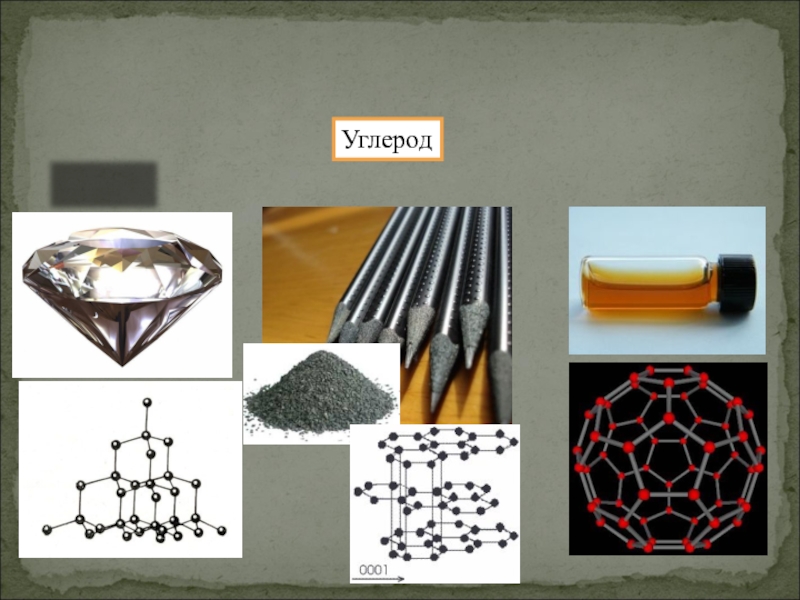
- 39. УглеродАлмаз Графит ФуллеренАллотропия формы
- 40. Фосфор Белый фосфор ядовит, светится в темноте,
- 41. Демонстрация видеоролика «Аллотропия фосфора. Получение белого фосфора».
- 42. 1) Элементы-неметаллы расположены в главных подгруппах …..
- 43. 1) Элементы-неметаллы расположены в главных подгруппах IV,
- 44. 1) Вставьте слова, пропущенные в тексте. Атомы
- 45. 5) Водород занимает в периодической таблице два
- 46. 1) Вставьте слова, пропущенные в тексте. Атомы
- 47. 5) Водород занимает в периодической таблице два
- 48. 1. Узнал много нового. 2. Мне это
- 49. Спасибо за внимание
Слайд 2Нет сил удерживать снующие частицы, Что далеки от нашего ядра. Пора бы неметаллам
Загадка
Слайд 3Вопрос. Что мы знаем о металлах? Какие физические свойства имеют металлы?
Слайд 4Нам вечно не хватает электронов, Мы в поисках с зари и до
Загадка
Слайд 6 систематизировать знания об особенностях неметаллов на атомарном уровне и макроуровне;
Цель урока -
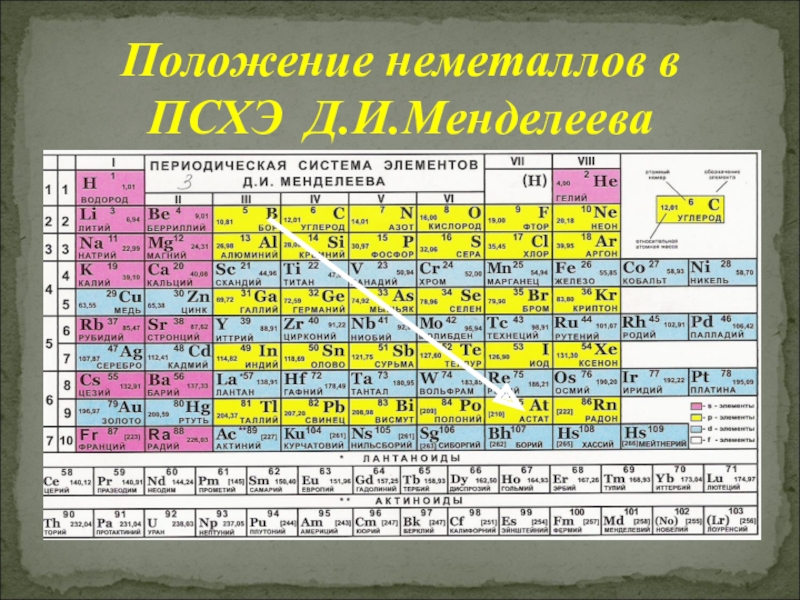
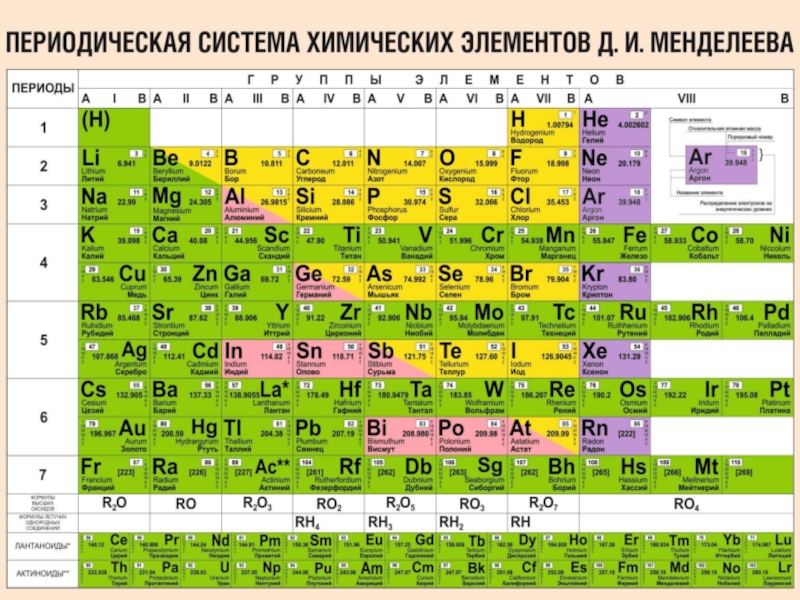
Слайд 8Неметаллы занимают правый верхний угол Периодической Системы Химических Элементов (ПСХЭ). Также к
Положение неметаллов в ПСХЭ Д.И.Менделеева
Слайд 9Неметаллы занимают правый верхний угол Периодической Системы Химических Элементов (ПСХЭ), в главных
Также к неметаллам относят водород (Н) и гелий (Не)
Положение неметаллов в ПСХЭ Д.И.Менделеева
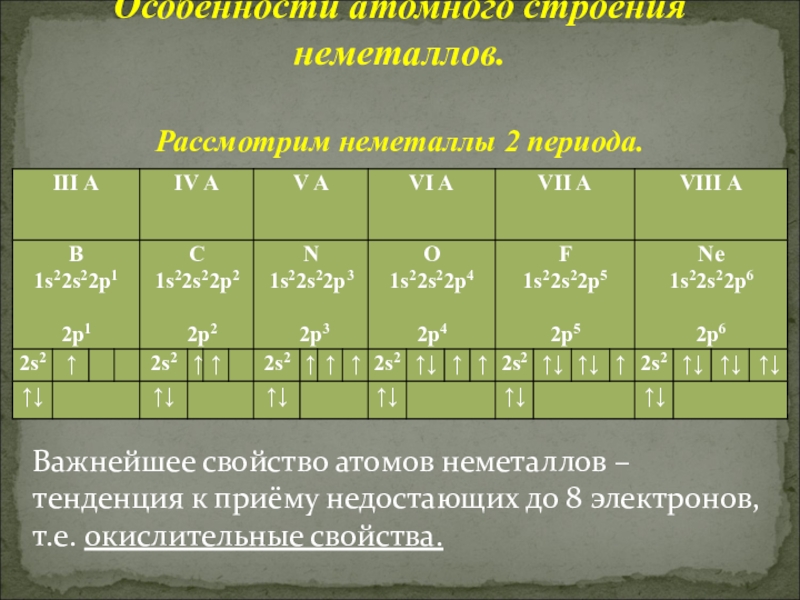
Слайд 11Особенности атомного строения неметаллов.
Рассмотрим неметаллы 2 периода.
Важнейшее свойство атомов неметаллов –
Слайд 12В периодах с увеличением заряда ядра атома элемента увеличивается количество электронов
В группах, главных подгруппах с увеличением заряда ядра атома увеличивается количество энергетических уровней, т. е. возрастает атомный радиус атома, а количество электронов на внешнем энергетическом уровне остается неизменным. К концу группы главной подгруппы неметалличность уменьшается.
Изменение окислительных свойств неметаллов в периодах и группах
Слайд 13Способность принимать электроны — это проявление окислительных свойств атомов элементов. Таким
Слайд 14Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно
Особенности атомного строения неметаллов.
Слайд 15Электроотрицательность (ЭО) - это свойство атомов химических элементов поляризовать химическую связь,
Электроотрицательность – мера неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Вопрос.
Что такое электроотрицательность?
Слайд 16Максимальное значение электроотрицательности имеет F, оно равно 4. Это самый неметаллический элемент,
У остальных неметаллов значение ЭО изменяется от 2 до 4 и в соответствии с этими значениями они располагаются в ряду ЭО (учебник, с. 119).
Электроотрицательность
Si B H2 P C S I2 N2 Cl2 O2 F2
Слайд 17
Ответьте на вопросы:
1). Какой неметалл имеет самую маленькую электроотрицательность?
- Si (кремний).
2).Какой
- F (фтор).
3). Как изменяются окислительные свойства неметаллов?
- Увеличиваются от кремния до фтора.
Si B H2 P C S I2 N2 Cl2 O2 F2
Слайд 18Сравнивая значения ЭО неметаллов, делаем вывод, что один и тот же
Si B H2 P C S I2 N2 Cl2 O2 F2
Пример: S — сера, проявляет окислительные свойства по отношению к левее расположенным элементам; в ряду ЭО S проявляет восстановительные свойства по отношению к элементам, правее расположенным в ряду ЭО.
Вывод:
Слайд 20Какой самый сильный окислитель?
На основе каких фактов вы это можете подтвердить?
Почему
Слайд 21У неметаллов преобладают окислительные свойства.
В соответствии с численными значениями относительной ЭО
Вывод:
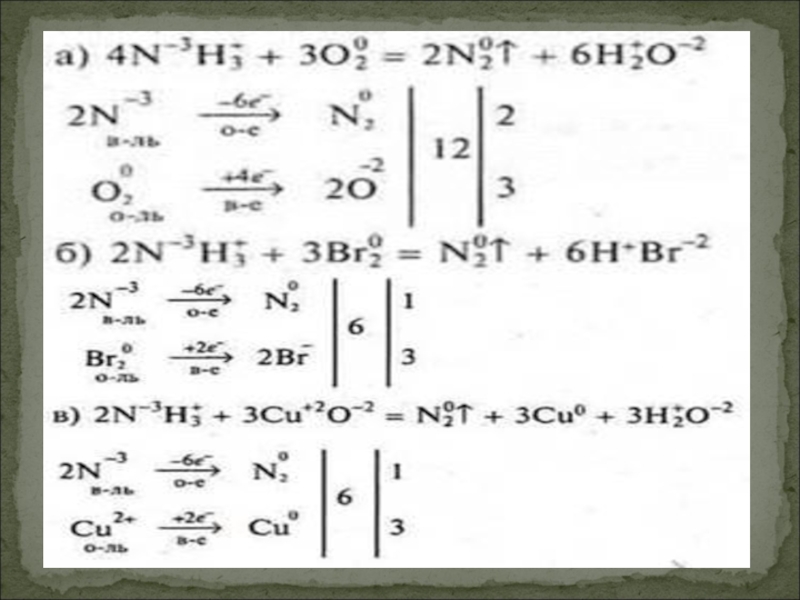
Слайд 22Химические свойства неметаллов следует рассматривать как окислительно-восстановительные, согласно их ЭО. Однако
Пример:
Химические свойства неметаллов.
Слайд 23Неметаллы проявляют также восстановительные свойства.
Восстановительные свойства постепенно возрастают от кислорода к
O2 Cl2 N2 I2 S C P H2 B Si
Вывод:
Слайд 27Видеоролик опыта, характеризующего
восстановительные свойства неметаллов:
«Восстановление оксида меди (II) водородом»
Слайд 30Атомы-неметаллы образуют молекулы простых веществ, как правило, двухатомные. Химическая связь —
Кристаллическое строение неметаллов - простых веществ.
Слайд 33Гораздо богаче у неметаллов чем у металлов и спектр цветов. Например,
Физические свойства неметаллов.
Слайд 34твёрдые — йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний,
жидком состоянии существует бром.
Слайд 35Аллотропия – это способность атомов одного химического элемента образовывать несколько простых
Аллотропия
Слайд 36Различный состав молекул простого вещества (аллотропия состава).
Способ размещения атомов или молекул
Причины аллотропии
Слайд 40Фосфор
Белый фосфор ядовит, светится в темноте, способен самовоспламеняться
Красный фосфор.
Ядовитость его
Чёрный фосфор
проводит электрический ток и имеет свойства полупроводника.
Металлический фосфор
очень хорошо проводит электрический ток.
Слайд 42 1) Элементы-неметаллы расположены в главных подгруппах ….. ….. ПС Д.И. Менделеева,
2) На внешнем электронном слое атомов элементов-неметаллов находятся от … до… электронов.
3) Неметаллические свойства элементов ………….. в периодах и ………….. в подгруппах с увеличением порядкового номера элемента.
4) Атомы элементов-неметаллов способны как ………… электроны, проявляя окислительные функции, так и ………….. их, проявляя восстановительные функции.
Выводы:
Слайд 43 1) Элементы-неметаллы расположены в главных подгруппах IV, V, VI, VII, VIII
2) На внешнем электронном слое атомов элементов-неметаллов находятся от 4 до 8 электронов.
3) Неметаллические свойства элементов усиливаются в периодах и уменьшаются в подгруппах с увеличением порядкового номера элемента.
4) Атомы элементов-неметаллов способны как присоединять электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
Выводы:
Слайд 44 1) Вставьте слова, пропущенные в тексте.
Атомы ……… в отличие от
2) Вставьте слова, пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах …..
В группах неметаллические свойства элементов ………
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента?
Тест
Слайд 455) Водород занимает в периодической таблице два места: в I А
6) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно…..
а) 4 б) 5 в) 6 г)7
7) Наиболее электроотрицательными являются атомы…..
серы, 2. фосфора, 3.кремния, 4.хлора
8) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
1)2, 1 2)2, 8, 2 3)2, 8, 7
Слайд 46 1) Вставьте слова, пропущенные в тексте.
Атомы неметаллов в отличие от
2) Вставьте слова, пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах усиливаются
В группах неметаллические свойства элементов уменьшаются.
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер? (SiO2, P2O5, Cl2O7, ArO4)
4) Запишите формулы водородных соединений элементов VII А группы. Как изменяются кислотные свойства с увеличением порядкового номера элемента? (HF, HCl, HBr, HI, HAt)
Проверка теста.
Слайд 475) Водород занимает в периодической таблице два места: в I А
6) Наиболее ярко выраженные неметаллические свойства проявляет вещество, образованное из атомов, в которых число электронов во внешнем электронном слое равно…..
а) 4 б) 5 в) 6 г)7
7) Наиболее электроотрицательными являются атомы…..
1.серы, 2. фосфора, 3.кремния, 4.хлора
8) Типичному неметаллу соответствует следующая схема распределения электронов по электронным слоям:
1)2, 1 2)2, 8, 2 3)2, 8, 7
Слайд 481. Узнал много нового.
2. Мне это пригодится в жизни.
3.
4. На возникшие вопросы я получил ответ.
5. Поработал добросовестно, цель достигнута.
В заключении - тест