категории
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад к уроку химии по теме Электролиз
Содержание
- 1. Презентация к уроку химии по теме Электролиз
- 2. Электролиз – это окислительно-восстановительный процесс, который протекает
- 3. ЭлектролизРасплавовРастворов Процесс на катоде не зависит от
- 4. Электролиз расплава щелочи
- 5. Электролиз растворов
- 6. Катодный процесс
- 7. Li+, K+, Ba2+, Ca2+, Na+,
- 8. Zn2+, Cr3+, Fe2+, Sn2+, Pb2+ Восстановление воды
- 9. Кислоты 2Н+ + 2 е = Н20
- 10. Cu2+, Ag+Восстановление металла Ме n+ + n e = Мe 0
- 11. Анодный процесс
- 12. F - , SO42- , NO3- ,
- 13. СL - , Br - , I
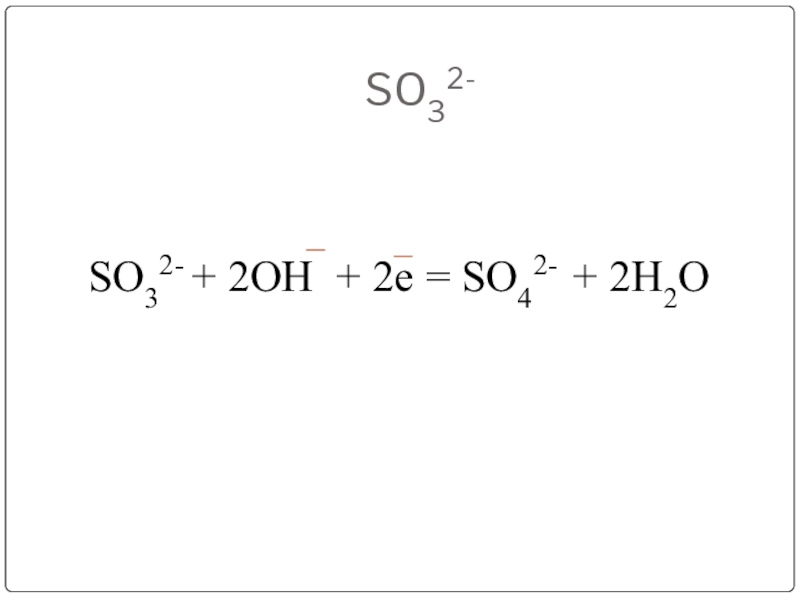
- 14. SO32-SO32- + 2ОН + 2е = SO42- + 2Н2О
- 15. Слайд 15
- 16. Слайд 16
- 17. Слайд 17
- 18. Слайд 18
- 19. Электролиз растворов солей карбоновых кислот (реакция
Электролиз – это окислительно-восстановительный процесс, который протекает на электродах, если через раствор или расплав электролита пропустить постоянный электрический ток
Слайд 1ГБОУ СОШ № 1 им. Г.М. Шубникова
«Электролиз»
Гузикова Оксана Александровна
учитель химии высшей
Слайд 2
Электролиз – это окислительно-восстановительный процесс, который протекает на электродах, если через
раствор или расплав электролита пропустить постоянный электрический ток
Слайд 3Электролиз
Расплавов
Растворов
Процесс на катоде не зависит от материала катода, а зависит
от активности металла
Процесс на аноде зависит от материала и от природы аниона
Процесс на аноде зависит от материала и от природы аниона
Слайд 8Zn2+, Cr3+, Fe2+, Sn2+, Pb2+
Восстановление воды и металла (одновременно)
2Н2О + 2 е = Н2 + 2ОН
Ме n+ + n e = Мe 0
Слайд 19Электролиз растворов солей карбоновых кислот
(реакция Кольбе)
электролиз
2 RCOONa +2Н2О R-R + 2 CO2 + H2 + 2NaOН
2 RCOONa +2Н2О R-R + 2 CO2 + H2 + 2NaOН