- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
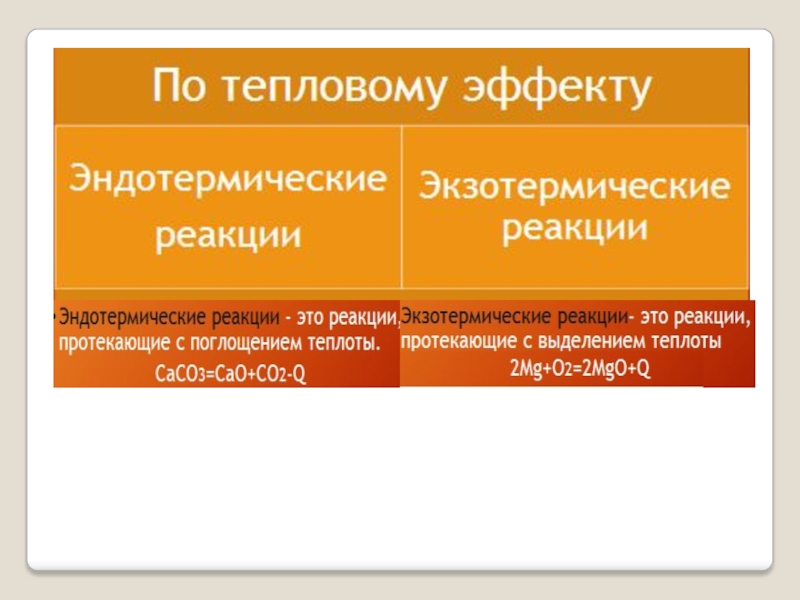
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Классификация химических реакций (9 класс)
Содержание
- 1. Классификация химических реакций (9 класс)
- 2. Вспомним…Признаки химической реакцииКлассификацию химических реакцийЗадание:Кликайте по реакциям,
- 3. А что же такое химическая реакция? Химические реакции
- 4. По числу и составу реагирующих веществ: Реакции,
- 5. Реакции, идущие с изменением состава веществ S0
- 6. Реакции, идущие с изменением состава веществ Мg(OH)2
- 7. Реакции, идущие с изменением состава веществ Na
- 8. Реакции, идущие с изменением состава веществ NaOH
- 9. Слайд 9
- 10. Вода и растворимые солиСпирт и водаБензин и
- 11. Слайд 11
- 12. NH3 + O2 = NO + H2O
- 13. Степень окисления – это условный заряд, образующийся
- 14. Как найти степень окисления:У простых веществ, степень
- 15. S0 + O20 = SO2-2
Вспомним…Признаки химической реакцииКлассификацию химических реакцийЗадание:Кликайте по реакциям, смотрите как они происходят и записывайте к каждой реакции признаки ее протекания
Слайд 2Вспомним…
Признаки химической реакции
Классификацию химических реакций
Задание:
Кликайте по реакциям, смотрите как они происходят
и записывайте к каждой реакции признаки ее протекания
Слайд 3А что же такое химическая реакция?
Химические реакции – химические процессы, в
результате которых из одних веществ образуются другие отличающиеся от них по составу и (или) строению. При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Признаки химических реакций:
1) Выделяется газ
2) Выпадет осадок
3) Происходит изменение окраски веществ 4) Выделяется или поглощается тепло, свет
И ДР
Признаки химических реакций:
1) Выделяется газ
2) Выпадет осадок
3) Происходит изменение окраски веществ 4) Выделяется или поглощается тепло, свет
И ДР
Слайд 4По числу и составу реагирующих веществ:
Реакции, идущие без изменения состава
веществ В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
Графит Алмаз
Графит Алмаз
Слайд 5
Реакции, идущие с изменением состава веществ
S0 + O20 = SO2
Fe
+ O2 = Fe2O3
Cr + Cl2 = CrCl3
СaO + CO2 = CaCO3
Cr + Cl2 = CrCl3
СaO + CO2 = CaCO3
А) Реакции соединения
Слайд 6
Реакции, идущие с изменением состава веществ
Мg(OH)2 = MgO + H2O
HNO3
= NO2 + O2 + H2O
PbCl4 = PbCl2 + Cl2
CaCO3 =СaO + CO2
(NH4)2Cr2O7 = N2 + H2O + Cr2O3
PbCl4 = PbCl2 + Cl2
CaCO3 =СaO + CO2
(NH4)2Cr2O7 = N2 + H2O + Cr2O3
А) Реакции разложения
Слайд 7
Реакции, идущие с изменением состава веществ
Na + H2O = NaOH
+ H2
Zn + HCl = ZnCl2 + H2
Zn + NaOH +H2O = Na2[Zn(OH)4] + H2
CuSO4 + Fe = FeSO4 + Cu
Zn + HCl = ZnCl2 + H2
Zn + NaOH +H2O = Na2[Zn(OH)4] + H2
CuSO4 + Fe = FeSO4 + Cu
А) Реакции замещения
Слайд 8
Реакции, идущие с изменением состава веществ
NaOH + HCl = NaCl
+ H2O
AgNO3 + NaCl = AgCl + NaNO3
Na2[Zn(OH)4] + HCl = NaCl + Zn(OH)2 + H2O
CuSO4 + NaOH = Cu(OH)2 + Na2SO4
AgNO3 + NaCl = AgCl + NaNO3
Na2[Zn(OH)4] + HCl = NaCl + Zn(OH)2 + H2O
CuSO4 + NaOH = Cu(OH)2 + Na2SO4
А) Реакции обмена
Слайд 10Вода и растворимые соли
Спирт и вода
Бензин и керосин
И др.
Вода и нерастворимые
соли
Вода и металл
Вода и воздух
Вода и бензин
И др.
Вода и металл
Вода и воздух
Вода и бензин
И др.
Слайд 13Степень окисления – это условный заряд, образующийся на атоме, если считать
что все связи в молекуле – ионные.
Слайд 14Как найти степень окисления:
У простых веществ, степень окисления всегда 0.
У Ме
первой группы, главной подгруппы (IA) +1
У Ме второй группы, главной подгруппы (IIA) +2
У Ме третьей группы, главной подгруппы (IIIA) +3
У фтора всегда -1
У кислорода в оксидах, гидроксидах, солях -2
У водорода в оксидах, гидроксидах, солях +1
У Ме второй группы, главной подгруппы (IIA) +2
У Ме третьей группы, главной подгруппы (IIIA) +3
У фтора всегда -1
У кислорода в оксидах, гидроксидах, солях -2
У водорода в оксидах, гидроксидах, солях +1
Слайд 15
S0 + O20 = SO2-2
x – 2·2 = 0
Fe + O2 = Fe2O3 2·x - 2·3 = 0
Cr + Cl2 = CrCl3 х - 1·3 = 0
СaO + CO2 = CaCO3 +2 + x - 2·3 = 0
Расставьте степени окисления во всех реакциях темы.
Fe + O2 = Fe2O3 2·x - 2·3 = 0
Cr + Cl2 = CrCl3 х - 1·3 = 0
СaO + CO2 = CaCO3 +2 + x - 2·3 = 0
Расставьте степени окисления во всех реакциях темы.