- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Кружковая работа студентов на тему: Санитарно-бактериологическое исследование воды
Содержание
- 1. Кружковая работа студентов на тему: Санитарно-бактериологическое исследование воды
- 2. Исследованию подлежит вода:1) централизованного водоснабжения; 2) из
- 3. В соответствии с Законом РФ «О санитарно-эпидемиологическом
- 4. Степень экологического неблагополучия водоемов оценивают по двум
- 5. Нормирование качества вод проводят по следующим показателям:-
- 6. Микробиологические основные показатели:1) определение числа мезофильных сапротрофных
- 7. Дополнительные: 3) определение числа бляшкообразующих единиц (БОЕ)
- 8. 5) определение числа Esherichiacoli. (или ТКБ). Этот
- 9. 7) определение числа стафилококков. Стафилококки определяют в
- 10. Отбор и транспортировка проб воды Отбор проб
- 11. Способы отбора проб воды могут быть различными,
- 12. Пробы воды исследуют не позднее чем через
- 13. Отобранные пробы сопровождаются документом, содержащим следующие сведения:-
- 14. Методы исследований Определение микробного числа (МАФАнМ
- 15. Проба с резазуринатом натрия Метод используют как
- 16. Метод предельных разведений Метод включает приготовление разведений,
- 17. Определение бактерий группы кишечных палочек (БГКП) Обнаружение
- 18. При росте на среде Эндо темно-красных колоний
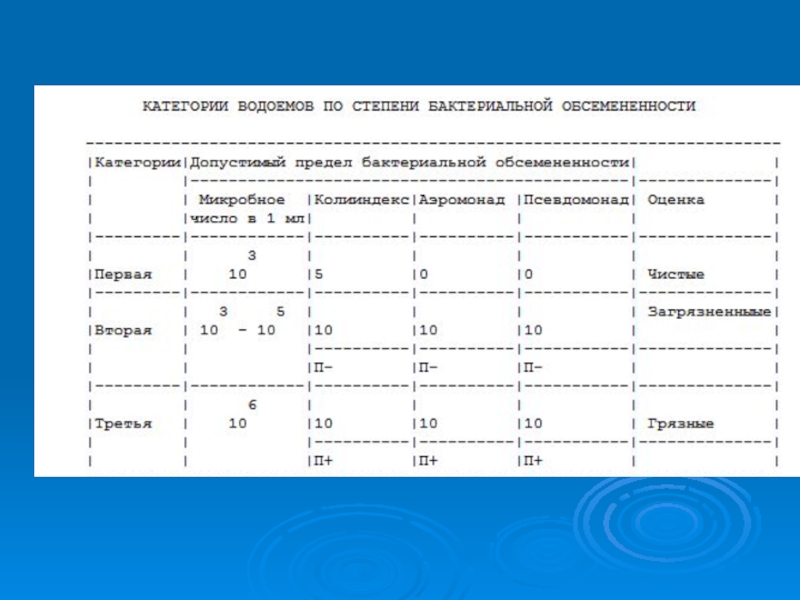
- 19. Слайд 19
- 20. Выявление свежего фекального загрязнения Для определения наличия
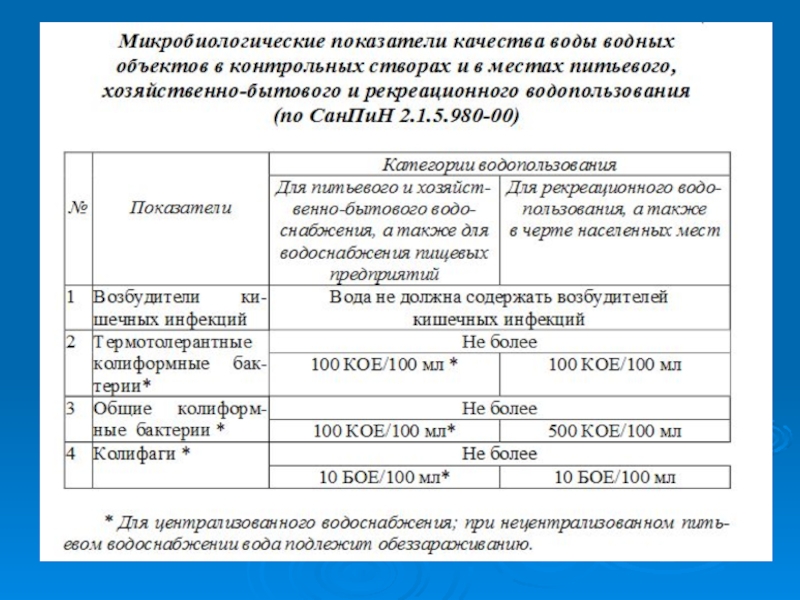
- 21. Слайд 21
- 22. СПАСИБО за ВНИМАНИЕ!
Исследованию подлежит вода:1) централизованного водоснабжения; 2) из колодцев различного типа; 3) открытых водоемов (рек, озер, морей); 4) плавательных бассейнов; 5) сточных вод.
Слайд 1Санитарно-бактериологическое исследование водоемов.
Подготовили
Студентки 3 курса:
Джемилова К.
Галкина Т.
Проверила:
Гончарова А.И.
Слайд 2Исследованию подлежит вода:
1) централизованного водоснабжения;
2) из колодцев различного типа;
3)
открытых водоемов (рек, озер, морей);
4) плавательных бассейнов;
5) сточных вод.
4) плавательных бассейнов;
5) сточных вод.
Слайд 3В соответствии с Законом РФ «О санитарно-эпидемиологическом
благополучии населения»
водные объекты, используемые в тех или иных целях, не должны являться источниками биологических, химических и физических факторов вредного воздействия на здоровье человека.
Основные понятия в области качества вод установлены ГОСТ 27065-86 (СТ СЭВ 5184-
85) «Качество вод».
Основные понятия в области качества вод установлены ГОСТ 27065-86 (СТ СЭВ 5184-
85) «Качество вод».
Слайд 4Степень экологического неблагополучия водоемов оценивают по двум основным факторам:
1) опасное для
здоровья людей снижение качества питьевой воды и воды водных объектов рекреационного назначения, т.е. фактор изменения среды обитания человека (санитарно
-гигиенический аспект);
2) создание угрозы деградации или нарушения функций воспро-
изводства основных биотических компонентов естественных экологических систем водоемов, т.е. ′′общеэкологический′′
фактор изменения природной среды (экологический аспект).
-гигиенический аспект);
2) создание угрозы деградации или нарушения функций воспро-
изводства основных биотических компонентов естественных экологических систем водоемов, т.е. ′′общеэкологический′′
фактор изменения природной среды (экологический аспект).
Слайд 5Нормирование качества вод проводят по следующим показателям:
- органолептическим(температура, запах, привкус, цветность,
мутность);
- химическим(показатели химического состава);
- санитарным(ПАВ, БПК, ХПК, перманганатная окисляемость, аммоний, нитриты, нитраты);
- биологическим (микробиологическим, паразитологическим).
Слайд 6Микробиологические основные показатели:
1) определение числа мезофильных сапротрофных аэробных и факультативно анаэробных
микроорганизмов, вырастающих при
температуре 20- 22°С и 37°С.
Соотношение численности этих групп микроорганизмов позволяет судить о динамике и интенсивности процесса самоочищения. При 20- 22°С вырастает больше сапротрофных микроорганизмов, чем при 37°С. Эта разница более выражена при завершении процесса самоочищения. В местах загрязнения хозяйстве
нно-бытовыми сточными водами численные значения обеих групп
близки. Сапротрофы, вырастающие при 20- 22°С, являются активными участниками процесса самоочищения водоемов. Динамика численности сапротрофов, вырастающих при 37°С, является чувств
ительным индикатором загрязнения вод, в частности органическими
веществами;
2) определение ЛКП (или ОКБ).
температуре 20- 22°С и 37°С.
Соотношение численности этих групп микроорганизмов позволяет судить о динамике и интенсивности процесса самоочищения. При 20- 22°С вырастает больше сапротрофных микроорганизмов, чем при 37°С. Эта разница более выражена при завершении процесса самоочищения. В местах загрязнения хозяйстве
нно-бытовыми сточными водами численные значения обеих групп
близки. Сапротрофы, вырастающие при 20- 22°С, являются активными участниками процесса самоочищения водоемов. Динамика численности сапротрофов, вырастающих при 37°С, является чувств
ительным индикатором загрязнения вод, в частности органическими
веществами;
2) определение ЛКП (или ОКБ).
Слайд 7Дополнительные:
3) определение числа бляшкообразующих единиц (БОЕ) фагов кишечных палочек. Определение
числа БОЕ фагов кишечных палочек в воде осуществляется в том случае, если невозможно или затруднено проведение исследований на содержание кишечных вирусов;
4) определение бактерий родовSalmonellaи
Shigella. Это исследование проводят при неблагоприятной санитарной и эпидемической обстановке, а также при превышении нормативов по коли-индексу.
Выделение из воды сальмонелл тифа, паратифов и шигелл свидетельствуют об эпидемической опасности данного водного объекта. В этом случае он не может служить источником водоснабжения и для рекреационных целей;
4) определение бактерий родовSalmonellaи
Shigella. Это исследование проводят при неблагоприятной санитарной и эпидемической обстановке, а также при превышении нормативов по коли-индексу.
Выделение из воды сальмонелл тифа, паратифов и шигелл свидетельствуют об эпидемической опасности данного водного объекта. В этом случае он не может служить источником водоснабжения и для рекреационных целей;
Слайд 85) определение числа Esherichiacoli. (или ТКБ). Этот показатель определяют при оценке
качества воды поверхностных водоемов для расшифровки характера и происхождения микробного загрязнения, превышающего норматив. Наличие в воде E. coliсвыше 1000 кл/л свидетельствует о недавнем поступлении хозяйственного-фекального загрязнения, о незавершенных процессах самоочищения, о несоблюдении требований к очистке сточных вод. В этих случаях водоем представляет потенциальную эпидемическую опасность;
6) определение числа энтерококков. Энтерококки рекомендуется определять для подтверждения фекального характера загрязнения. При индексе энтерококков свыше 500 предполагается поступление
свежего фекального загрязнения и опасность в эпидемическом отно-
шении;
6) определение числа энтерококков. Энтерококки рекомендуется определять для подтверждения фекального характера загрязнения. При индексе энтерококков свыше 500 предполагается поступление
свежего фекального загрязнения и опасность в эпидемическом отно-
шении;
Слайд 97) определение числа стафилококков. Стафилококки определяют в воде водоемов, используемых для
купания. Сигнальное значение для регламентации нагрузки на зону купания имеет наличие свыше 100 стафилококков в 1 л воды.
8) определение холерного вибриона.
8) определение холерного вибриона.
Слайд 10Отбор и транспортировка проб воды
Отбор проб воды из больших водоемов производится
в нескольких местах с учетом гидробиологических особенностей каждого участка (заросли, отмели, песчаные и заболоченные участки и т.д.).
Водоемы однотипные по гидробиологическим условиям исследуют в одном-двух местах на расстоянии 3 - 4 м от берега. Пробы берут на глубине 10 - 15 см от поверхности и не менее 10 - 15 см от дна, в зимовальных прудах и в других водоемах в зимний период из проруби - на глубине 10 - 15 см от нижней поверхности льда. Для контроля над течением микробиологических процессов и состоянием рыбы в прудах отбирают также несколько проб по вертикали.
Выемку проб осуществляют на притоке, в средней части и у водовыпуска. В неблагополучных по инфекционным заболеваниям водоемах пробы воды отбирают 1 - 2 раза в месяц через равные промежутки времени. При комплексных исследованиях сначала отбирают пробы для микробиологических, затем химических и гидробиологических исследований.
Водоемы однотипные по гидробиологическим условиям исследуют в одном-двух местах на расстоянии 3 - 4 м от берега. Пробы берут на глубине 10 - 15 см от поверхности и не менее 10 - 15 см от дна, в зимовальных прудах и в других водоемах в зимний период из проруби - на глубине 10 - 15 см от нижней поверхности льда. Для контроля над течением микробиологических процессов и состоянием рыбы в прудах отбирают также несколько проб по вертикали.
Выемку проб осуществляют на притоке, в средней части и у водовыпуска. В неблагополучных по инфекционным заболеваниям водоемах пробы воды отбирают 1 - 2 раза в месяц через равные промежутки времени. При комплексных исследованиях сначала отбирают пробы для микробиологических, затем химических и гидробиологических исследований.
Слайд 11Способы отбора проб воды могут быть различными, но обязательным условием является
соблюдение асептики и взятие материала в стерильную посуду. Пробы воды в количестве 500 мл отбирают в стерильную посуду с притертой каучуковой или корковой пробкой. Наполняют флаконы или склянки с таким расчетом, чтобы при транспортировке не замочить пробку. Посуду и батометры стерилизуют завернутыми в бумагу и разворачивают их непосредственно перед взятием проб воды.
Слайд 12Пробы воды исследуют не позднее чем через 2 ч после отбора.
При невозможности выполнения этих условий допускается проведение анализа не позднее чем через 24 ч после отбора проб, сохраняя при этом пробы при температуре от 1 до 5 °С. При этом обязательным условием является фиксация их формалином из расчета 2 - 3 капли (0,1 мл) 40%-ного раствора на 100 мл воды. Склянки с зафиксированными пробами плотно закрывают притертыми пробками, на которые надевают резиновые колпачки. Посуду с пробами упаковывают в сумки-холодильники или в ящики с теплоизолирующей прокладкой. При транспортировке проб избегают различных толчков, которые могут привести к намоканию пробок.
Слайд 13Отобранные пробы сопровождаются документом, содержащим следующие сведения:
- точное месторасположение водоема;
- дату
отбора (с указанием года, месяца, числа и часа);
- количество отобранных проб и место их отбора;
- цель исследования: сделан ли отбор в порядке текущего санитарного надзора или по особым показаниям (сигналы об эпизоотологическом неблагополучии и т.д.).
Сопроводительный документ подписывает лицо, отбиравшее пробы, с указанием места работы и должности.
- количество отобранных проб и место их отбора;
- цель исследования: сделан ли отбор в порядке текущего санитарного надзора или по особым показаниям (сигналы об эпизоотологическом неблагополучии и т.д.).
Сопроводительный документ подписывает лицо, отбиравшее пробы, с указанием места работы и должности.
Слайд 14Методы исследований
Определение микробного числа (МАФАнМ КОЕ/куб. см (г)) воды (грунта).
Микробное
число определяют чашечным методом, методом предельных разведений или - ориентировочно - пробой с резазуринатом натрия.
Слайд 15Проба с резазуринатом натрия
Метод используют как ориентировочный, не исключающий определение
микробного числа чашечным методом или методом предельных разведений. В зависимости от количества микроорганизмов в исследуемой пробе через определенное время происходит изменение синего цвета раствора резазурината натрия в фиолетовый, красный или обесцвечивание.
К 9,0 мл исследуемой воды добавляют 1,0 мл стерильного мясопептонного бульона (МПБ) и 1,0 мл 0,01%-ного водного раствора резазурината натрия (резазурина). Содержимое пробирок перемешивают и пробы помещают в термостат при температуре 37 °С. Одновременно ставится контроль: 9 мл дистиллированной воды + 1,0 мл МПБ + 1,0 мл 0,01%-ного водного раствора резазурината натрия. Через каждый час визуально учитывают результаты. Изменение цвета в фиолетовый через 2 - 3 часа и в красный (розовый) через 3 - 4 часа свидетельствует о неудовлетворительном, а в фиолетовый через 4 - 5 и красный (розовый) через 6 - 7 часов - о сомнительном, в более поздние сроки - об удовлетворительном качестве воды. Цвет среды в контрольных пробирках должен быть синим. Раствор резазурината натрия готовят перед использованием.
К 9,0 мл исследуемой воды добавляют 1,0 мл стерильного мясопептонного бульона (МПБ) и 1,0 мл 0,01%-ного водного раствора резазурината натрия (резазурина). Содержимое пробирок перемешивают и пробы помещают в термостат при температуре 37 °С. Одновременно ставится контроль: 9 мл дистиллированной воды + 1,0 мл МПБ + 1,0 мл 0,01%-ного водного раствора резазурината натрия. Через каждый час визуально учитывают результаты. Изменение цвета в фиолетовый через 2 - 3 часа и в красный (розовый) через 3 - 4 часа свидетельствует о неудовлетворительном, а в фиолетовый через 4 - 5 и красный (розовый) через 6 - 7 часов - о сомнительном, в более поздние сроки - об удовлетворительном качестве воды. Цвет среды в контрольных пробирках должен быть синим. Раствор резазурината натрия готовят перед использованием.
Слайд 16Метод предельных разведений
Метод включает приготовление разведений, посев в жидкую питательную
среду МПБ, регистрацию наличия или отсутствия роста после инкубации и расчет наиболее вероятного числа клеток в единице объема исследуемой воды по таблице Мак-Креди (см. Приложение 1).
Чашечный метод определения количества микробных клеток обеспечивает большую точность по сравнению с методом предельных разведений, однако, при посеве на МПА в чашки иногда происходит зарастание агара микрофлорой, обладающей ползучим ростом. В этом случае метод предельных разведений является более приемлемым. Приготовление разведений производится точно так же, как и для чашечного метода. Посев в мясопептонный бульон производится при соблюдении условий стерильности в количестве 1,0 мл каждого разведения параллельно в 3 - 5 пробирок, содержащих по 5,0 мл МПБ. Результаты учитывают через 5 суток. После инкубации при температуре 27 °С регистрируют наличие или отсутствие роста микроорганизмов визуально (помутнение среды, образование пленки, осадка). Наиболее вероятное количество микробных клеток в единице объема определяют с помощью таблицы, разработанной на основании методов вариационной статистики Мак-Креди
Чашечный метод определения количества микробных клеток обеспечивает большую точность по сравнению с методом предельных разведений, однако, при посеве на МПА в чашки иногда происходит зарастание агара микрофлорой, обладающей ползучим ростом. В этом случае метод предельных разведений является более приемлемым. Приготовление разведений производится точно так же, как и для чашечного метода. Посев в мясопептонный бульон производится при соблюдении условий стерильности в количестве 1,0 мл каждого разведения параллельно в 3 - 5 пробирок, содержащих по 5,0 мл МПБ. Результаты учитывают через 5 суток. После инкубации при температуре 27 °С регистрируют наличие или отсутствие роста микроорганизмов визуально (помутнение среды, образование пленки, осадка). Наиболее вероятное количество микробных клеток в единице объема определяют с помощью таблицы, разработанной на основании методов вариационной статистики Мак-Креди
Слайд 17Определение бактерий группы кишечных палочек (БГКП)
Обнаружение в воде кишечных палочек
следует рассматривать как показатель поступления в пруды животноводческих или городских сточных вод, а их количество позволяет судить о степени этого загрязнения. Наличие и количественный учет кишечных палочек определяют бродильным методом. Сущность метода заключается в посеве определенных объемов анализируемой воды в среды накопления и подращивания при температуре 37 +/- 0,5 °С с последующими пересевом на плотную питательную среду Эндо и дифференциацией выросших бактерий. Пробы воды и их разведения высевают по 1,0 или 0,5 мл (в зависимости от количества среды в соотношении 1:10) в глюкозопептонную среду (ГПС) или среду ВНИИВС. Посевы инкубируют при температуре 43 +/- 5 °С в течение 24 ч. Отсутствие помутнения, образование кислоты и газа в ГПС или помутнение и изменение цвета среды ВНИИВС из сиреневого в салатный дают основание предположить наличие бактерий группы кишечной палочки. В этих случаях производят пересев на среду Эндо. Посевной материал следует брать с таким расчетом, чтобы выросли изолированные колонии. Для этого производят пересев бактериологической петлей штрихами по поверхности среды. Чашки с посевами помещают в термостат и инкубируют при температуре 37 +/- 0,5° С в течение 24 - 48 ч.
Слайд 18При росте на среде Эндо темно-красных колоний с металлическим блеском их
принадлежность к БГКП подтверждают микроскопированием мазков, окрашенных по Граму, и постановкой оксидазного теста. Наличие мелких неспорообразующих грамотрицательных палочек в мазках и отрицательный оксидазный тест позволяют дать заключение о содержании кишечной палочки в анализируемой пробе воды.
Для постановки оксидазного теста берут петлей 2 - 3 изолированные колонии, выросшие на среде Эндо, и наносят штрихом на фильтровальную бумагу, смоченную соответствующим реактивом (см. Приложение 3, п. 6). При отрицательной реакции на оксидазный тест фильтровальная бумага не изменяет цвета в течение 1 - 2 мин. после нанесения бактериальной массы. При активной реакции на оксидазу фильтровальная бумага синеет в течение 1 - 2 мин.
Определение титра БГКП (колититра) проводят установлением наименьшего количества воды, в котором находится одна кишечная палочка.
Для постановки оксидазного теста берут петлей 2 - 3 изолированные колонии, выросшие на среде Эндо, и наносят штрихом на фильтровальную бумагу, смоченную соответствующим реактивом (см. Приложение 3, п. 6). При отрицательной реакции на оксидазный тест фильтровальная бумага не изменяет цвета в течение 1 - 2 мин. после нанесения бактериальной массы. При активной реакции на оксидазу фильтровальная бумага синеет в течение 1 - 2 мин.
Определение титра БГКП (колититра) проводят установлением наименьшего количества воды, в котором находится одна кишечная палочка.
Слайд 20Выявление свежего фекального загрязнения
Для определения наличия в воде свежих фекальных кишечных
палочек производят посев воды (3-х объемов) на лактозопептонную среду с борной кислотой. Инкубируют при 43° С 24 ч. Наличие кислоты и газа свидетельствует о свежем фекальном загрязнении.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.
По эпидемиологическим показаниям в воде определяют сальмонеллы, шигеллы, энтеровирусы.
Примечание. Общепринятым дополнительным показателем фекального загрязнения питьевой воды являются энтерококки. При проведении бактериологического исследования определяют все группы энтерококков, хотя санитарное значение имеют преимущественно фекальные стрептококки, обнаружение которых является показателем свежего фекального загрязнения.