- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Вторая группа химических элементов
Содержание
- 1. Вторая группа химических элементов
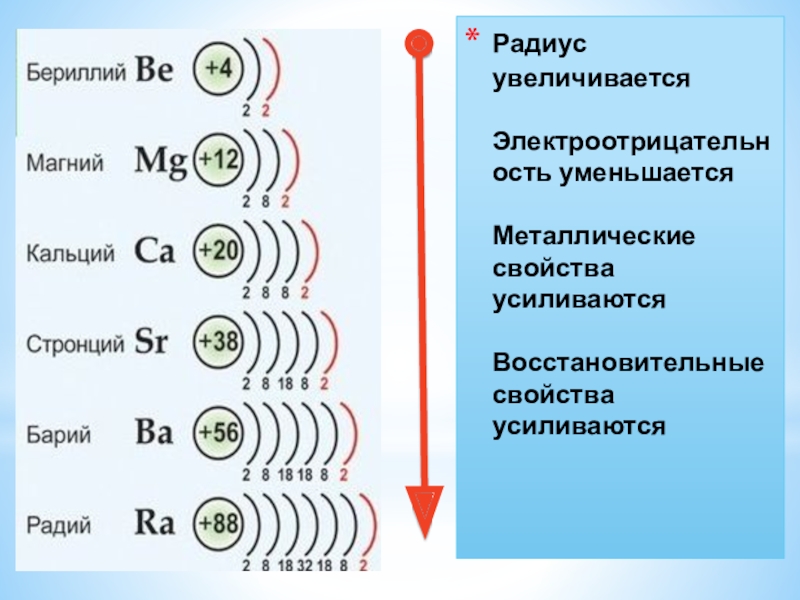
- 2. Радиус увеличивается Электроотрицательность уменьшается Металлические свойства усиливаются Восстановительные свойства усиливаются
- 3. Все элементы этой подгруппы относятся к металлам. Кальций, стронций, барий и радий называются щелочноземельными металлами.
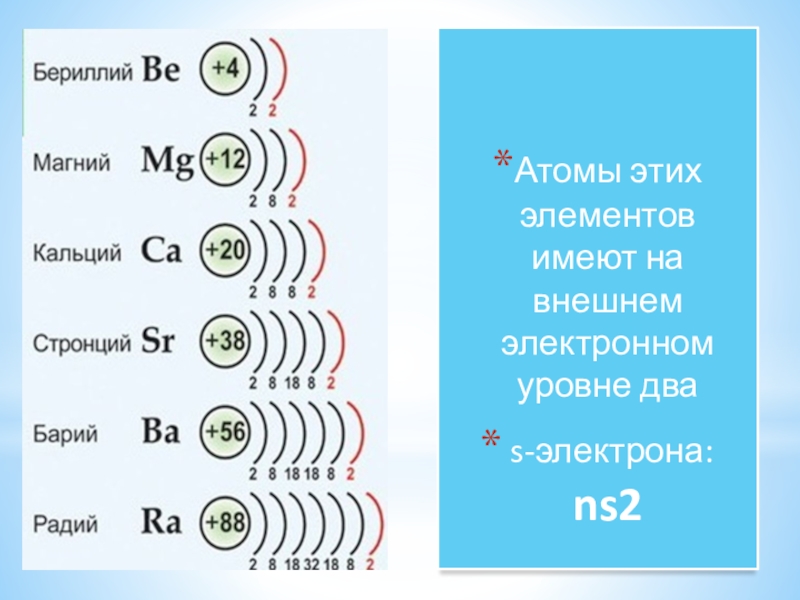
- 4. Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: ns2
- 5. При возбуждении s-электроны переходят на р-подуровень и
- 6. В природе элементы главной подгруппы II группы
- 7. На воздухе Be и Mg покрываются
- 8. Химические свойства щелочноземельных металловЩелочноземельные металлы химически весьма
- 9. Аналитические реакции катионов магния Mg 2+Реакция с
- 10. Слайд 10
- 11. История открытия бериллияДанный химический элемент длительное время
- 12. Магний-постоянная составная часть организма человека. Обладает антистрессовыми
- 13. Открытие кальция. в 1808 году английский ученый
- 14. Слайд 14
Радиус увеличивается Электроотрицательность уменьшается Металлические свойства усиливаются Восстановительные свойства усиливаются
Слайд 2Радиус увеличивается
Электроотрицательность уменьшается
Металлические свойства усиливаются
Восстановительные свойства
усиливаются
Слайд 3Все элементы этой подгруппы относятся к металлам. Кальций, стронций, барий и
радий называются щелочноземельными металлами.
Слайд 5При возбуждении s-электроны переходят на р-подуровень и тогда возможно образование двух
связей(валентность равна двум). В соединениях металлы проявляют степень окисления +2
Слайд 6В природе элементы главной подгруппы II группы широко распространены (кроме Be
и Ra). За счет высокой активности в свободном состоянии не встречаются, всегда в виде соединений: CaCO3 – известняк, CaCO3.MgCO3 – доломит, MgCO3 – магнезит, CaSO4.2H2O – гипс, CaF2 – флюорит, BaCO3 – витерит, SrCO3 – стронцианит, MgCl2.KCl – карналит, Be3Al3[Si6O18] – берилл (изумруд, аквамарин). Радий содержится в урановых рудах в ничтожных количествах. Для получения одного грамма Ra необходимо переработать около 30 тонн руды.
Получают щелочноземельные металлы электролизом расплавленных солей.
Получают щелочноземельные металлы электролизом расплавленных солей.
Слайд 7 На воздухе Be и Mg покрываются защитной пленкой и сгорают
только
при поджигании, тогда как Ca, Sr, Ba самовоспламеняются при
контакте с воздухом.
Оксид бериллия имеет амфотерные свойства, остальные оксиды - основные свойства.
контакте с воздухом.
Оксид бериллия имеет амфотерные свойства, остальные оксиды - основные свойства.
Слайд 8Химические свойства щелочноземельных металлов
Щелочноземельные металлы химически весьма активны, в реакциях проявляют
свойства восстановителей. Взаимодействуют с
1. Кислородом (горят на воздухе)
2Са + О2 = 2СаО
Оксид бария при нагреваии до 500оС образуeт пероксид:
2BaO + O2 = 2BaO2
2. С водородом при нагревании образуют гидриды
Ca + H2 = CaH2
3. С серой реагируют в обычных условиях, образуя сульфиды
Ca + S = CaS
4. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
Са + 2Н2О = Са(ОН)2 + Н2
5. Восстанавливают другие металлы из их соединений, например:
UF4 + 2Ca = U + 2CaF2
1. Кислородом (горят на воздухе)
2Са + О2 = 2СаО
Оксид бария при нагреваии до 500оС образуeт пероксид:
2BaO + O2 = 2BaO2
2. С водородом при нагревании образуют гидриды
Ca + H2 = CaH2
3. С серой реагируют в обычных условиях, образуя сульфиды
Ca + S = CaS
4. С водой – растворяются с выделением водорода, реакция протекает спокойнее, чем со щелочными металлами:
Са + 2Н2О = Са(ОН)2 + Н2
5. Восстанавливают другие металлы из их соединений, например:
UF4 + 2Ca = U + 2CaF2
Слайд 9Аналитические реакции катионов магния Mg 2+
Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию
проводят в аммиачном буфере:
Mg2+ + НРО42- + NH3 -- NH4MgPO4
| (белый кристаллический)
Mg2+ + НРО42- + NH3 -- NH4MgPO4
| (белый кристаллический)
Слайд 11История открытия бериллия
Данный химический элемент длительное время не удавалось открыть. Многим
был известен минерал берилл, по названию которого и был назван новый химический элемент. Они не могли определить присутствие нового химического элемента в минерале.
Даже используя современнейшие методы анализа, нелегко определить бериллий . Это связано с тем, что он очень похож на алюминий, и как бы скрывался за ним.
Даже используя современнейшие методы анализа, нелегко определить бериллий . Это связано с тем, что он очень похож на алюминий, и как бы скрывался за ним.
Луи Никола Воклен (1763-1829)
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твёрдость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий.
Слайд 12Магний
-постоянная составная часть организма человека. Обладает антистрессовыми свойствами.
Магний – самый легкий
конструкционный материал, используемый в промышленных масштабах . Кроме того, магний прекрасно обрабатывается и может быть отлит и переделан любыми стандартными методами металлообработки Поэтому его основная область применения – в качестве легкого конструкционного металла.
Особенно широко применяют сплавы магния с алюминием, цинком и марганцем Магний придает сплаву легкость.
Особенно широко применяют сплавы магния с алюминием, цинком и марганцем Магний придает сплаву легкость.
Слайд 13Открытие кальция.
в 1808 году английский ученый Г. Дэви сумел получить
из извести новый металл. Для этого Дэви подверг электролизу смесь слегка увлажненной гашеной извести с окисью ртути и выделил из образующейся на ртутном катоде амальгамы новый металл, который он назвал кальцием (от лат. calx, род. падеж calcis — известь).
Применение кальция и его соединений
Металлический кальций применяют для металлотермического получения урана, тория, титана, циркония, цезия и рубидия.
Применение кальция и его соединений
Металлический кальций применяют для металлотермического получения урана, тория, титана, циркония, цезия и рубидия.