- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Водород. Химия, 8 класс
Содержание
- 1. Водород. Химия, 8 класс
- 2. Общая характеристика.
- 3. В атоме водорода имеется положительно заряженное ядро
- 4. +1Строение атома11S1+ē-ēН+Н-Как щелочные МЕКак галогеныН2 - s-элементЕдинственный
- 5. Задача Суммарное количество протонов и нейтронов в
- 6. Нахождение в природеХотя водорода очень много на
- 7. Круговорот в природеВ природе водород образуется главным
- 8. 1.Электролиз водных растворов солей: 2NaCl +2H2O →
- 9. 1.Действие разбавленных кислот на металлы. Для проведения
- 10. Получение водорода в школеДействие разбавленных кислот на
- 11. Применение водорода
Слайд 1Водород
Общая характеристика. Нахождение в природе. Получение водорода. Приминение.
Часть 1.
Подготовила Сохибова К.И.,
Слайд 3В атоме водорода имеется положительно заряженное ядро (+1), 1 протон и
В 1913 году Нильс Бор предложил схему строения атома водорода, согласно которой положительно заряженное ядро находится в центре, а вокруг него по единственной орбитали движется электрон. В соответствии с этой схемой он вывел спектр излучения этого химического элемента. Который был позже доказан с помощью квантово-механических расчетов уравнения Шредингера (1925-1930 годы).
Нильс Бор
Эрвин Шредингер
Строение атома
Слайд 4+1
Строение атома
1
1S1
+ē
-ē
Н+
Н-
Как щелочные МЕ
Как галогены
Н2 - s-элемент
Единственный электрон, который имеется у
В результате взаимодействия водород может как терять электрон, т.е. являться его донором, так и принимать, т.е. быть акцептором.
В этих случаях атом превращается либо в положительно, либо отрицательно заряженный ион (H+/Н—):
H0 –e →H+;
H0 +e →H—.
Слайд 5Задача
Суммарное количество протонов и нейтронов в ядре атома химического элемента
Для того, чтобы рассчитать количество нейтронов в ядре элемента с атомным номером 10 и нуклонным числом 20 нужно:
n = N –p.
n = 20-10 = 10
Определите количество протонов и нейтронов в ядре атома элемента с атомным номером 10 и нуклонным числом 20.
В ядре находится 10 протонов и 10 нейтронов (10p и 10n).
Ответ :
Решение:
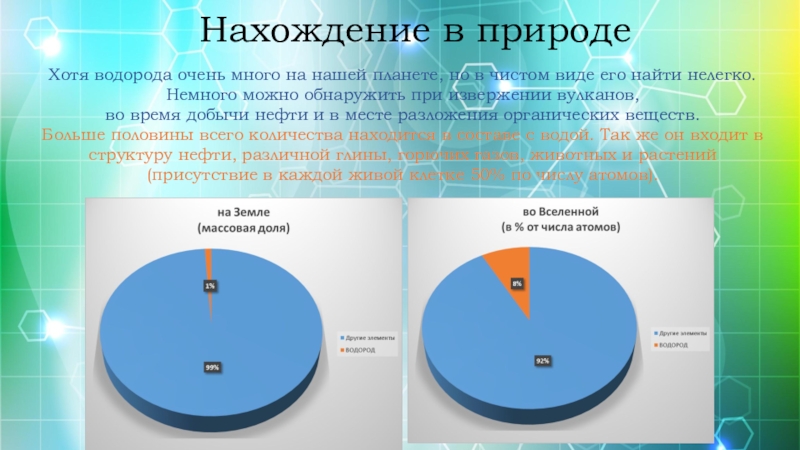
Слайд 6Нахождение в природе
Хотя водорода очень много на нашей планете, но в
Немного можно обнаружить при извержении вулканов,
во время добычи нефти и в месте разложения органических веществ.
Больше половины всего количества находится в составе с водой. Так же он входит в структуру нефти, различной глины, горючих газов, животных и растений
(присутствие в каждой живой клетке 50% по числу атомов).
Слайд 7Круговорот в природе
В природе водород образуется главным образом при разложении органических
Большие его количества освобождаются при коксовании угля; поэтому светильный и коксовый газы в среднем состоят на 50 объёмн. % из свободного водорода.
В последнее время коксовый газ стали технически перерабатывать на водород, сжижая его и выделяя водород как трудно конденсирующийся газ.
Слайд 81.Электролиз водных растворов солей:
2NaCl +2H2O → H2↑ +2NaOH +Cl2
2.Пропускание паров воды
H2O +C ⇄ H2↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:
CH4 +H2O ⇄ CO↑ +3H2↑ (1000°C)
Каталитическое окисление кислородом:
2CH4 +O2 ⇄ 2CO↑ +4H2↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в промышленности
Слайд 91.Действие разбавленных кислот на металлы.
Для проведения такой реакции чаще всего
Zn +2HCl → ZnCl2 +H2↑
2.Взаимодействие кальция с водой:
Ca +2H2O → Ca(OH)2 +H2↑
3.Гидролиз гидридов:
NaH +H2O → NaOH +H2↑
4.Действие щелочей на цинк или алюминий: 2Al +2NaOH +6H2O → 2Na[Al(OH)4] +3H2↑ Zn +2KOH +2H2O → K2[Zn(OH)4] +H2↑
5.С помощью электролиза.
При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например: 2H3O+ +2e- → H2↑ +2H2O
Получение водорода в лаборатории
Слайд 10Получение водорода в школе
Действие разбавленных кислот на металлы.
Для проведения такой
Zn +2HCl → ZnCl2 +H2↑
Прибор создал голландский аптекарь
Петер-Якоб Кипп
в 1853 году.
Фактически это малый аналог аппарата Киппа.
На газоотводную трубку надет зажим Мора
Прибор Кирюшкина