- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Важнейшие соединения галогенов.
Содержание
- 1. Важнейшие соединения галогенов.
- 2. II. Хлороводород 1. 1. Состав.
- 3. Галогеноводороды H HalHF
- 4. Хлороводород. Состав. строение.HClHCl+HCl+δ─ δЭлемент с большей ЭО,
- 5. Слайд 5
- 6. Получение хлороводородаВ лаборатории для получения HCl используют
- 7. Физические свойства хлороводородаХлороводород – это газ с
- 8. Соляная кислота (HCl) КлассификацияСоляная кислота по:наличию кислорода:основности:растворимости в воде:летучести:степени электролитической диссоциации:стабильности:бескислороднаяодноосновнаярастворимаялетучаясильнаястабильная
- 9. Физические свойства соляной кислотыСоляная кислота – бесцветная
- 10. Химические свойства соляной кислоты1. Действие соляной кислоты
- 11. Применение соляной кислоты1. Получение солей4. При паянии3.
- 12. HCl132456
- 13. Соли соляной кислоты (хлориды)Хлорид натрия1. СоставNaCl2. СтроениеХимическая
- 14. Кристаллическая решетка хлорида натрияВещества с ионным типом
- 15. Качественное определение галогенид-ионовНа соляную кислоту и ее
- 16. Тест ответы1. Химическая связь в молекуле хлороводорода:
Слайд 1Урок по теме «Важнейшие соединения галогенов »
Цель: сформировать представление о соединениях
Слайд 2II. Хлороводород
1. 1. Состав. Строение.
2.
а) в лаборатории;
б) в промышленности.
3. Физические свойства
III. Соляная кислота
1. 1. Классификация
2. 2. Физические свойства
3. 3. Химические свойства
4. 4. Применение соляной кислоты
IV. Соли соляной кислоты (Хлориды)
V. Качественная реакция на галогенид - ионы
VI. Тест
Важнейшие соединения галогенов
I. Галогеноводороды
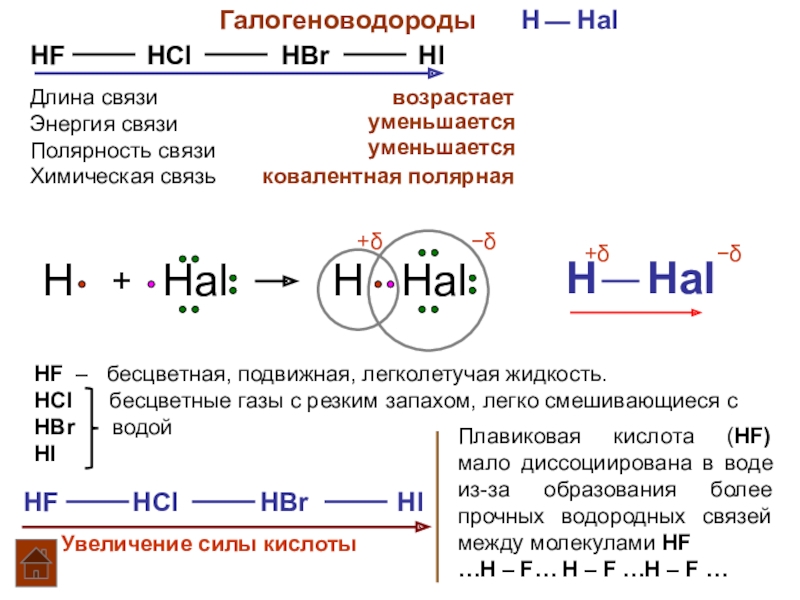
Слайд 3Галогеноводороды H Hal
HF
Длина связи
Энергия связи
Полярность связи
возрастает
уменьшается
уменьшается
Химическая связь
ковалентная полярная
H
+
Hal
H
Hal
+δ
−δ
H Hal
+δ
−δ
HF – бесцветная, подвижная, легколетучая жидкость.
HCl бесцветные газы с резким запахом, легко смешивающиеся с
HBr водой
HI
HF HCl HBr HI
Увеличение силы кислоты
Плавиковая кислота (HF) мало диссоциирована в воде из-за образования более прочных водородных связей между молекулами HF
…Н – F… Н – F …Н – F …
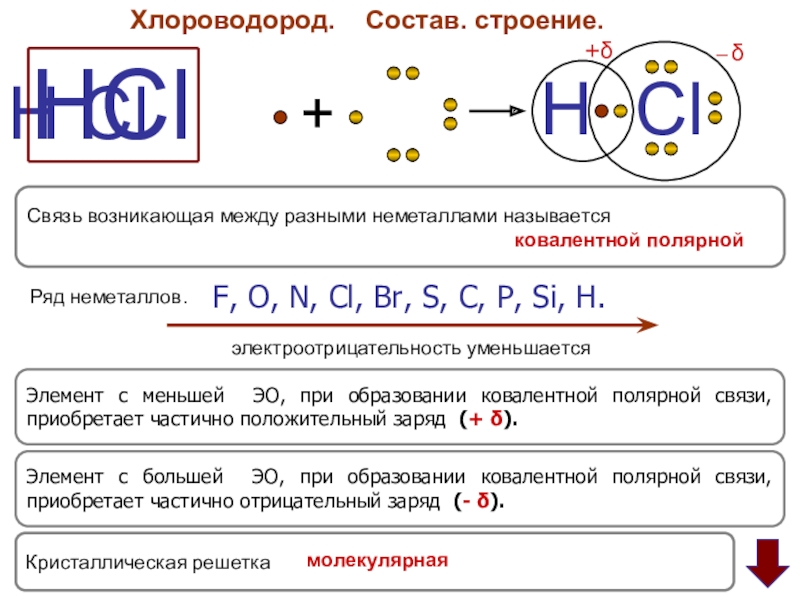
Слайд 4Хлороводород.
Состав. строение.
HCl
H
Cl
+
H
Cl
+δ
─ δ
Элемент с большей ЭО, при образовании ковалентной полярной
Элемент с меньшей ЭО, при образовании ковалентной полярной связи, приобретает частично положительный заряд (+ δ).
F, O, N, Cl, Br, S, C, P, Si, H.
электроотрицательность уменьшается
Связь возникающая между разными неметаллами называется
Ряд неметаллов.
Кристаллическая решетка
ковалентной полярной
молекулярная
Слайд 6Получение хлороводорода
В лаборатории для получения HCl используют реакцию обмена между кристаллическим
Составьте уравнение реакции:
NaCl + H2SO4 = NaHSO4 + HCl
Необратимому протеканию этой реакции способствует летучесть HCl.
В промышленности HCl получают прямым взаимодействием H2 и Cl2
(сжиганием) H2 + Cl2 = 2HCl + Q
Слайд 7Физические свойства хлороводорода
Хлороводород – это газ с резким запахом, без цвета,
в воде (500 объемов HCl в 1 объеме воды), на воздухе «дымит», так как взаимо-
действует с парами воды и образует капельки соляной кислоты. Раствор хлоро-
водорода в воде и называют соляной кислотой.
Слайд 8Соляная кислота (HCl) Классификация
Соляная кислота по:
наличию кислорода:
основности:
растворимости в воде:
летучести:
степени электролитической
стабильности:
бескислородная
одноосновная
растворимая
летучая
сильная
стабильная
Слайд 9Физические свойства соляной кислоты
Соляная кислота – бесцветная дымящаяся на воздухе жидкость
(в продажу поступает 36%-ный раствор хлороводорода в воде),
Несколько тяжелее воды (плотность 1,19 г/мл).
Слайд 10Химические свойства соляной кислоты
1. Действие соляной кислоты на индикаторы
2. Взаимодействие с
3. Взаимодействие с основными оксидами
4. Реакция нейтрализации
5. Взаимодействие с солями (самостоятельная работа с текстом учебника по изучению химических свойств и выполнение заданий на закрепление).
Слайд 11Применение соляной кислоты
1. Получение солей
4. При паянии
3. Приготовление лекарств
2. Производство пластмасс
синтетических материалов
6. Производство красок
5. Очистка поверхности металлов в
гальваностегии
Слайд 13Соли соляной кислоты (хлориды)
Хлорид натрия
1. Состав
NaCl
2. Строение
Химическая связь между катионами и
притяжением, называется
ионной
Схема образования ионной связи в хлориде натрия:
Na
+
Cl
Na
Cl
+
−
или
Na
23
11
0
)
)
)
2
8
1
+
Cl
35
17
)
)
)
7
8
2
0
Na
)
)
11
23
Cl
+
)
)
)
8
8
2
8
2
−
35
17
ион натрия
ион хлора
Na0 − 1e → Na+
Cl 0 + 1e → Cl −
Слайд 14
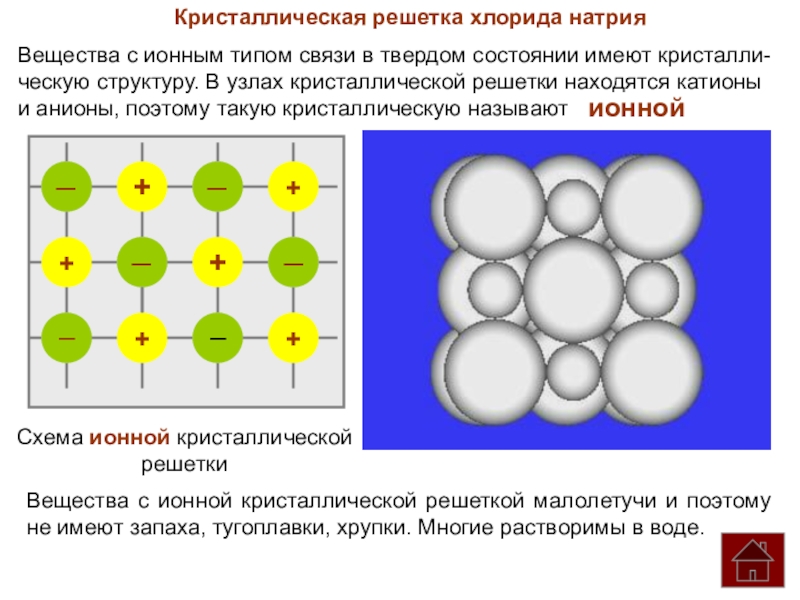
Кристаллическая решетка хлорида натрия
Вещества с ионным типом связи в твердом состоянии
ческую структуру. В узлах кристаллической решетки находятся катионы
и анионы, поэтому такую кристаллическую называют
ионной
Вещества с ионной кристаллической решеткой малолетучи и поэтому не имеют запаха, тугоплавки, хрупки. Многие растворимы в воде.
─
+
─
─
─
─
─
+
+
+
+
+
Схема ионной кристаллической
решетки
Слайд 15Качественное определение галогенид-ионов
На соляную кислоту и ее соли хлориды, равно как
Составьте уравнения реакций, рассмотрите с т.зр. ТЭД.
Nal + AgNO3 = AgI↓ + NaNO3 Ag+ + I- = AgI↓ (желтый)
NaBr + AgNO3 = AgBr↓ + NaNO3 Ag+ + Br- = AgBr↓ (светло-желтый)
NaCl + AgNO3 = AgCl↓ + NaNO3 Ag+ + Cl- = AgCl↓ (белый творожистый)
Так как AgF растворим, в качестве реактива на HF и фторид-ионы
используют реакцию с ионами Са2 , поскольку CaF2 выпадает в осадок.
Слайд 16Тест
ответы
1. Химическая связь в молекуле хлороводорода:
А) ковалентная полярная;
Б) ионная. Г) металлическая.
2. Пара формул веществ, в каждом из которых связь только ионная:
А) Cl2, NaCl; Б) HCl, Br2; В) I2, Cl2; Г) NaCl, KBr.
3. Какая соль галогеноводородной кислоты представляет собой осадок
светло−желтого цвета:
А) фтороводородная; В) бромоводородная;
Б) иодоводородная; Г) хлороводородная.
4. Соляная кислота не взаимодействует:
А) с нитратом серебра; В) с гидроксидом алюминия
Б) с оксидом кальция; Г) с бромоводородом.
5. Галогены способны вытеснять друг друга из растворов солей. Лишь один
из них не обладает такой способностью:
А) иод; Б) хлор; В) фтор: Г) бром.
6. Для получения хлороводорода в лаборатории используют:
А) раствор хлорида натрия и разб. серную кислоту.
Б) твердый хлорид натрия и конц. серную кислоту.
7. Какой объем хлороводорода (н.у.) получится при взаимодействии 15 л
хлора с избытком водорода:
А) 30 л; Б) 3 л; В) 15 л; г) 1,5 л.
А
Г
В
Г
А
Б
А