- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Важнейшие бинарные соединения
Содержание
- 1. Важнейшие бинарные соединения
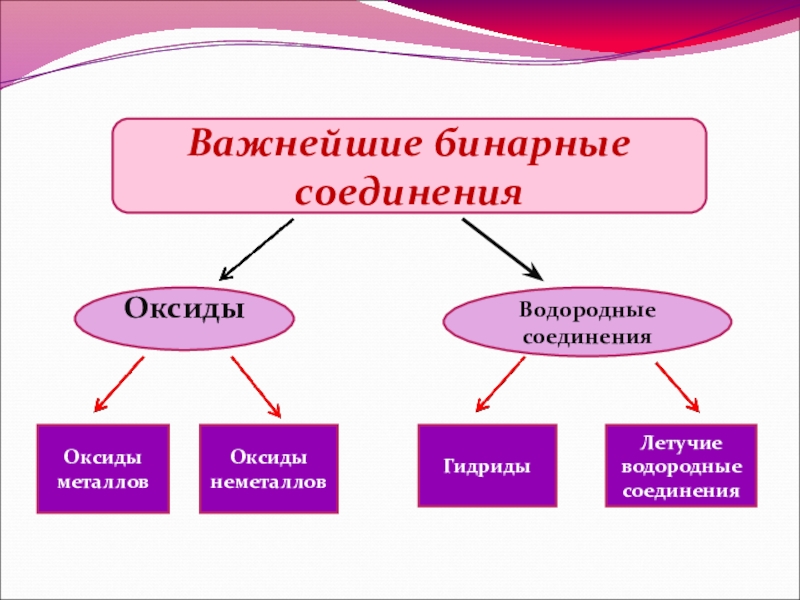
- 2. Важнейшие бинарные соединенияОксиды Водородные соединения Оксиды металловОксиды неметалловГидриды Летучие водородные соединения
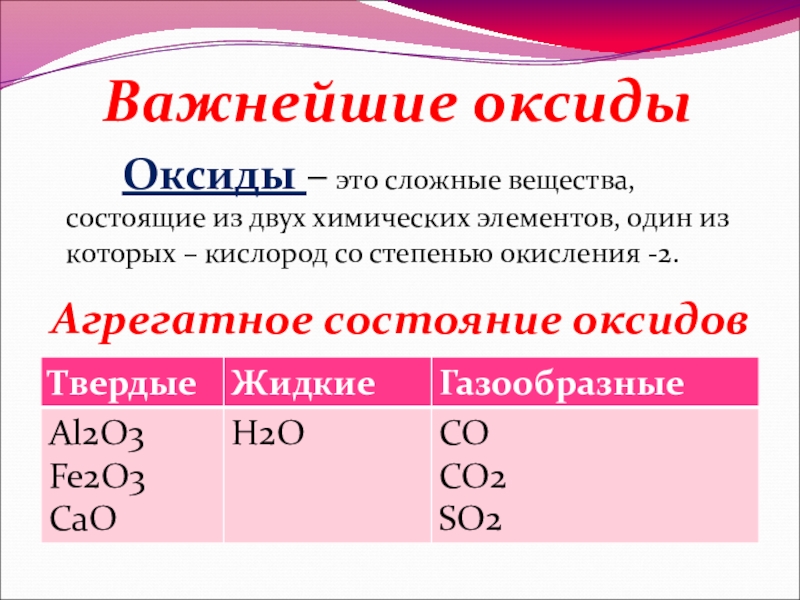
- 3. Оксиды – это сложные вещества, состоящие
- 4. Красный железняк Fe2O3 Оксид железа (III) Синонимы: красный железняк, кровавик, черный..Fe2O3, или красный железняк
- 5. МАГНИТНЫЙ ЖЕЛЕЗНЯК Fe2O4 Магнитный камень (магнитный железняк)Магнетит, он же магнитный железняк
- 6. КРЕМНЕЗЁМ (КВАРЦЕВЫЙ ПЕСОК) SiO2 oксид кремния (IV) Кварцевый песок - желтыйКварцевый песок - белый
- 7. Негашенная известь СаО оксид кальция (II)
- 8. Применение СаО
- 9. Вода H2O оксид водородаОсобенности воды:Имеет три агрегатных
- 10. Вода в природе:
- 11. Вода в промышленности:
- 12. Углекислый газ СО2 оксид углерода
- 13. СО2 оксид углерода (IV)
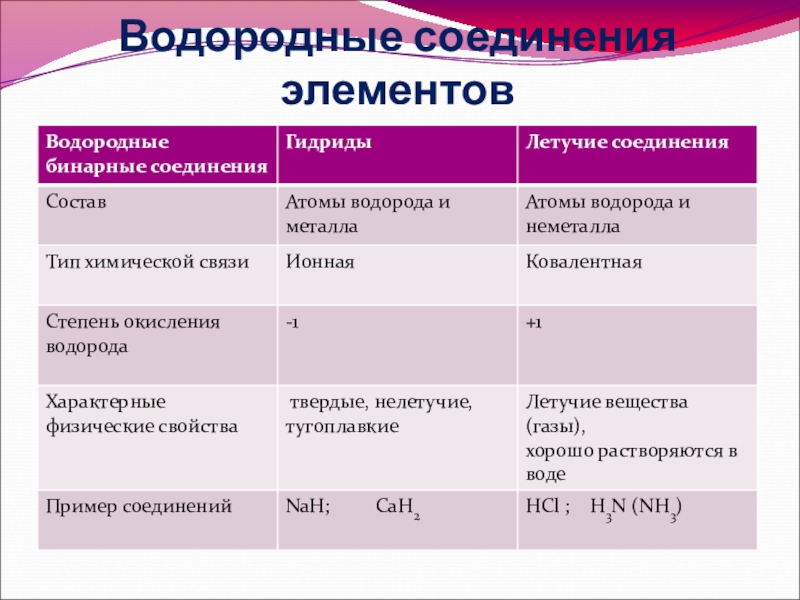
- 14. Водородные соединения элементов
- 15. Хлороводород HCl Свойства хлороводорода:Бесцветный газ;Тяжелее воздуха;На
- 16. Аммиак NH3Свойства аммиака:1. Бесцветный газ;2. В два
- 17. Задания: Задание 1. Назовите вещества, имеющие формулы:
- 18. Задание 3. Какие названия соответствуют
- 19. Домашнее задание
Слайд 2Важнейшие бинарные соединения
Оксиды
Водородные соединения
Оксиды металлов
Оксиды неметаллов
Гидриды
Летучие водородные соединения
Слайд 3 Оксиды – это сложные вещества, состоящие из двух химических элементов,
Важнейшие оксиды
Агрегатное состояние оксидов
Слайд 4Красный железняк Fe2O3 Оксид железа (III)
Синонимы: красный железняк, кровавик, черный..
Fe2O3,
Слайд 5МАГНИТНЫЙ ЖЕЛЕЗНЯК Fe2O4
Магнитный камень (магнитный железняк)
Магнетит, он же
Слайд 6
КРЕМНЕЗЁМ (КВАРЦЕВЫЙ ПЕСОК) SiO2 oксид кремния (IV)
Кварцевый песок - желтый
Кварцевый
Слайд 9Вода H2O оксид водорода
Особенности воды:
Имеет три агрегатных состояния – жидкость, лед,
Обладает большой теплоемкостью;
Является хорошим растворителем;
Составляет до 80% массы клетки и выполняет в ней важнейшие функции.
Слайд 12Углекислый газ СО2
оксид углерода (IV)
Образуется при:
При дыхании;
При гниении и
При сгорании топлива.
Минеральные воды – как источник углекислого газа.
Свойства углекислого газа
Бесцветные
Без запаха
В 1,5 раза тяжелее воздуха
Хорошо растворим в воде
Слайд 15Хлороводород HCl
Свойства хлороводорода:
Бесцветный газ;
Тяжелее воздуха;
На воздухе дымит;
Хорошо растворим
Слайд 16Аммиак NH3
Свойства аммиака:
1. Бесцветный газ;
2. В два раза легче воздуха;
3. Хорошо
н
н
N
Слайд 17Задания:
Задание 1.
Назовите вещества, имеющие формулы: CaO, Fe2O3, CO,
Задание 2.
2. Выберите формулы оксидов:
а) CuS б) P2 O 5
в) MgO г) CH 4
д) CO е) NH3
Почему вы отнесли их к оксидам? Дайте им названия.
Слайд 18Задание 3.
Какие названия соответствуют формуле СО2:
а) оксид углерода
б) карбид кислорода (II)
в) углекислый газ
г) оксид углерода (IV)
Задание 4 (задача).
Рассчитайте массовую долю кислорода в веществах FeO; Fe2O3. В каком из этих веществ содержится больше кислорода?