- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок -презентация ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ.ЦЕЛЕСООБРАЗНО ИСПОЛЬЗОВАТЬ НА УРОКАХ ХИМИИ В 9,11КЛАССАХ
Содержание
- 1. Урок -презентация ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ.ЦЕЛЕСООБРАЗНО ИСПОЛЬЗОВАТЬ НА УРОКАХ ХИМИИ В 9,11КЛАССАХ
- 2. По числу и составу исходных веществ и
- 3. ВЫБРАТЬ РЕАКЦИИ СОЕДИНЕНИЯ1) CaCO3= CaO+CO22) 2SO2+O2
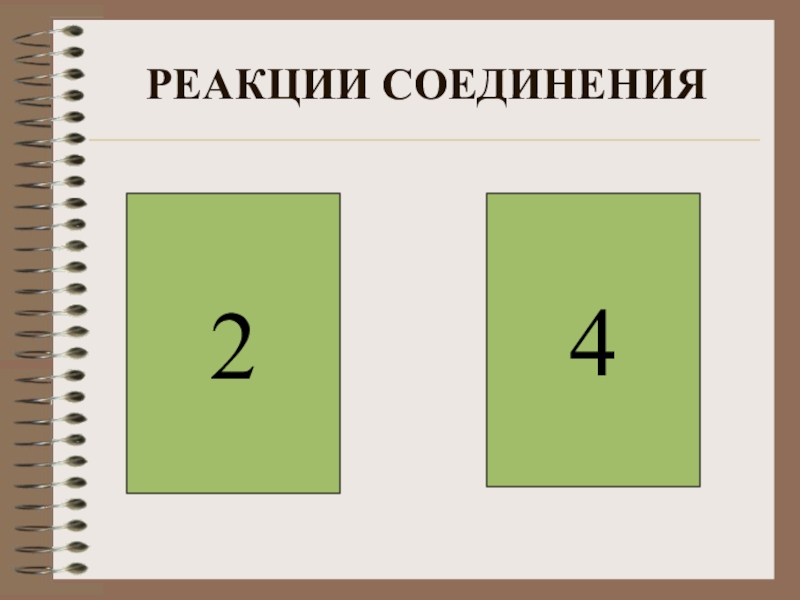
- 4. РЕАКЦИИ СОЕДИНЕНИЯ42
- 5. ВЫБЕРИТЕ РЕАКЦИИ РАЗЛОЖЕНИЯ
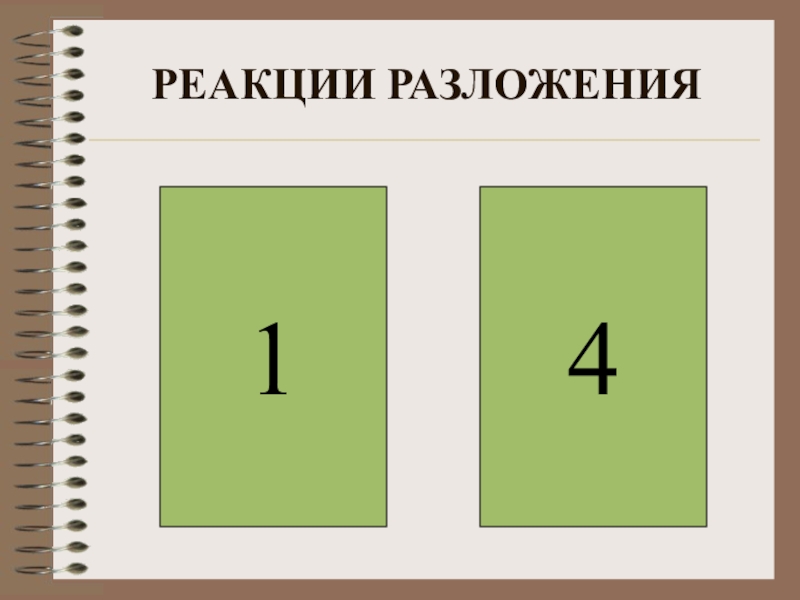
- 6. РЕАКЦИИ РАЗЛОЖЕНИЯ41
- 7. ВЫБЕРИТЕ РЕАКЦИИ ЗАМЕЩЕНИЯ1) H2 +Br2
- 8. РЕАКЦИИ ЗАМЕЩЕНИЯ34
- 9. ВЫБЕРИТЕ РЕАКЦИИ ОБМЕНА1) NaOH+HCl=NaCl+H2O2) 2Fe(OH)3 =Fe2O3+3H2O3) CaO+SO2 =CaSO34) Ba(NO3)2 +H2SO4 = BaSO4 + 2HNO3
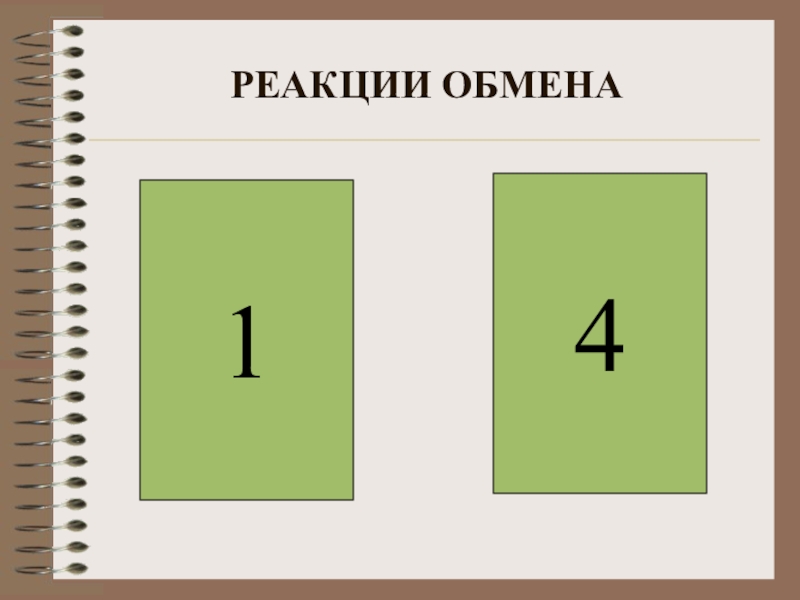
- 10. РЕАКЦИИ ОБМЕНА41
- 11. По тепловому эффекту 1. Экзотермические(+Q)
- 12. ВЫБЕРИТЕ ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ1) CaCO3 =CaO+CO2 –Q2) H2 + Br2 2HBr+Q3) FeO+H2 =Fe+H2O-Q4) NaOH+HCl=NaCl+H2O+Q
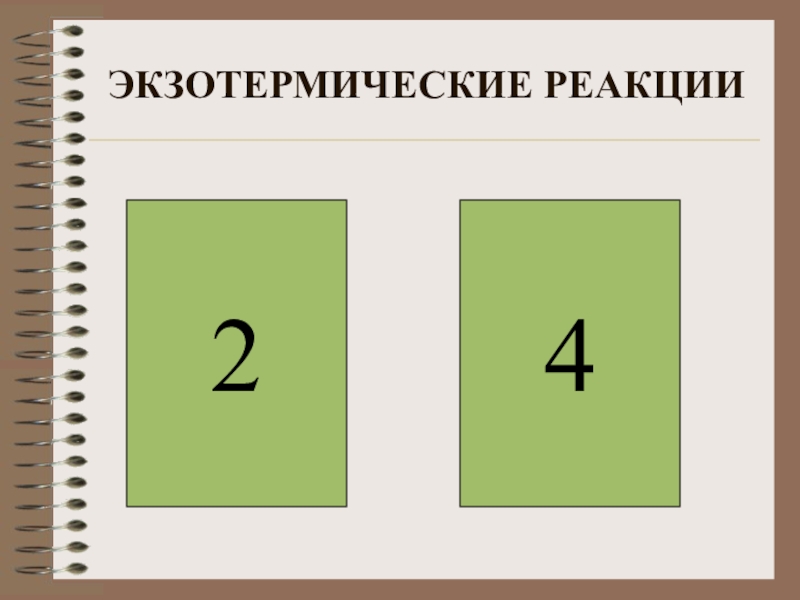
- 13. ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ24
- 14. ВЫБЕРИТЕ ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИИ1) S+O2 =SO2 +Q2) CaSO3
- 15. ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИИ23
- 16. Присутствие катализатора 1. Каталитические ( kat ) 2. Некаталитические (=)
- 17. ВЫБЕРИТЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ1) 2Al+3I2 =
- 18. КАТАЛИТИЧЕСКИЕ РЕАКЦИИ14
- 19. По изменению степени окисления 1. ОВР (СО меняется)2. неОВР (СО const)
- 20. ВЫБЕРИТЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНУЮ РЕАКЦИЮ1) BaO+2HCl=BaCl2 +H2O2) 2Ca+O2 = 2CaO3) CaCO3 = CaO+CO24) 2Al+3CuO=Al2O3 +3Cut
- 21. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ-РЕАКЦИИ24
- 22. По наличию поверхности раздела1. Гомогенные
- 23. ВЫБЕРИТЕ ГОМОГЕННУЮ РЕАКЦИЮ1) Zn+2HCl=ZnCl2 +H22)2CO + O2
- 24. ГОМОГЕННЫЕ РЕАКЦИИ23
- 25. ПО НАПРАВЛЕНИЮ ПРОТЕКАНИЯ РЕАКЦИИ 1.
- 26. ВЫБЕРИТЕ НЕОБРАТИМЫЕ РЕАКЦИИ1)N2+3H2 2NH32)NaCl+AgNO3=AgCl +HNO33)CaCO3+2HCl=CaCl2+CO2 +H2O4)2SO2+O2 2SO3
- 27. НЕОБРАТИМЫЕ РЕАКЦИИ23
- 28. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙХимические Реакции(классификация)По направлению протекания реакции1.
- 29. ПОДУМАЙ И НАПИШИ1 ВАРИАНТ1-А2-А3-Г4-Г5-А6 -соединения-каталитическаяОВРэкзотермическаягомогеннаяобратимая2 вариант1-Б2-А3-В4-Б5-В6 – соединения-некаталитическаяОВР эндотермическая гомогенная обратимая.
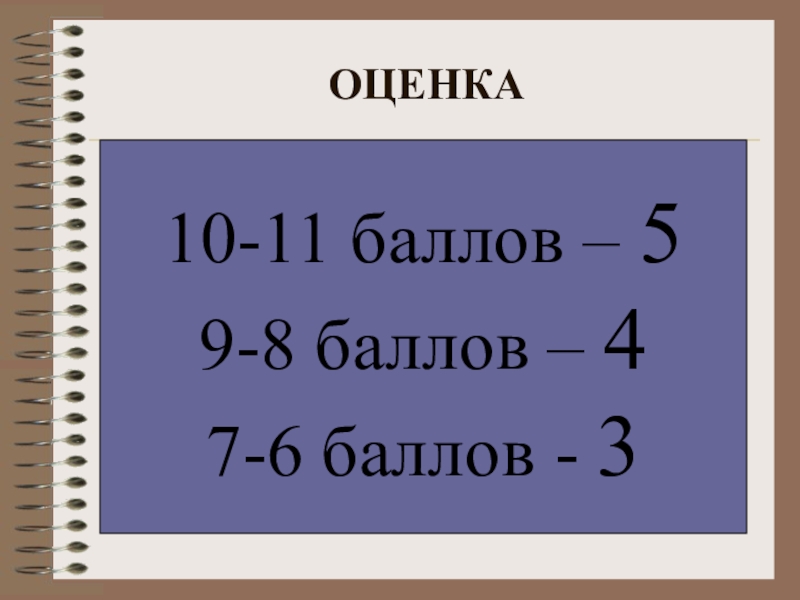
- 30. ОЦЕНКА10-11 баллов – 59-8 баллов – 47-6 баллов - 3
- 31. "ЗНАТЬ- ЗНАЧИТЬ ПОБЕДИТЬ" А.Н. НЕСМЕЯНОВ
Слайд 1«ОБРАТИМЫЕ И НЕОБРАТИМЫЕ РЕАКЦИИ. КЛАССИФИКАЦИИ ХИМИЧЕСКИХ РЕАКЦИЙ»
(обобщение и наблюдение позволяют установить
Учитель химии
МБОУ-СОШ № 19 г. Армавир
Тарасевич И.А.
Слайд 2По числу и составу исходных веществ и продуктов реакции
1 Соединения (А+В=С)
2
3 Замещения (С+АВ=СВ+А)
4 Обмена (АВ+СD=CD+AD)
Слайд 3ВЫБРАТЬ РЕАКЦИИ СОЕДИНЕНИЯ
1) CaCO3= CaO+CO2
2) 2SO2+O2
3) KCl+AgNO3=AgCl +HNO3
4) SO3+H2O=H2SO4
t
Слайд 5ВЫБЕРИТЕ РЕАКЦИИ РАЗЛОЖЕНИЯ
1) 2KMnO4 = K2MnO4+MnO2+O2
2) Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
3) CaO+CO2 = CaCO3
4) 2NH3 3H2 +N2
t
t
Слайд 7ВЫБЕРИТЕ РЕАКЦИИ ЗАМЕЩЕНИЯ
1) H2 +Br2 2HBr
2) CH4
3) Zn + 2HCl =ZnCl2 +H2
4) 2Al+3CuO = Al2O3 +3Cu
t
t
Слайд 9ВЫБЕРИТЕ РЕАКЦИИ ОБМЕНА
1) NaOH+HCl=NaCl+H2O
2) 2Fe(OH)3 =Fe2O3+3H2O
3) CaO+SO2 =CaSO3
4) Ba(NO3)2 +H2SO4 =
Слайд 11По тепловому эффекту 1. Экзотермические(+Q) (нейтрализации) 2. Эндотермические (-Q)
Слайд 12ВЫБЕРИТЕ ЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ
1) CaCO3 =CaO+CO2 –Q
2) H2 + Br2 2HBr+Q
3)
4) NaOH+HCl=NaCl+H2O+Q
Слайд 14ВЫБЕРИТЕ ЭНДОТЕРМИЧЕСКИЕ РЕАКЦИИИ
1) S+O2 =SO2 +Q
2) CaSO3 = CaO+SO2 –Q
3) 2KNO3
4) SO3 +H2O=H2SO4 +Q
t
t
Слайд 17ВЫБЕРИТЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
1) 2Al+3I2 = 2AlI3
2) KOH+HNO3 =KNO3 +H2O
3)
4) 2H2O2 = 2H2O+O2
H2O
MnO2
Слайд 20ВЫБЕРИТЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНУЮ РЕАКЦИЮ
1) BaO+2HCl=BaCl2 +H2O
2) 2Ca+O2 = 2CaO
3) CaCO3 = CaO+CO2
4)
t
Слайд 22
По наличию поверхности
раздела
1. Гомогенные (нет границ
Г –Г
2. Гетерогенные (есть граница
тв – г г-ж тв – ж тв – тв)
Слайд 23ВЫБЕРИТЕ ГОМОГЕННУЮ РЕАКЦИЮ
1) Zn+2HCl=ZnCl2 +H2
2)2CO + O2 = 2CO2
3) 2NaOH
4) 4Al+3O2=2Al2O3
ТВ
Ж
Ж
Г
Г
Г
Г
Ж
Ж
Ж
Ж
ТВ
Г
ТВ
Слайд 25ПО НАПРАВЛЕНИЮ ПРОТЕКАНИЯ РЕАКЦИИ
1. Обратимые (
(принцип Ле-Шателье)
2.Необратимые (=)
, , Н2О, М
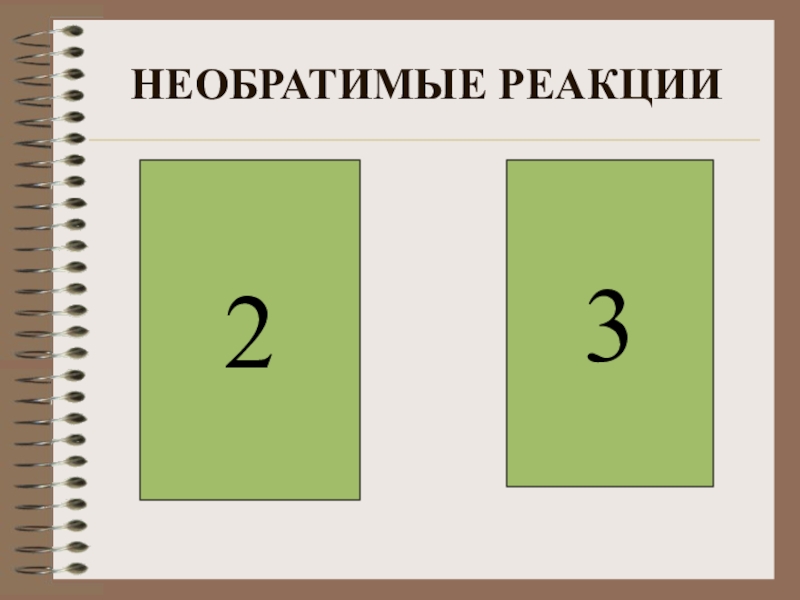
Слайд 26ВЫБЕРИТЕ НЕОБРАТИМЫЕ РЕАКЦИИ
1)N2+3H2 2NH3
2)NaCl+AgNO3=AgCl +HNO3
3)CaCO3+2HCl=CaCl2+CO2 +H2O
4)2SO2+O2
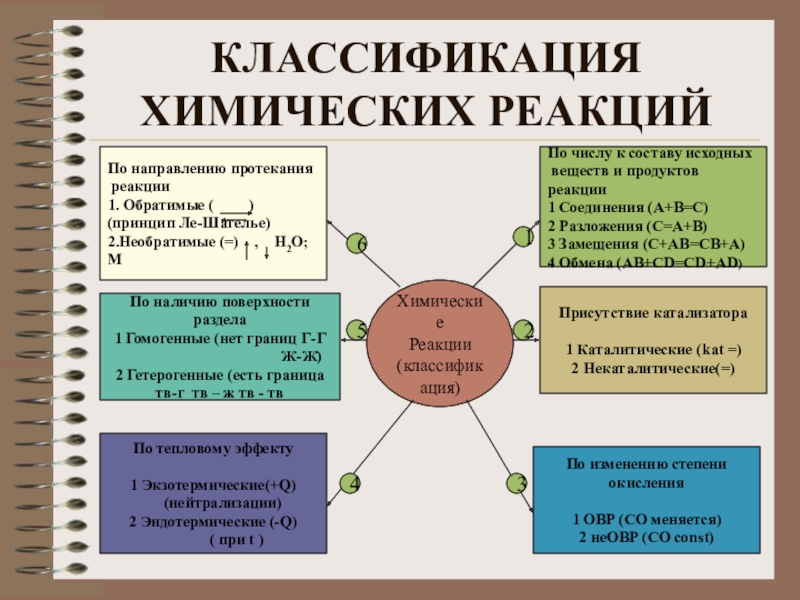
Слайд 28КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические
Реакции
(классификация)
По направлению протекания
реакции
1. Обратимые (
(принцип Ле-Шателье)
2.Необратимые (=) , Н2О; М
По наличию поверхности раздела
1 Гомогенные (нет границ Г-Г
Ж-Ж)
2 Гетерогенные (есть граница
тв-г тв – ж тв - тв
По тепловому эффекту
1 Экзотермические(+Q)
(нейтрализации)
2 Эндотермические (-Q)
( при t )
Присутствие катализатора
1 Каталитические (kat =)
2 Некаталитические(=)
По изменению степени
окисления
1 ОВР (СО меняется)
2 неОВР (СО const)
По числу к составу исходных
веществ и продуктов реакции
1 Соединения (А+В=С)
2 Разложения (С=А+В)
3 Замещения (С+АВ=СВ+А)
4 Обмена (АВ+СD=CD+AD)
1
5
2
6
3
4