- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок презентация по химии на тему: Углеводороды-Алканы.
Содержание
- 1. Урок презентация по химии на тему: Углеводороды-Алканы.
- 2. Углеводороды – органические соединения,
- 3. Метан – первый представитель предельных углеводородовСН4
- 4. АлканыМетан, этан, пропан, бутан являются первыми
- 5. Молекулярная форма метана:СН4 – электронная формула
- 6. Указанные выше формулы не отражают пространственного строения
- 7. Природный газДобычаХранениеПереработка
- 8. Номенклатура алкановГазыЖидкостиInternational Union of Pure and Applied Chemistry (ИЮПАК)
- 9. Номенклатура алканов Для определения названия
- 10. Физические свойства алканов Температуры
- 11. Химические свойства алканов1. ГорениеCH4 + 2O2
- 12. Химические свойства алканов3. Полное разложение4. Неполное
- 13. Химические свойства алканов6. Изомеризация
- 14. Получение алкановВ лаборатории метан получают при
- 15. Получение алкановЭтан и другие предельные углеводороды
- 16. Применение алканов1. Картриджи.2. Резина.3. Типографская краска.4. Растворители.5. Хладагенты (фреоны).6. Метанол.7. Ацетилен.
- 17. Применение алкановТопливо
- 18. Использованные источникиО.С.Габриелян. Химия. 10 класс. Базовый уровень.
Слайд 2
Углеводороды – органические соединения, состоящие исключительно из атомов
Поскольку углерод имеет четыре валентных электрона, а водород – один, простейший углеводород (природный газ) – метан (СН4)
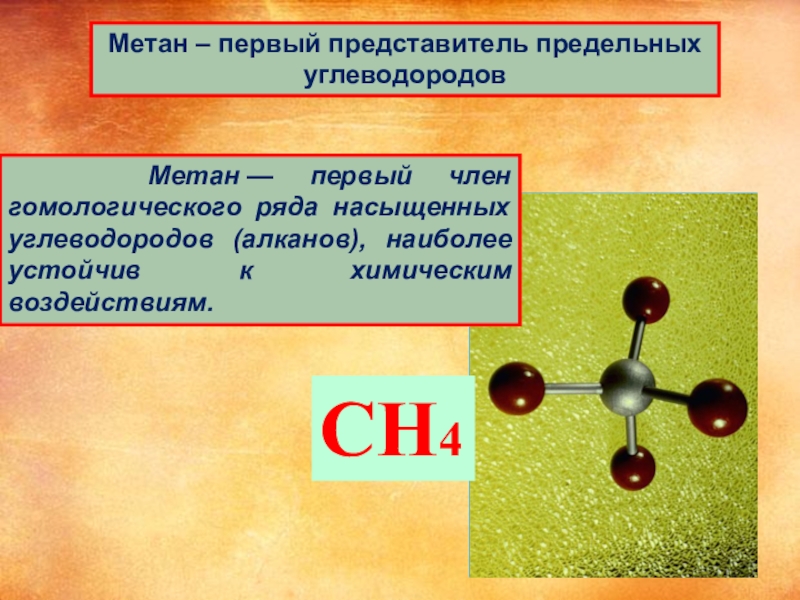
Слайд 3Метан – первый представитель предельных углеводородов
СН4
Метан — первый член гомологического
Слайд 4 Алканы
Метан, этан, пропан, бутан являются первыми четырьмя членами гомологического ряда
Алканы –
это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Состав их отражает общая формула
Cn + H2n + 2
Слайд 5Молекулярная форма метана:
СН4
– электронная формула (ковалентная полярная связь);
.
Но:
Строение молекулы метана
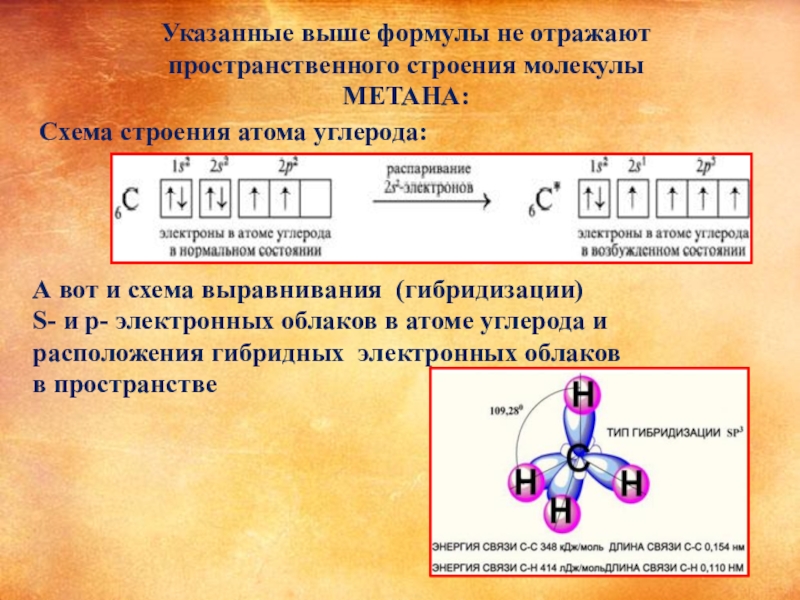
Слайд 6Указанные выше формулы не отражают пространственного строения молекулы
МЕТАНА:
Схема строения атома углерода:
А
S- и p- электронных облаков в атоме углерода и
расположения гибридных электронных облаков
в пространстве
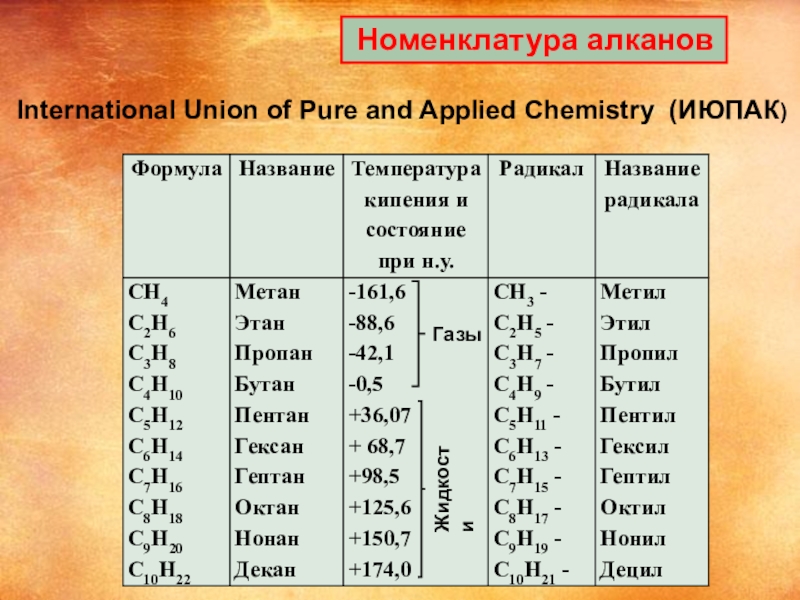
Слайд 9 Номенклатура алканов
Для определения названия углеводорода следует придерживаться следующего
1. Выбрать в формуле наиболее длинную углеродную цепь и символы атомов углерода в ней пронумеровать, начиная с того конца цепи, к которому ближе разветвление:
CH3
4 3 2│ 1
CH3 ─ CH2 ─ C ─ CH3
│
CH3
2. Назвать радикал (начиная с простейшего) и при помощи цифр указать их место в у нумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, номер повторяют дважды:
2,2-диметил…
3. Полное название данному углеводороду дать по числу атомов углерода в нумерованной цепи:
2,2-диметилбутан
Слайд 10 Физические свойства алканов
Температуры плавления и кипения увеличиваются с молекулярной
При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; начиная с C14H30 и далее — твёрдые вещества.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20°C н-пентан — жидкость, а неопентан — газ.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Слайд 11 Химические свойства алканов
1. Горение
CH4 + 2O2 → CO2 + 2H2O
2. Замещение (галогенирование) – реакции идут на свету
CH4 + Cl2 → CH3Cl + HCl
xлорметан
CH3Cl + Cl2 → CH2Cl2 + HCl
дихлорметан
CH2Cl2 + Cl2 → CHCl3 + HCl
трихлорметан
CHCl3 + Cl2 → CCl4 + HCl
тетрахлорметан
Слайд 12 Химические свойства алканов
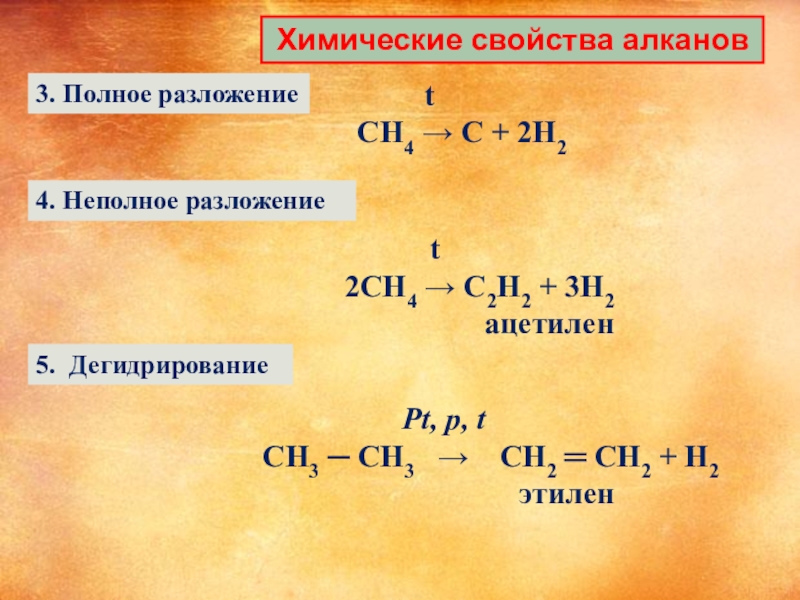
3. Полное разложение
4. Неполное разложение
CH4 → C + 2H2
t
2CH4 → C2H2 + 3H2
ацетилен
5. Дегидрирование
Pt, p, t
CH3 ─ CH3 → CH2 ═ CH2 + H2
этилен
Слайд 13 Химические свойства алканов
6. Изомеризация
Углеводороды нормального строения под
t,AlCl3
CH3─CH2─CH2─CH2─CH3 → CH3─CH─CH2─CH3
│
CH3
2-метилбутан
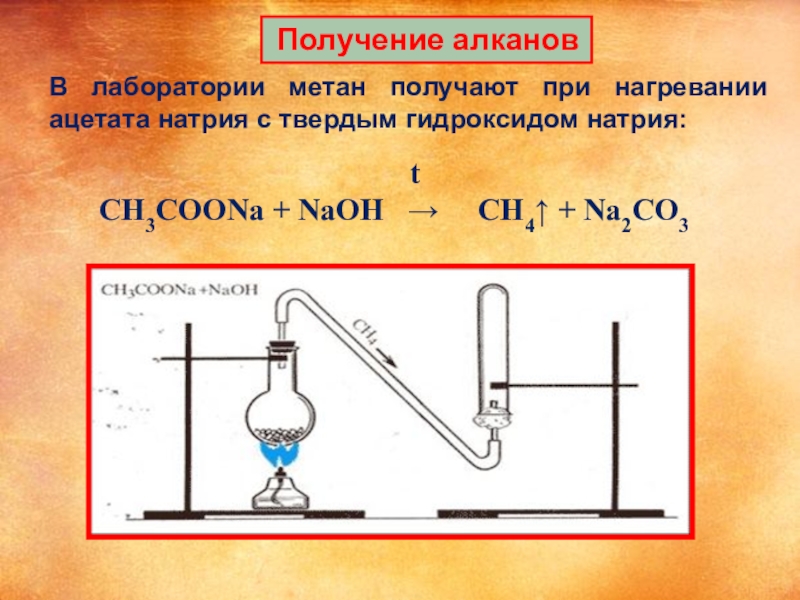
Слайд 14 Получение алканов
В лаборатории метан получают при нагревании ацетата натрия с
t
CH3COONa + NaOH → CH4↑ + Na2CO3
Слайд 15 Получение алканов
Этан и другие предельные углеводороды с более длинной углеродной
CH3 ─ I Na
+ → CH3 ─ CH3 + 2NaI
CH3 ─ I Na
иодометан этан
Реакция Вюрца
Слайд 16
Применение алканов
1. Картриджи.
2. Резина.
3. Типографская краска.
4. Растворители.
5. Хладагенты
6. Метанол.
7. Ацетилен.
Слайд 18
Использованные источники
О.С.Габриелян. Химия. 10 класс. Базовый уровень. М. Дрофа. 2013.
2.
Картинка «получение алканов» слайд 14:
http://dist-tutor.info/mod/book/view.php?id=28450&chapterid=1598
Картинка «применение алканов» слайд 16:
http http://www.alhimikov.net/organikbook/alcan_01.html