- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок - презентация по химии на тему Ковалентная связь (8 класс)
Содержание
- 1. Урок - презентация по химии на тему Ковалентная связь (8 класс)
- 2. Ковалентная связь
- 3. Какая из электронных формул относится к нейтральному
- 4. Какая из электронных формул относится к нейтральному
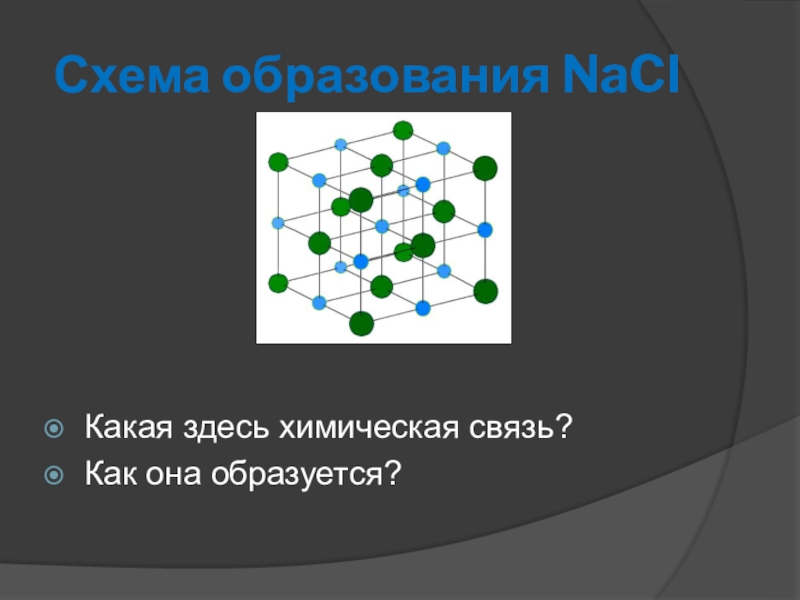
- 5. Схема образования NaClКакая здесь химическая связь?Как она образуется?
- 6. Схема образования N2Какая здесь химическая связь?Как она образуется?
- 7. Химическая связь – это такое взаимодействие атомов,
- 8. Вставьте в предложениеАтомы благородных газов не соединяются
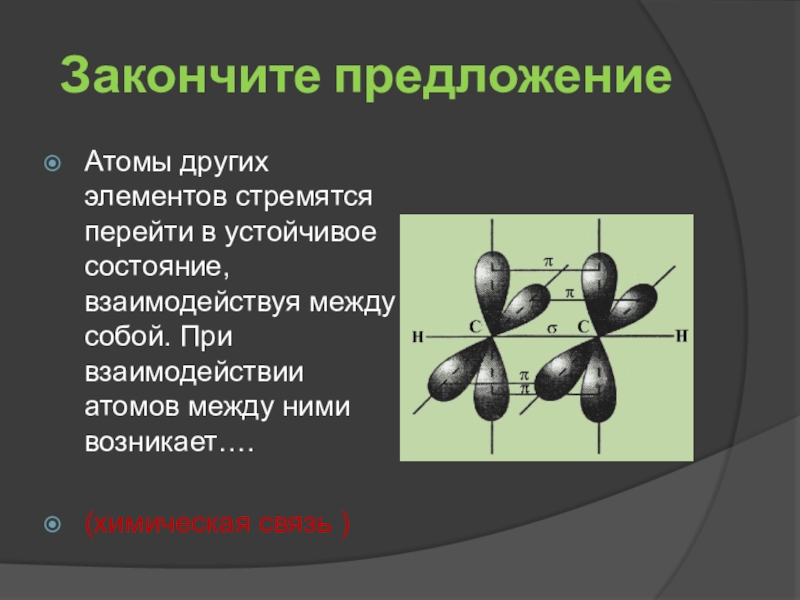
- 9. Закончите предложениеАтомы других элементов стремятся перейти в
- 10. Закончите предложениеВ образовании химической связи принимают участие
- 11. Вставьте в предложениеХимическая связь образуется за счет
- 12. Закончите предложение В слове «ковалентная« приставка «ко»
- 13. это связь, возникающая между атомами за счет
- 14. Гилберт Ньютон ЛьюисВ 1916 Льюис высказал идею,
- 15. Метод компаса (химические элементы главных подгрупп)
- 16. КНС образуют атомы одного и того же
- 17. КПС образуют атомы разных неметаллов (с разной
- 18. Схема образования молекул с ковалентной полярной связью(HF)
- 19. Посмотрим на ряд ЭО H
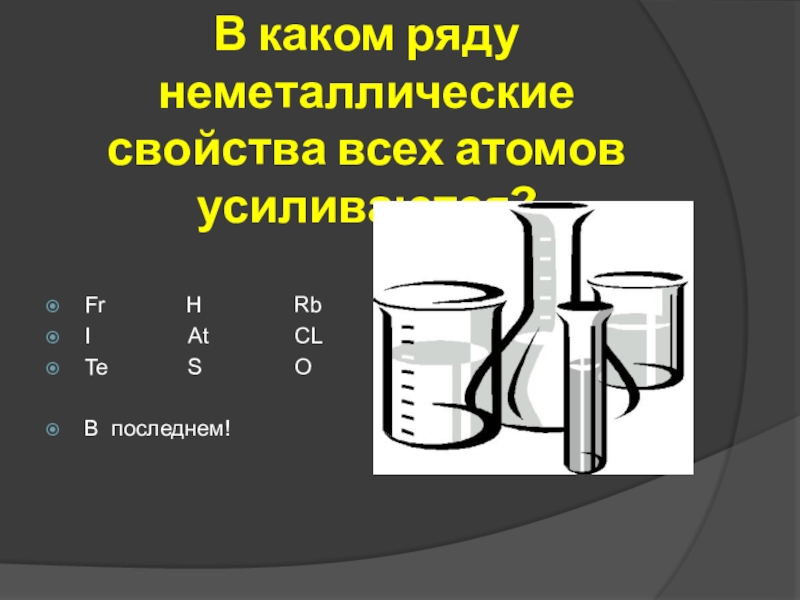
- 20. В каком ряду неметаллические свойства всех атомов
- 21. В каком ряду неметаллические свойства всех атомов
- 22. Назовите связь!1)Металл + Металл (Ме1 +Ме2)(металлическая связь)2)Неметалл
- 23. Закрепление материала!
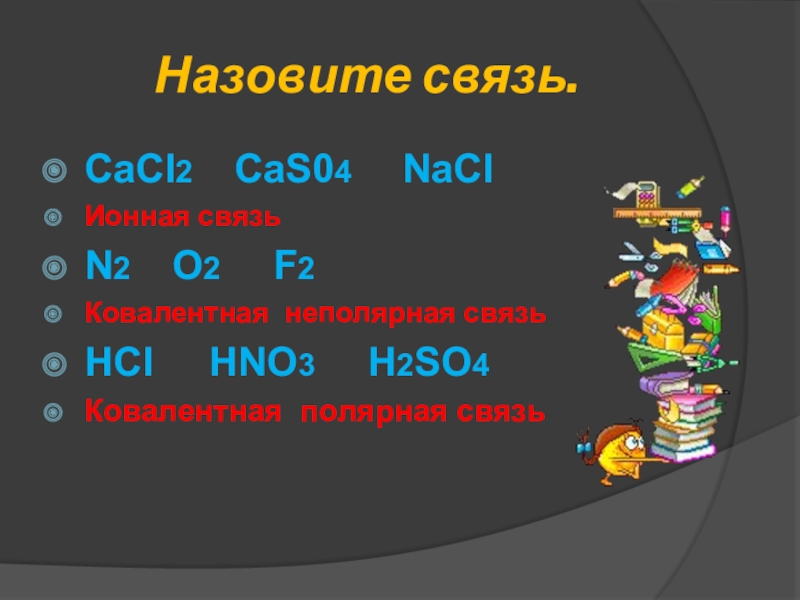
- 24. Назовите связь.CaCl2 CaS04 NaClИонная
- 25. Является катионом1) H+2)H-3)H4)H2
- 26. Является анионом1) H+2)H-3)H4)H2
- 27. Двойная ковалентная связь имеется в молекуле1) N22) H23) O24) Cl2
- 28. Ковалентная полярная связь имеется в соединении1) NaCl2)H23) HCl
- 29. CaCl2Cl2HBrNa2So4I2H2SO4
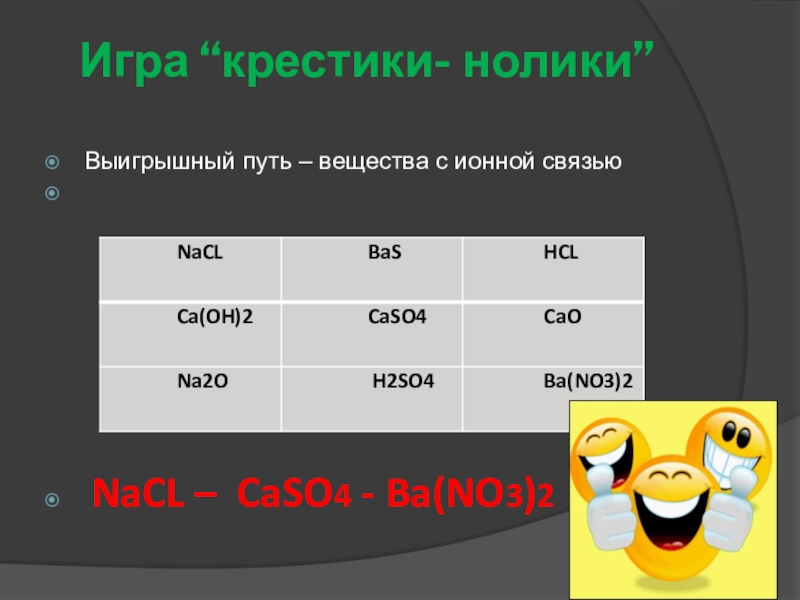
- 30. Игра “крестики- нолики” Выигрышный путь – вещества с ионной связью NaCL – CaSO4 - Ba(NO3)2
- 31. Игра “крестики- нолики” Выигрышный путь - вещества с ковалентной неполярной связью O2- N2- F2
- 32. Игра “крестики- нолики” Выигрышный путь –
- 33. Ответьте на вопрос! 1)В ряду элементов F
- 34. Ответьте на следующий вопрос!2) В ряду элементов
- 35. Какая химическая связь образуется между атомами элементов
- 36. Установите соответствие между
- 37. Молодцы!5
- 38. Домашнее заданиеУчебник параграф 11 упр. 1-4.Придумать свой тест
Слайд 1Урок- презентация
на тему
ковалентная полярная связь.
Учитель химии ГБОУ № 475
Данилишина Валентина Алексеевна
Слайд 3Какая из электронных формул относится к нейтральному атому Na, а какая
A) 1s2 2s2 2p6 3s1
или
Б)1s2 2s2 2p6
Слайд 4Какая из электронных формул относится к нейтральному атому CL, а какая
A)1s2 2s2 2p6 3s2 3p5
Или
Б) 1s2 2s2 2p6 3s2 3p6
Слайд 7
Химическая связь – это такое взаимодействие атомов, которое связывает их в
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Слайд 8Вставьте в предложение
Атомы благородных газов не соединяются друг с другом. Они
( завершенный )
Слайд 9Закончите предложение
Атомы других элементов стремятся перейти в устойчивое состояние, взаимодействуя между
(химическая связь )
Слайд 10Закончите предложение
В образовании химической связи принимают участие валентные электроны. Они расположены
(внешнем )
Слайд 11Вставьте в предложение
Химическая связь образуется за счет электронов внешнего энергетического уровня,
(ионной, ковалентной неполярной и ковалентной полярной)
Слайд 12Закончите предложение
В слове «ковалентная« приставка «ко» означает совместное участие,
( другими атомами )
Слайд 13это связь, возникающая между атомами за счет образования общих электронных пар.
По
Ковалентная связь-
Слайд 14Гилберт Ньютон Льюис
В 1916 Льюис высказал идею, что ковалентная химическая связь
Слайд 16 КНС образуют атомы одного и того же химического элемента.
Механизм образования связи.
Примеры образования КНС:
H . + . H H : H H-H H2
.. .. .. ..
: F . + . F : : F : F : F-F F2
.. .. .. ..
. .
: O : + : O : : O :: O : O=O O2
. . .. ..
Ковалентная неполярная связь
Слайд 17 КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Электроотрицательность (ЭО)- это
Самый электроотрицательный элемент – F.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Примеры образования связи.
.. .. + -
H . + . Cl : H : Cl : H Cl + - Диполь
.. ..
Ковалентная полярная связь
Слайд 19Посмотрим на ряд ЭО
H As I Si
Усиление электроотрицательности --
Слайд 20В каком ряду неметаллические свойства всех атомов увеличиваются ?
Li
Si P CL
Br Se As
В среднем!
Слайд 21В каком ряду неметаллические свойства всех атомов усиливаются?
Fr
I At CL
Te S O
В последнем!
Слайд 22 Назовите связь!
1)Металл + Металл (Ме1 +Ме2)
(металлическая связь)
2)Неметалл + Неметалл (одинаковые)
(ковалентная неполярная
3)Металл + Неметалл (Ме+ НеМе)
(Ионная связь)
4)Неметалл + Неметалл (разные) (НеМе1+НеМе2)
(ковалентная полярная связь)
Слайд 24Назовите связь.
CaCl2 CaS04 NaCl
Ионная связь
N2 O2
Ковалентная неполярная связь
HCl HNO3 H2SO4
Ковалентная полярная связь
Слайд 31Игра “крестики- нолики”
Выигрышный путь - вещества с ковалентной неполярной связью
O2-
Слайд 32Игра “крестики- нолики”
Выигрышный путь – вещества с ковалентной полярной связью
HCL - H2SO3 - H3PO4
Слайд 33Ответьте на вопрос!
1)В ряду элементов
F CL
с увеличением порядкового номера хим. элемента электроотрицательность
А) увеличивается
Б) уменьшается
В) не изменяется
Г) изменяется периодически
Слайд 34Ответьте на следующий вопрос!
2) В ряду элементов
C N
с увеличением порядкового номера хим. элемента электроотрицательность
А) увеличивается
Б) уменьшается
В) не изменяется
Г) изменяется периодически
Слайд 35Какая химическая связь образуется между атомами элементов с порядковыми номерами 9
1) Ионная.
2) Металлическая.
3) Ковалентная полярная.
4) Ковалентная неполярная.
Ответ 1) Ионная.
Слайд 36 Установите соответствие между формулой вещества и видом
Формула вещества Вид химической
связи