- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок-презентация Химические реакции. Составление уравнений химических реакций 8 класс
Содержание
- 1. Урок-презентация Химические реакции. Составление уравнений химических реакций 8 класс
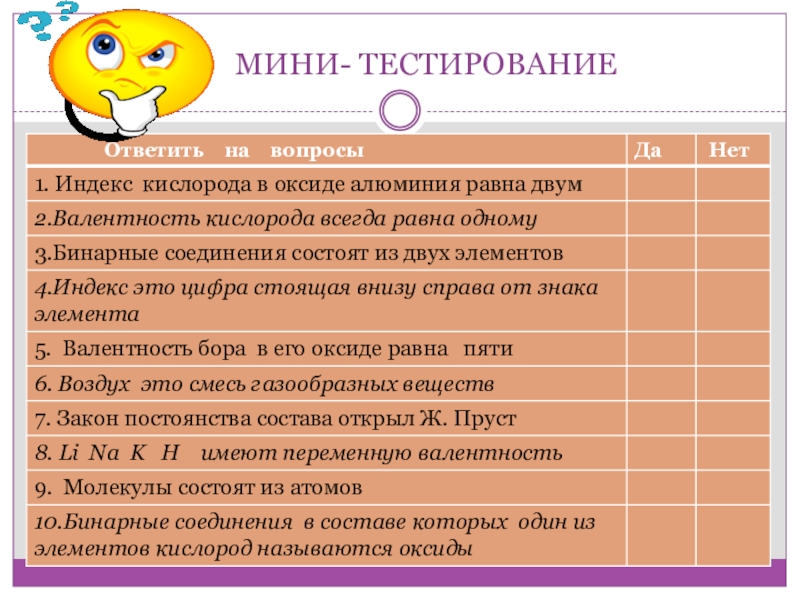
- 2. Проверим домашнеезадание
- 3. МИНИ- ТЕСТИРОВАНИЕ
- 4. Можно ли химические реакции изобразить на доске?Если
- 5. « Составь
- 6. Составьте постер пошаговых действй в написании уравнений реакций «Лестница успеха»12543
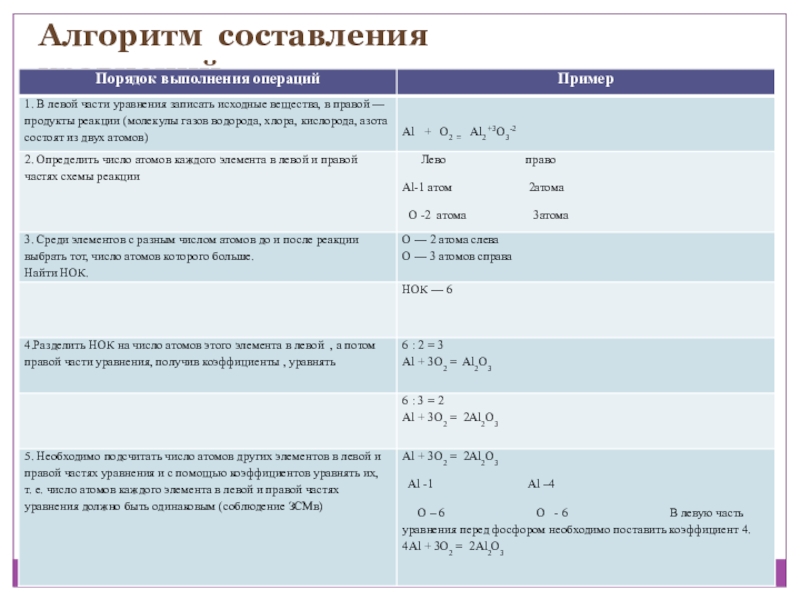
- 7. Алгоритм составления уравнений
- 8. Трибунская Елена Жановна учитель химии МОУ СОШ№7
- 9. Трибунская Елена Жановна учитель химии МОУ СОШ№7
- 10. Выберите записи химических уравнений1.Ватиантг) а) H2
- 11. Эталон ответа1.Ватиантг) а) H2 + Сl2
- 12. Открытие закона сохранения
- 13. Рефлексия «Мое место на лестнице успеха »
- 14. Домашнее задание: § 15 стр.37-38 №6,7. Опережающее задание «История открытия закона сохранения массы веществ.»
Слайд 1
«
«Химические реакции.
Составление уравнений химических реакций».
Урок химии 8 класс
Раджабова Сона Вахриевна
Слайд 4Можно ли химические реакции изобразить на доске?Если да то как ?
И
Разгораясь жарко,
Освещая тьму ночную
Далеко и ярко.
И.Суриков
Слайд 5«
Составь -те 3 вопроса по новой теме
Проведите диалог в парах
Выделите и задайте три вопроса другой группе (прием Жигсо)
Прочитайте текст § 15 стр 37 выполните задание:
«Единственный путь, ведущий к знаниям, -
это деятельность»
Б. Шоу
Слайд 8Трибунская Елена Жановна учитель химии МОУ СОШ№7 г. Балаково
Расставьте коэффициенты в
а) K + N2 = K3N;
б) Zn + H2SO4 = Zn SO4 + H2;
в) Na2SO4 + BaCl2 = BaSO4 + NaCl;
г) KClO3 = KCl + O2
Слайд 9Трибунская Елена Жановна учитель химии МОУ СОШ№7 г. Балаково
Эталон
а) 6K + N2 = 2K3N
б) Zn + H2SO4 = ZnSO4 + H2
в) Na2SO4 + BaCl2=BaSO4 + 2NaCl
г) 2KClO3 = 2KCl + 3O2
Слайд 10
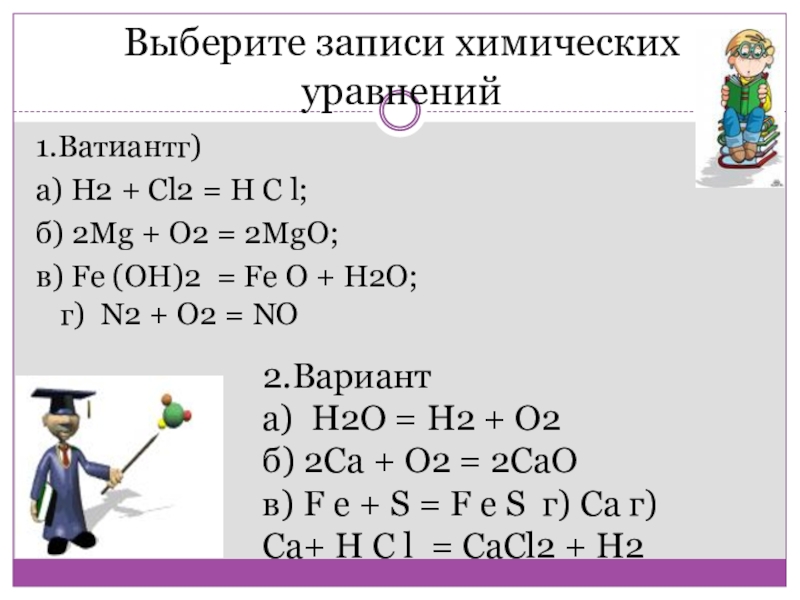
Выберите записи химических уравнений
1.Ватиантг)
а) H2 + Сl2 = Н
б) 2Mg + O2 = 2MgО;
в) Fe (ОН)2 = Fe О + H2O; г) N2 + О2 = NO
2.Вариант
а) Н2О = Н2 + О2
б) 2Са + О2 = 2СаO
в) F е + S = F е S г) Ca г)Са+ Н С l = CaCl2 + H2
Слайд 11
Эталон ответа
1.Ватиантг)
а) H2 + Сl2 = Н С l;
б) 2Mg + O2 = 2MgО; - ур-ние
в) Fe (ОН)2 = Fe О + H2O; - ур-ние г) N2 + О2 = NO -схема
2.Вариант
а) Н2О = Н2 + О2 -схема
б) 2Са + О2 = 2СаO -ур-ние
в) F е + S = F е S -ур-ние г)Са+ Н С l = CaCl2 + H2 схема
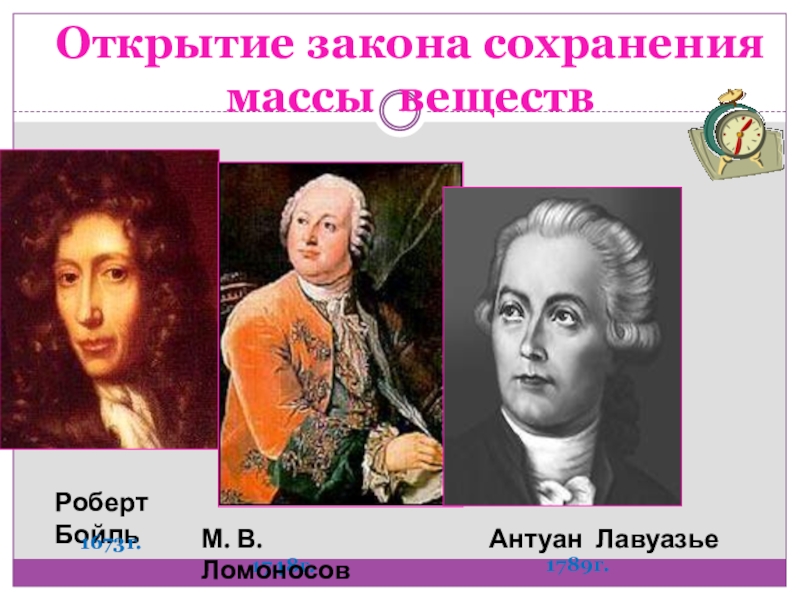
Слайд 12 Открытие закона сохранения
массы веществ
Роберт Бойль
1673г.
1748г.
М. В. Ломоносов
Антуан Лавуазье