- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок по томе Азотная кислота
Содержание
- 1. Урок по томе Азотная кислота
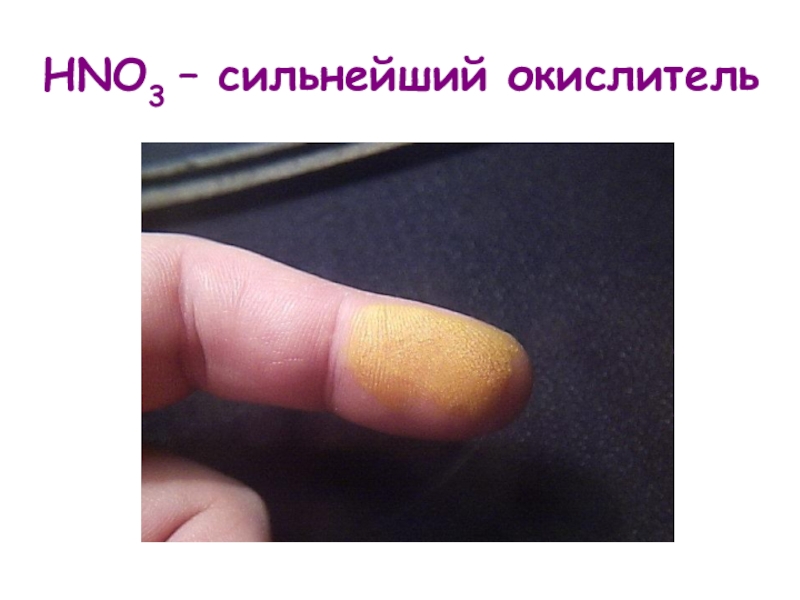
- 2. HNO3 – сильнейший окислитель
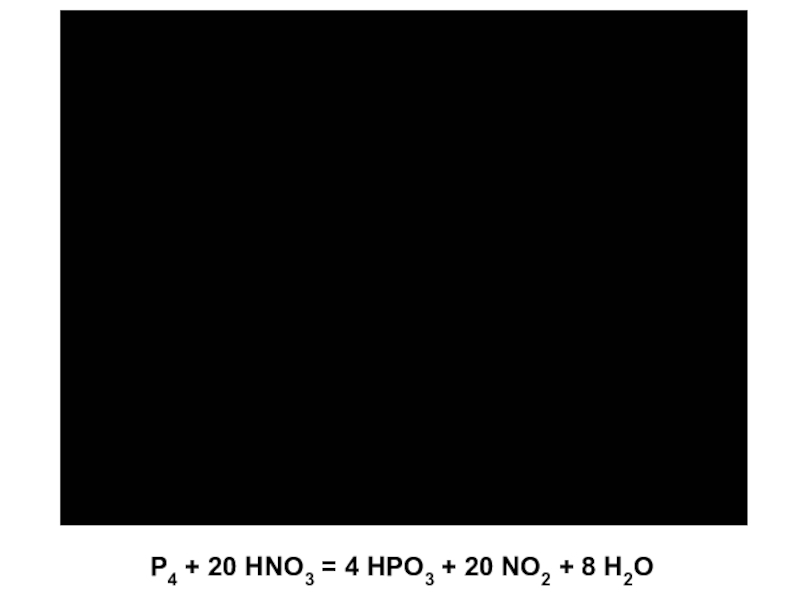
- 3. Р4 + 20 НNО3 = 4 НРО3 + 20 NО2 + 8 Н2О
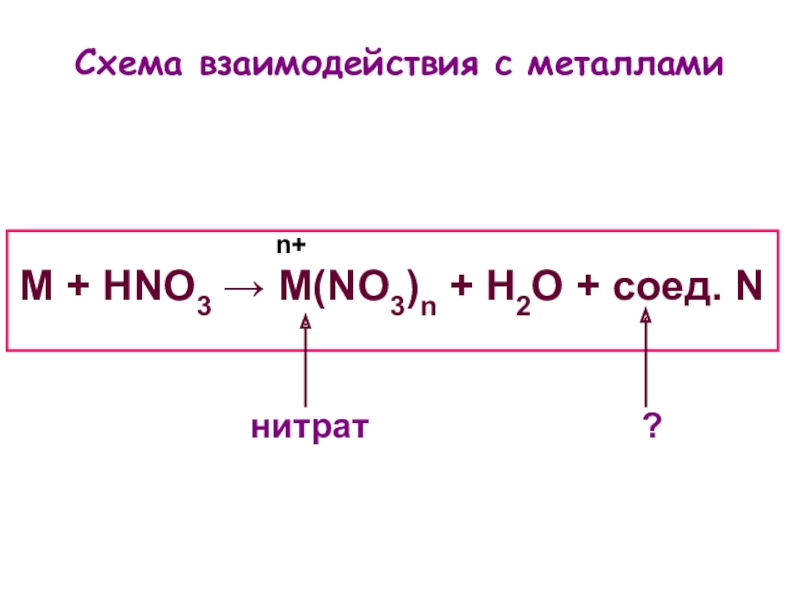
- 4. Взаимодействие с металлами
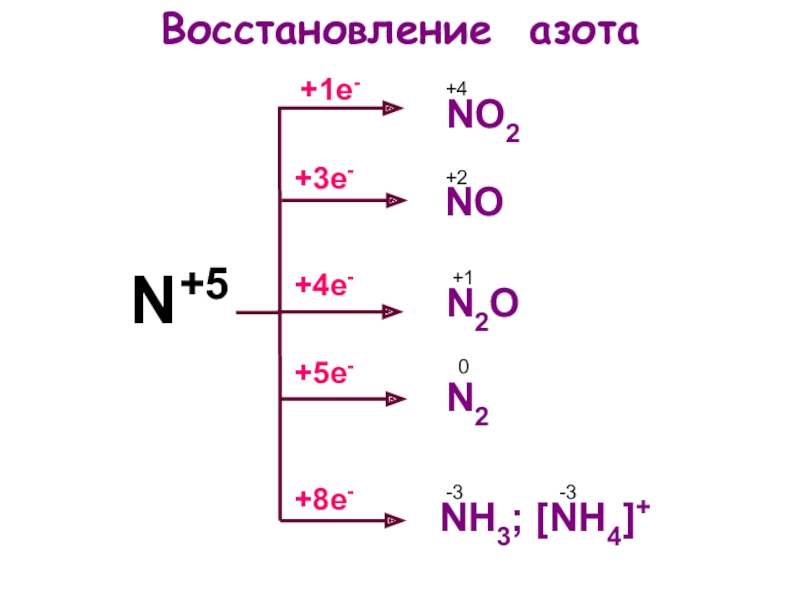
- 5. N+5Восстановление азота+5е-+1е-+8е-+4е-+3е-
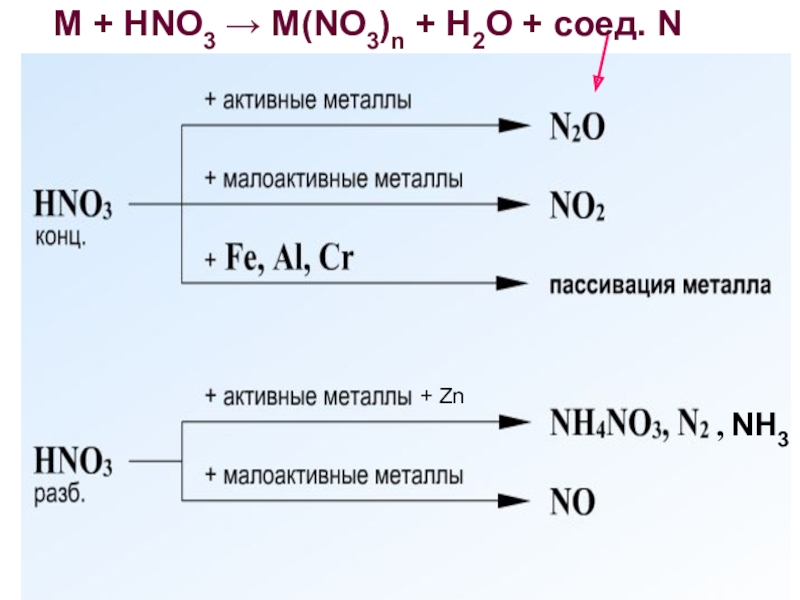
- 6. M + HNO3 → M(NO3)n + H2O + соед. NСхема взаимодействия с металламиn+
- 7. + Zn, NH3 M + HNO3 → M(NO3)n + H2O + соед. N
- 8. Домашнее заданиеПараграф 27 + схемы в тетради;№
HNO3 – сильнейший окислитель
Слайд 8Домашнее задание
Параграф 27 + схемы в тетради;
№ 2 (гидроксид алюминия, оксид
алюминия, сульфит калия);
4 (хром)(п)
№ 6 – дополнительное задание
4 (хром)(п)
№ 6 – дополнительное задание