- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
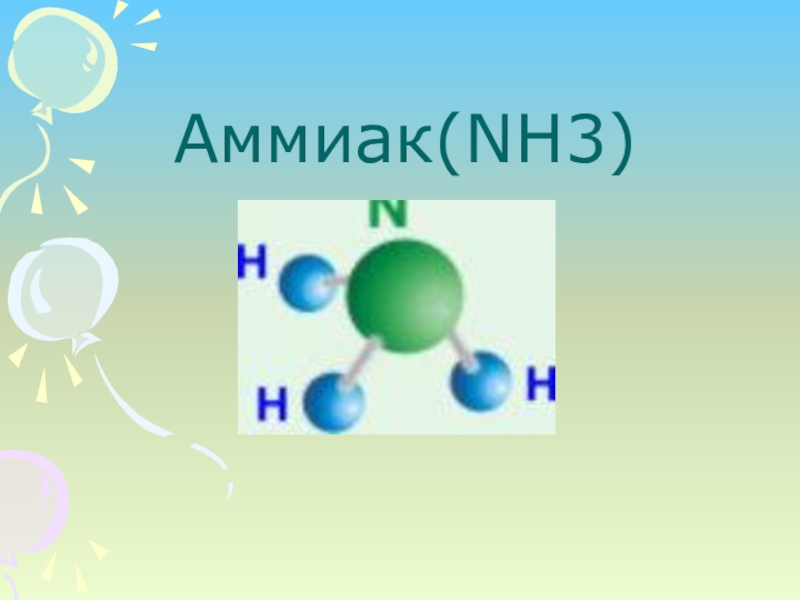
Презентация, доклад на тему Урок по теме: Аммиак
Содержание
- 1. Урок по теме: Аммиак
- 2. АММИАК – бесцветный газ с резким запахом,
- 3. Резкий запах аммиака известен человеку с доисторических
- 4. Молекула аммиака имеет форму тригональной пирамиды с
- 5. Химические свойства1.Взаимодействует с кислотами: NH3 +
- 6. Биологическая рольАммиак является конечным продуктом азотистого обмена
- 7. Применения В основном используется для производства
- 8. Получение аммиакаПромышленный способ получения аммиака основан на
- 9. В промышленных условиях использован принцип циркуляции -
- 10. Гидроксид аммонияСлабое основание, образующееся при взаимодействии аммиака
- 11. При отравлении аммиаком нужно принять следующие меры:
- 12. При утечке и разливе: устранить источники открытого
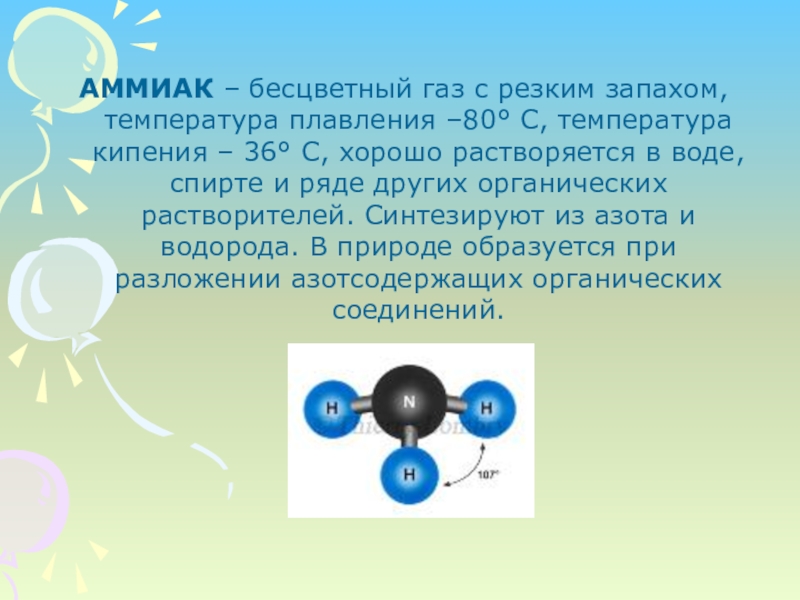
АММИАК – бесцветный газ с резким запахом, температура плавления –80° С, температура кипения – 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении
Слайд 2АММИАК – бесцветный газ с резким запахом, температура плавления –80° С,
температура кипения – 36° С, хорошо растворяется в воде, спирте и ряде других органических растворителей. Синтезируют из азота и водорода. В природе образуется при разложении азотсодержащих органических соединений.
Слайд 3Резкий запах аммиака известен человеку с доисторических времен, так как этот
газ образуется в значительных количествах при гниении, разложении и сухой перегонке содержащих азот органических соединений, например мочевины или белков. Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака. Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе и в дождевой воде, поскольку он непрерывно образуется при разложении животных и растительных белков.
Слайд 4Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Три не спаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N-H), четвёртая пара внешних электронов является не поделённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4. Благодаря тому, что не связывающее двух электронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
Слайд 5Химические свойства
1.Взаимодействует с кислотами:
NH3 + HNO3 → NH4NO3
2.
Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
3. С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
4. При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
3. С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
4. При 1000°C аммиак реагирует с углем, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
CH4 + NH3 + 1,5O2 → HCN + 3H2O
Слайд 6Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и
животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину).
Слайд 7Применения
В основном используется для производства азотных удобрений (нитрат и
сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В холодильной технике используется в качестве холодильного агента (R717)
Слайд 8Получение аммиака
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и
азота:
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химический основы метода). Реакция происходит с выделением тепла и понижением объёма. процесс получения аммиака проводят при следующих условиях: температура 500°C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30%. В промышленных условиях использован принцип циркуляции - аммиак удаляют охлаждением.
N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химический основы метода). Реакция происходит с выделением тепла и понижением объёма. процесс получения аммиака проводят при следующих условиях: температура 500°C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30%. В промышленных условиях использован принцип циркуляции - аммиак удаляют охлаждением.
Слайд 9В промышленных условиях использован принцип циркуляции - аммиак удаляют охлаждением,а не
прореагировавшие азот и водород возвращают в колонну синтеза. Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Для осушения аммиака его пропускают через смесь извести с едким натром.
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
Для осушения аммиака его пропускают через смесь извести с едким натром.
Слайд 10Гидроксид аммония
Слабое основание, образующееся при взаимодействии аммиака с водой:
NH3 + H2O
↔ NH4OH.
Реакция образования гидроксида аммония обратима, поэтому в водных растворах гидроксид аммония находится в равновесии с аммиаком, обусловливающим резкий запах таких растворов. Водные растворы аммиака, в которых он существует преимущественно в форме гидроксида аммония, носят название аммиачная вода
Реакция образования гидроксида аммония обратима, поэтому в водных растворах гидроксид аммония находится в равновесии с аммиаком, обусловливающим резкий запах таких растворов. Водные растворы аммиака, в которых он существует преимущественно в форме гидроксида аммония, носят название аммиачная вода
Слайд 11При отравлении аммиаком нужно принять следующие меры:
промыть глаза и лицо
водой, надеть противогаз или ватно-марлевую повязку, смоченную 5% раствором лимонной кислоты, открытые участки кожи обильно промыть водой, немедленно покинуть очаг заражения.
удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
удалить посторонних. Держаться с наветренной стороны.
Изолировать опасную зону и не допускать посторонних. В зону аварии входить только в полной защитной одежде. Соблюдать меры пожарной безопасности, не курить.
Слайд 12При утечке и разливе: устранить источники открытого огня. Устранить течь. Для
осаждения газов использовать распыленную воду. Оповестить об опасности отравления местные органы власти. Эвакуировать людей из зоны, подвергшейся опасности заражения ядовитым газом. Не допускать попадания вещества в водоемы, тоннели, подвалы, канализацию. В случае загрязнения воды сообщить СЭС.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.
При пожаре: убрать из зоны пожара, если это не представляет опасности, и дать возможность догореть. Не приближаться к горящим емкостям. Охлаждать емкости водой с максимального расстояния. Тушить распыленной водой, воздушно-механической пеной с максимального расстояния.