- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок на тему Основные положения теории электролитической диссоциации
Содержание
- 1. Урок на тему Основные положения теории электролитической диссоциации
- 2. Цели урокаСформулировать основные положения теории электролитической диссоциацииОбобщить сведения об ионах и их классификациях
- 3. Проверка домашнего заданияЧто такое электролиты и неэлектролиты?
- 4. 1 положениеВсе вещества по их способности проводить
- 5. 2 положениеПри растворении в воде электролиты диссоциируют
- 6. Чем отличается металлический натрий от иона натрия?Атом
- 7. 3 положениеПричиной диссоциации электролита является его взаимодействие
- 8. Слайд 8
- 9. 4 положениеПод действием электрического тока положительные ионы
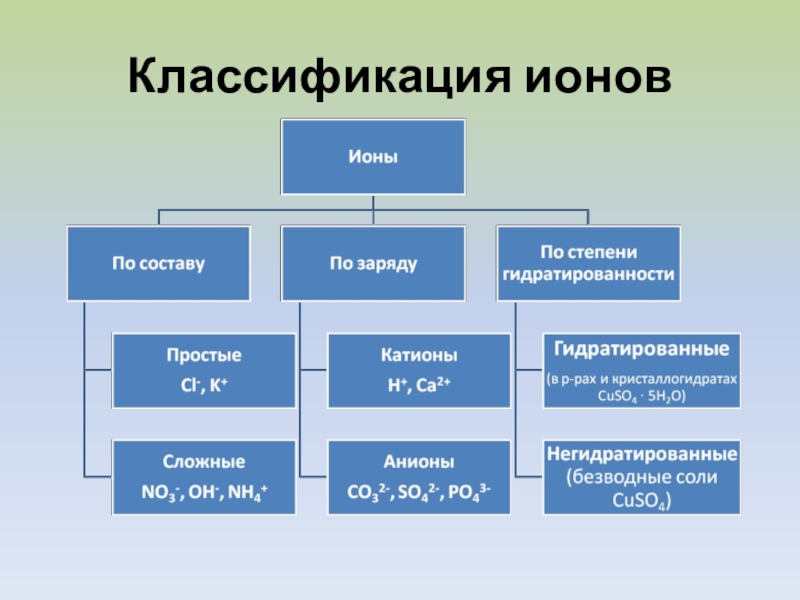
- 10. Классификация ионов
- 11. 5 положениеРазные электролиты по-разному диссоциируют на ионы
- 12. 6 положениеХимические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации
- 13. По характеру образующихся ионов различают 3 типа электролитов
- 14. Многоосновные кислоты диссоциируют ступенчатоН3РО4
- 15. Многокислотные основания диссоциируют ступенчатоCa(ОН)2
- 16. Диссоциация солейНезависимо от числа катионов и анионов
- 17. Общие свойства кислотКислый вкусИзменение окраски индикатора и др. обусловлены наличием катионов водорода
- 18. Общие свойства оснований (щелочей)Мылкость на ощупьИзменение окраски индикатораГигроскопичностьЕдкость и др. обусловлены наличием ионов ОН- - гидроксид-ионов
- 19. Свойства солейОпределяются индивидуальноЗависят от катиона металла и
- 20. Напишите уравнения диссоциации для веществАзотная кислотаСероводородная кислотаКремниевая
- 21. Домашнее заданиеПараграф 36Выучить положения ТЭДУпражнения 1 – 6 (с. 202 - 203)
- 22. Литература О.С.Габриелян. Учебник химии 8 класс. М.,
Цели урокаСформулировать основные положения теории электролитической диссоциацииОбобщить сведения об ионах и их классификациях
Слайд 2Цели урока
Сформулировать основные положения теории электролитической диссоциации
Обобщить сведения об ионах и
их классификациях
Слайд 3Проверка домашнего задания
Что такое электролиты и неэлектролиты? Приведите примеры.
Что такое электролитическая
диссоциация?
Кто автор теории электролитической диссоциации?
Как происходит диссоциация у веществ с ионной и ковалентной сильнополярной связью?
Чем отличаются сильные электролиты от слабых?
Что такое степень диссоциации? Какие значения она принимает?
Какая степень диссоциации будет у вещества, если из 100 молекул на ионы диссоциировало 20 молекул? К какому типу электролита будет относиться это вещество?
От чего зависит степень диссоциации?
Кто автор теории электролитической диссоциации?
Как происходит диссоциация у веществ с ионной и ковалентной сильнополярной связью?
Чем отличаются сильные электролиты от слабых?
Что такое степень диссоциации? Какие значения она принимает?
Какая степень диссоциации будет у вещества, если из 100 молекул на ионы диссоциировало 20 молекул? К какому типу электролита будет относиться это вещество?
От чего зависит степень диссоциации?
Слайд 41 положение
Все вещества по их способности проводить электрический ток в растворах
делятся на электролиты и неэлектролиты
К электролитам относятся все растворимые соли, кислоты, основания (щелочи)
К неэлектролитам относятся все нерастворимые соли, основания, кислоты, простые вещества, оксиды и органические вещества
При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы
К электролитам относятся все растворимые соли, кислоты, основания (щелочи)
К неэлектролитам относятся все нерастворимые соли, основания, кислоты, простые вещества, оксиды и органические вещества
При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы
Слайд 52 положение
При растворении в воде электролиты диссоциируют (распадаются) на положительные и
отрицательные ионы
Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких элементов в результате отдачи или присоединения электронов
В переводе с греческого «ион» - «странствующий»
Ионы – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких элементов в результате отдачи или присоединения электронов
В переводе с греческого «ион» - «странствующий»
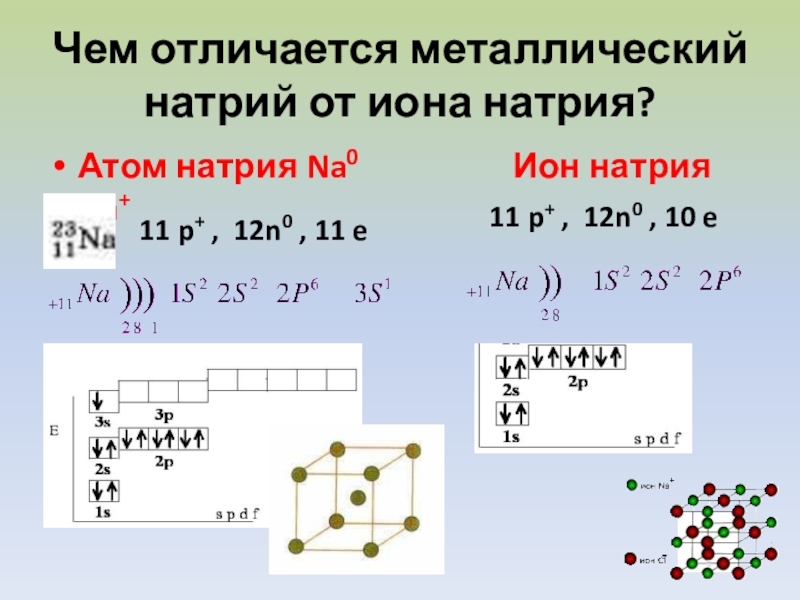
Слайд 6Чем отличается металлический натрий от иона натрия?
Атом натрия Na0
Ион натрия Na+
11 p+ , 12n0 , 10 e
11 p+ , 12n0 , 11 e
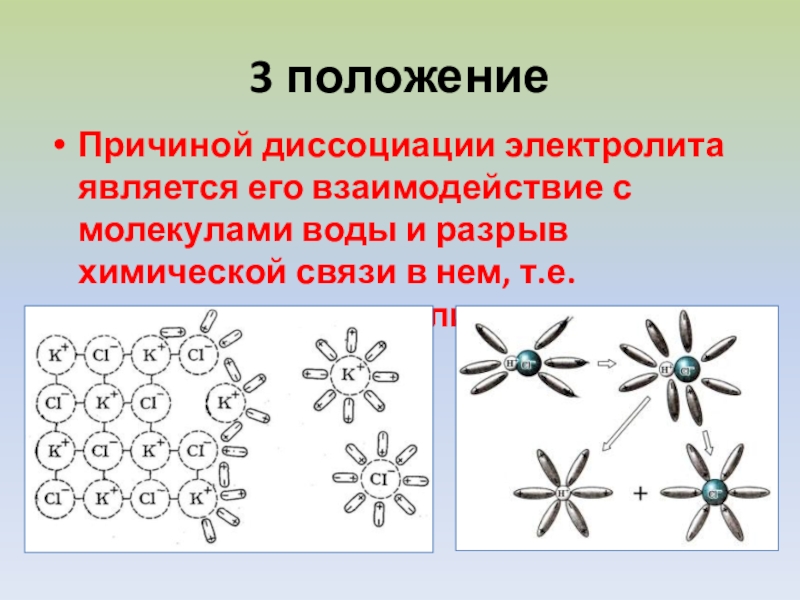
Слайд 73 положение
Причиной диссоциации электролита является его взаимодействие с молекулами воды и
разрыв химической связи в нем, т.е. гидратация электролита
Слайд 94 положение
Под действием электрического тока положительные ионы движутся к катоду и
называются катионами, а отрицательные – к аноду и называются анионами
Слайд 115 положение
Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на:
А)
сильные (соли, щелочи, некоторые кислоты), у которых α→1
Б) слабые (гидрат аммиака, некоторые кислоты), у которых α→0
Электролитическая диссоциация – процесс обратимый для слабых электролитов
HNO2 ↔ H+ + NO2-
Б) слабые (гидрат аммиака, некоторые кислоты), у которых α→0
Электролитическая диссоциация – процесс обратимый для слабых электролитов
HNO2 ↔ H+ + NO2-
Слайд 126 положение
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они
образуют при диссоциации
Слайд 14Многоосновные кислоты диссоциируют ступенчато
Н3РО4 Н+ +
Н2РО42-(первая ступень)
дигидрофосфат-ион
Н2РО42- Н+ + НРО42- (вторая ступень)
гидрофосфат-ион
НРО42- Н+ + РО43-(третья ступень)
фосфат-ион
Диссоциация многоосновной кислоты протекает
главным образом по первой ступени, в меньшей степени по второй и
лишь в незначительной степени - по третьей.
Поэтому в водном растворе фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы
(в последовательно уменьшающихся количествах)
Н2РО42-, НРО42- и РО43-.
дигидрофосфат-ион
Н2РО42- Н+ + НРО42- (вторая ступень)
гидрофосфат-ион
НРО42- Н+ + РО43-(третья ступень)
фосфат-ион
Диссоциация многоосновной кислоты протекает
главным образом по первой ступени, в меньшей степени по второй и
лишь в незначительной степени - по третьей.
Поэтому в водном растворе фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы
(в последовательно уменьшающихся количествах)
Н2РО42-, НРО42- и РО43-.
Слайд 15Многокислотные основания диссоциируют ступенчато
Ca(ОН)2
Са(ОН)+ + OH- (первая ступень)
Ca(OH)+ Ca2+ + OH- (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид- ионы. Эти электролиты называются амфотерными
или амфолитами.
К ним относятся: вода, гидроксиды цинка, алюминия, хрома и ряд других веществ.
Вода диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O Н+ + ОН-
Ca(OH)+ Ca2+ + OH- (вторая ступень)
Однако имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид- ионы. Эти электролиты называются амфотерными
или амфолитами.
К ним относятся: вода, гидроксиды цинка, алюминия, хрома и ряд других веществ.
Вода диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O Н+ + ОН-
Слайд 16Диссоциация солей
Независимо от числа катионов и анионов кислотного остатка средние соли
диссоциируют в одну ступень:
Na2CO3 = 2Na+ + CO32-
Fe2(SO4)3 = 2Fe3+ + 3SO42-
Сu(NO3)2 = Cu2+ + 2 NO3-
Na2CO3 = 2Na+ + CO32-
Fe2(SO4)3 = 2Fe3+ + 3SO42-
Сu(NO3)2 = Cu2+ + 2 NO3-
Слайд 17Общие свойства кислот
Кислый вкус
Изменение окраски индикатора и др. обусловлены наличием катионов
водорода
Слайд 18Общие свойства оснований (щелочей)
Мылкость на ощупь
Изменение окраски индикатора
Гигроскопичность
Едкость и др. обусловлены
наличием ионов ОН- - гидроксид-ионов
Слайд 19Свойства солей
Определяются индивидуально
Зависят от катиона металла и аниона кислотного остатка
Соли аммония
– cвойства обусловлены наличием иона NH4+ и анионов кислотного остатка
Сульфаты – соли серной кислоты – определяются наличием иона SO42- и разными катионами металлов
Сульфаты – соли серной кислоты – определяются наличием иона SO42- и разными катионами металлов
Железный купорос
Медный купорос
Аммиачная
селитра
Слайд 20Напишите уравнения диссоциации для веществ
Азотная кислота
Сероводородная кислота
Кремниевая кислота
Хлорид натрия
Нитрат калия
Фосфат натрия
Сульфат
бария
Силикат калия
Гидроксид бария
Гидроксид лития
Гидроксид железа (III)
Силикат калия
Гидроксид бария
Гидроксид лития
Гидроксид железа (III)
Слайд 22Литература
О.С.Габриелян. Учебник химии 8 класс. М., «Дрофа», 2011
М.Ю.Горковенко. Поурочные разработки
по химии. 8 класс, М., «ВАКО», 2005
О.С.Габриелян, Н.П.Воскобойникова. Настольная книга учителя химии 8 класс, М., «Дрофа», 2002
http://images.yandex.ru
О.С.Габриелян, Н.П.Воскобойникова. Настольная книга учителя химии 8 класс, М., «Дрофа», 2002
http://images.yandex.ru