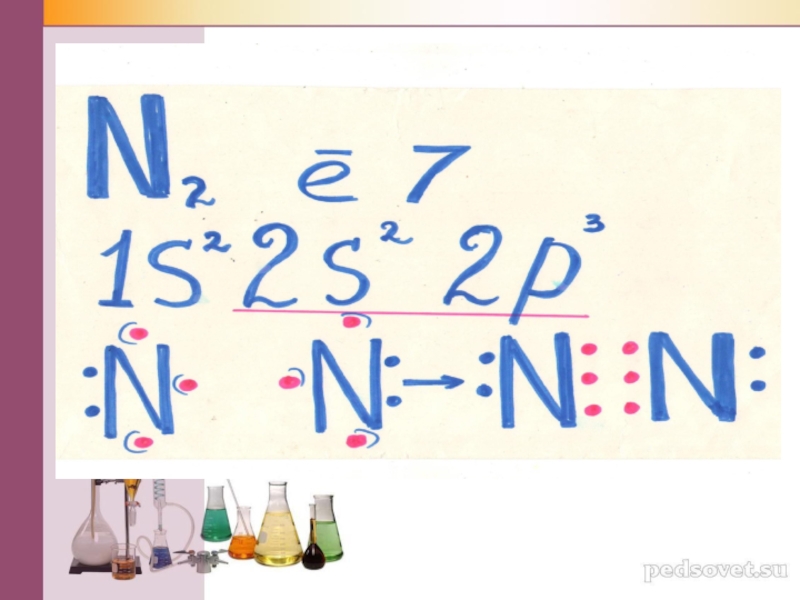производства аммиака
А.И.Попова МОУ «ООШ» пст.Диасёръя
- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок Как Азот уговорили делать добро
Содержание
- 1. Урок Как Азот уговорили делать добро
- 2. Девиз:
- 3. Слайд 3
- 4. Слайд 4
- 5. Учитель:Мы с вами отправимся в царство –
- 6. Вы, наверное, догадались, что Азот ведёт довольно
- 7. Изобразим строение молекулы азота в тетрадях. N2
- 8. Слайд 8
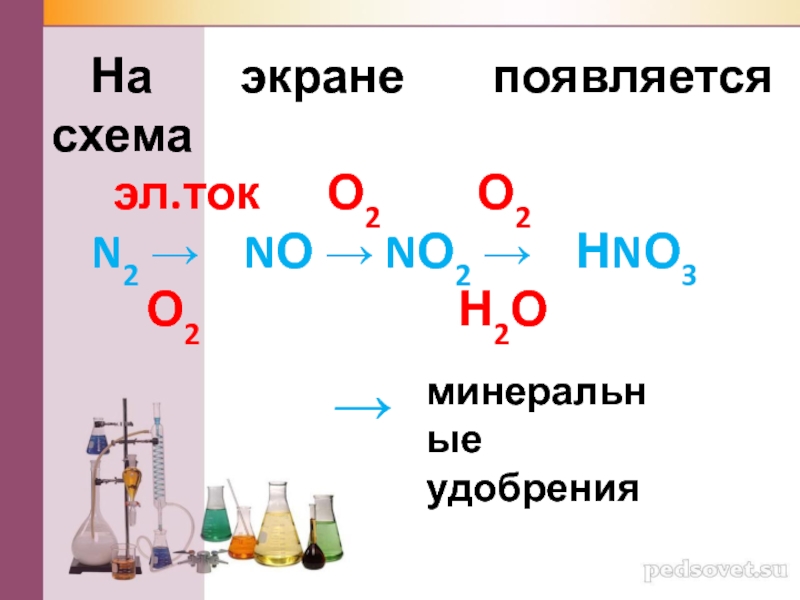
- 9. Кислород (появляется вездесущий кислород), который был крайне
- 10. На экране появляется схема эл.ток
- 11. Внимательно выслушав предложение кислорода, в разговор
- 12. Кислород. «Согласитесь, мне, как ближайшему соседу Азота,
- 13. Водород. «Это прекрасно! – воскликнул Водород. –
- 14. С этими словами Водород отправился к Азоту.
- 15. Водород. «Уважаемый Азот, не считаете ли вы,
- 16. Текст песни «Роксана Бабаян - Я Не
- 17. Водород. «Я сочувствую тебе, - сказал Водород,
- 18. Начались жаркие споры о добре и зле,
- 19. Спорщики не заметили, как вокруг собралась толпа,
- 20. Элемент Франий неожиданно вспомнил, что из таких
- 21. «Теперь без людей нам не обойтись, -
- 22. Итак, наша сказка подходит к концу. Как
- 23. Промышленное производство аммиака
- 24. Основные научные принципы химического производства
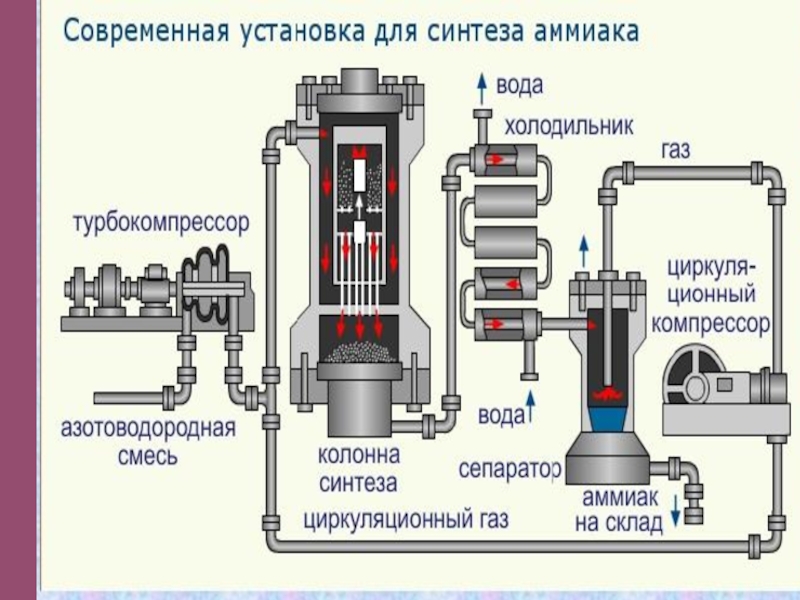
- 25. Современные производства
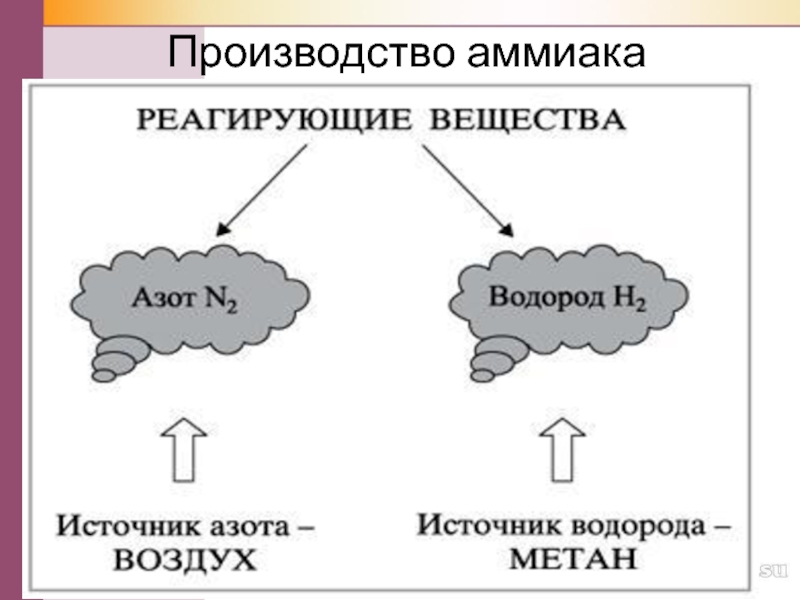
- 26. Производство аммиака
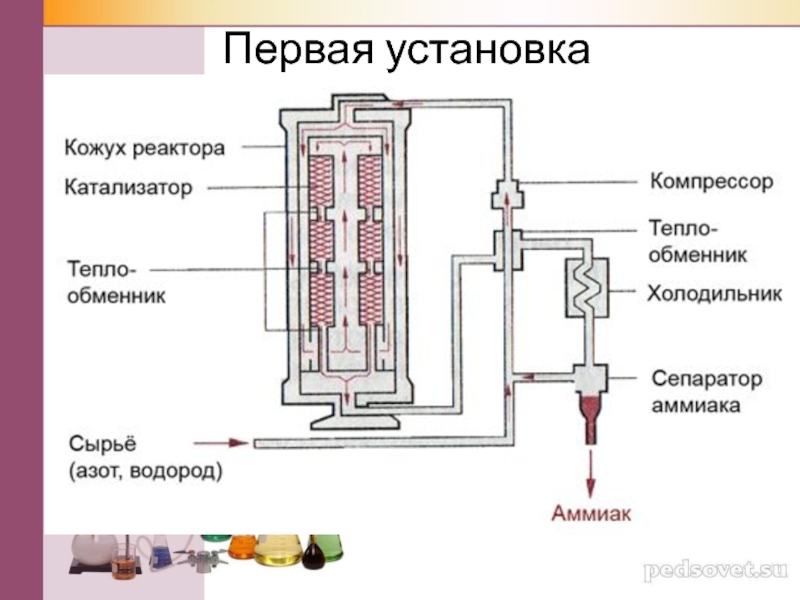
- 27. Первая установка
- 28. Химический процесс N2 + 3H2
- 29. Слайд 29
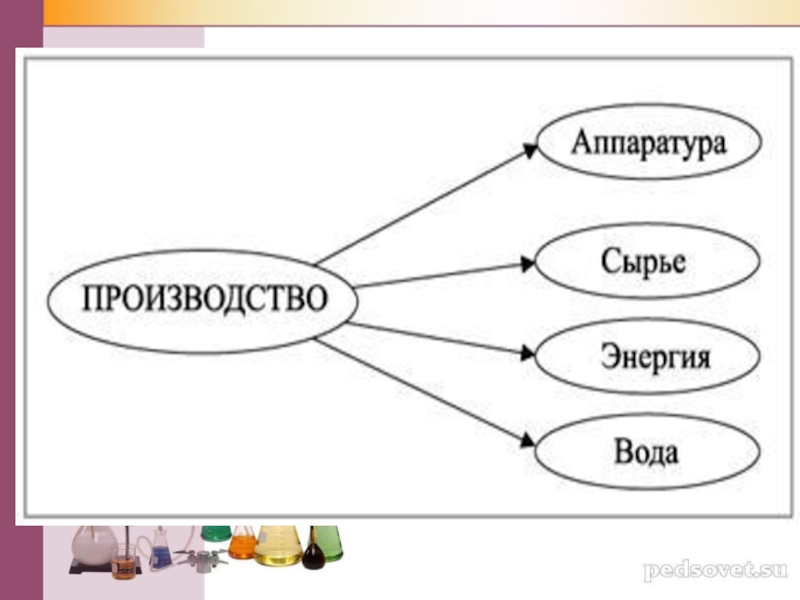
- 30. ПланСырьёАппаратураТехнологические принципыХимические процессы и условия их протеканияПродукт
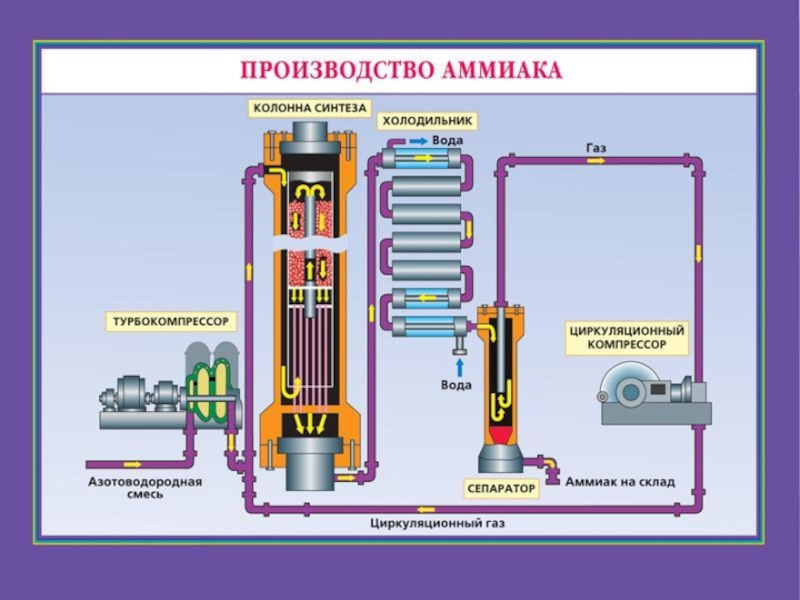
- 31. Производство аммиака
- 32. Слайд 32
- 33. Условия протекания реакцииТемпература 450-550 С оптимальнаяДавление 250-350
- 34. Из предложенных принципов выберите, характерные для данного производства.
- 35. Основные технологические принципыНепрерывность процессаПротивотокУтилизация теплоты реакцииТеплообменКомплексное использование сырья и отходов производстваЦиркуляционный процессПринцип кипящего слоя
- 36. «Чтобы закрепить материал сегодняшнего урока, рассмотрите данное
- 37. ответьте на следующие вопросы:Какое сырьё используется для
- 38. аммиак – сырьё для производства азотной кислоты.
- 39. Слайд 39
- 40. Слайд 40
- 41. Слайд 41
- 42. Слайд 42
- 43. Слайд 43
- 44. Слайд 44
- 45. Слайд 45
- 46. Слайд 46
- 47. Промышленный способ получения азотной кислоты из аммиака,
- 48. Свинья под Дубом вековымНаелась желудей досыта, до
- 49. Пусть сохнет, - говорит Свинья, - Ничуть
- 50. «Неблагодарная! – промолвил Дуб ей
- 51. Использованные ресурсыПолучение и применение аммиака http://www.eor.edu.ru/search.pageФото Габера
Девиз: Земля надежду вечную несётИ смотрит вдаль бессонными ночами
Слайд 5Учитель:Мы с вами отправимся в царство – «Химическое государство», где поближе
познакомимся с Азотом.
(Появляется Азот).
Азот - злой,
надменный,
обросший.
(Появляется Азот).
Азот - злой,
надменный,
обросший.
Слайд 6Вы, наверное, догадались, что Азот ведёт довольно замкнутый образ жизни, ни
с кем не желает поддерживать отношения. По-видимому, он очень высокого мнения о себе, и это не случайно, ведь у него огромные владения в атмосфере Земли, а кроме того, он возомнил себя близким родственником Благородных газов. И если мы ещё раз вспомним строение молекулы Азота, то убедимся в том, что у него есть на это основания.
Слайд 7Изобразим строение молекулы азота в тетрадях.
N2 – ковалентная неполярная связь
7N
– 1S22S22P3
׃ N ·+·N׃ → ׃N ::: N׃ → N = N
Учащиеся должны прокомменти-
ровать записи и сделать вывод о том, почему Азот вправе считать себя близким родственником Благородных газов.
׃ N ·+·N׃ → ׃N ::: N׃ → N = N
Учащиеся должны прокомменти-
ровать записи и сделать вывод о том, почему Азот вправе считать себя близким родственником Благородных газов.
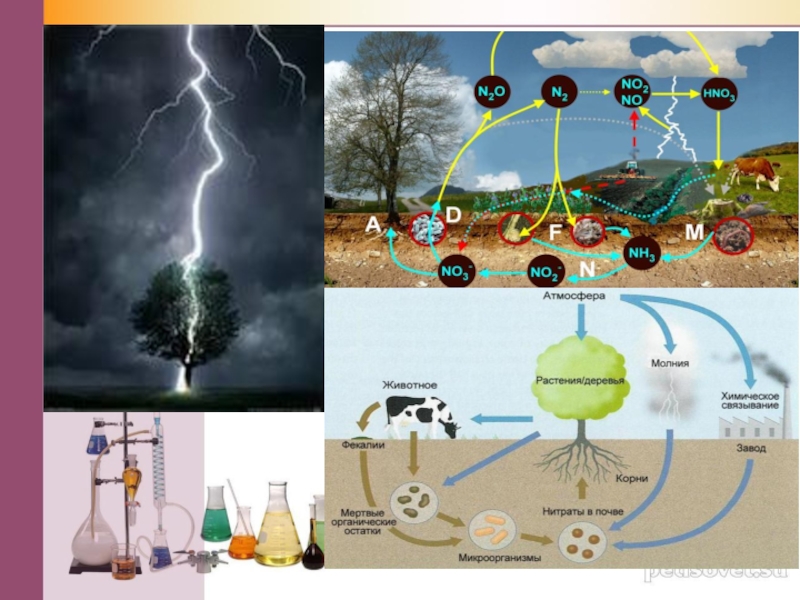
Слайд 9Кислород (появляется вездесущий кислород), который был крайне взволнован состоянием здоровья своих
родителей – растений: «Что с ним долго разговаривать? Давайте, подобно природной стихии, с помощью электрического разряда приведём его в шоковое состояние, а затем мои атомы быстро приведут его в чувство – и это будет уже не Азот».
Слайд 11Внимательно выслушав предложение кислорода, в разговор вмешался мудрый старец Водород.
Он был представителем более развитых внеземных цивилизаций и обычно,
в спорах за ним
оставалось
последнее слово:
Водород. «Я против
насилия и зла. Они не
могут породить добро.
Неужели никто из вас не
знает Азот с хороше
стороны?»
Слайд 12Кислород. «Согласитесь, мне, как ближайшему соседу Азота, виднее, и я утверждаю,
что в Азоте нет ничего хорошего», - заявил Кислород, известный своей вспыльчивостью. В его присутствии даже маленькая искра превращается в пламя. Он с усмешкой добавил: «Разве только то, что он, как и многие из нас, влюблён в красавицу Воду».
Слайд 13Водород. «Это прекрасно! – воскликнул Водород. – Если он способен на
высокое чувство – любовь, значит от него можно ожидать и благородных поступков».
Слайд 14С этими словами Водород отправился к Азоту. Он представился родственником Воды,
и Азот любезно его принял. Мудрость Водорода подсказала ему, что к цели своего визита нужно подойти издалека. Он завёл разговор о красоте Земли, утопающей в зелени, и в связи с этим они вспоминали о Воде, которая много трудится для процветания жизни на Земле. Водород почувствовал заинтересованность Азота в этом разговоре и рискнул изложить цель своего визита.
Слайд 15Водород. «Уважаемый Азот, не считаете ли вы, что при желании могли
бы помочь Воде сделать Землю ещё прекрасней?»
Азот. «Я не знаю, захочет ли она со мной общаться. Скажу вам по секрету, однажды я попробовал объясниться с ней и вот, что услышал в ответ».
Слайд 16Текст песни «Роксана Бабаян - Я Не Для Вас»
Возможно я и
не права,
Что ваши слушала слова.
И ничего не отвечала,
Что улыбалась и молчала.
Так это правила игры
Они известны и стары.
За этот взгляд,за этот вздох
Меня еще накажет бог
А то,что я тогда молчала-
Так это женское начало.
А что плечами повела-
Так я иначе не могла.
Я Вас могу поцеловать,
Я Вас могу околдовать,
Я Вас могу испепелить сияньем глаз.
Но не смотрите на меня
И берегитесь,как огня,
Я не для Вас…
Что ваши слушала слова.
И ничего не отвечала,
Что улыбалась и молчала.
Так это правила игры
Они известны и стары.
За этот взгляд,за этот вздох
Меня еще накажет бог
А то,что я тогда молчала-
Так это женское начало.
А что плечами повела-
Так я иначе не могла.
Я Вас могу поцеловать,
Я Вас могу околдовать,
Я Вас могу испепелить сияньем глаз.
Но не смотрите на меня
И берегитесь,как огня,
Я не для Вас…
Слайд 17Водород.
«Я сочувствую тебе, - сказал Водород, - но не печалься,
утро вечера мудренее. Я постараюсь тебе помочь». С нетерпением ждал Азот рассвета. И вот настал час встречи.
Водород:
«Чтобы обратить на себя внимание Воды, ты Азот, должен прославиться добрыми делами».
Азот:
«Но что такое добро?
Такое понятие мне неизвестно».
Водород:
«Чтобы обратить на себя внимание Воды, ты Азот, должен прославиться добрыми делами».
Азот:
«Но что такое добро?
Такое понятие мне неизвестно».
Слайд 18Начались жаркие споры о добре и зле, о бескорыстии и корыстолюбии,
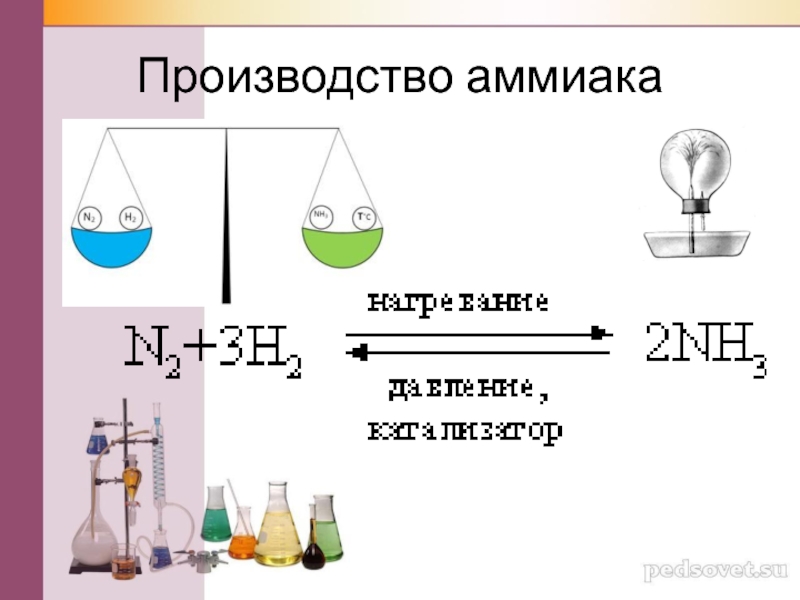
альтруизме и эгоизме. И всё-таки Водороду удалось кое в чём убедить Азот, передать ему чуточку своей мудрости. В результате Азот превращался в Аммиак, но, не уверенный в успехе дела, вновь возвращался к своим убеждениям, превращался в Азот. Казалось, спору не будет конца, так, как установилось динамическое равновесие:
N2 + 3Н2 ↔2NН3 + Q
N2 + 3Н2 ↔2NН3 + Q
Слайд 19Спорщики не заметили, как вокруг собралась толпа, которая была солидарна с
Водородом. И чтобы помочь ему одержать победу в споре, принцесса Химия направила к ним катализатор – Железо. В его присутствии споры шли более оживлённо, но равновесие не смещалось.
Fe
N2 + 3Н2 ↔2NН3 + Q
Fe
N2 + 3Н2 ↔2NН3 + Q
Слайд 20Элемент Франий неожиданно вспомнил, что из таких затруднительных положений умеет находить
выход его соотечественник Ле-Шателье, который предложил создать особые условия, способствующие течению процесса в желательном направлении
Слайд 21«Теперь без людей нам не обойтись, - задумчиво произнесла Химия. пришла
долгожданная весть от элемента Германия, что его соотечественник Габер близок к решению этой проблемы. Для волшебницы Химии нет преград, и она пригласила всех заглянуть в лабораторию Ф. Габера и понаблюдать за ходом его поиска.
Слайд 22Итак, наша сказка подходит к концу. Как и во всех сказках,
в нашей добро тоже побеждает зло. Союз природы, науки и человека позволил решить сложнейшую производственную проблему связывания молекулярного азота воздуха. Аммиак, полученный при определённых условиях в результате взаимодействия Азота с Водородом, оказался на редкость трудолюбивым: он работал на азотно-туковом комбинате, где совместно с кислотами создавал различные минеральные удобрения. На Азот в таком виде обратила внимание красавица Вода. И вот уже долгие они живут рядом в мире и согласии, своим трудом преображая Землю».
Слайд 30План
Сырьё
Аппаратура
Технологические принципы
Химические процессы и условия их протекания
Продукт
Слайд 33Условия протекания реакции
Температура 450-550 С оптимальная
Давление 250-350 атм или 25-35 Мпа
Катализатор
FeO+Fe2O3
Концентрация веществ
Концентрация веществ
N2 + 3H2 = 2 NH3 + Q
Слайд 35Основные технологические принципы
Непрерывность процесса
Противоток
Утилизация теплоты реакции
Теплообмен
Комплексное использование сырья и отходов производства
Циркуляционный
процесс
Принцип кипящего слоя
Принцип кипящего слоя
Слайд 36«Чтобы закрепить материал сегодняшнего урока, рассмотрите данное производство в соответствии с
известным вам планом, используя предложенную карту-схему,проработайте схему производства по предложенным вам карточкам.
Слайд 37ответьте на следующие вопросы:
Какое сырьё используется для производства аммиака?
Как его получают?
Реализация
каких технологических принципов позволяет обеспечить рентабельность производства?
Какое промышленное применение находит получаемый аммиак?
Какое промышленное применение находит получаемый аммиак?
Слайд 47Промышленный способ получения азотной кислоты из аммиака, позволил выпускать высококонцентрированные азотные
удобрения. Наверняка многие из вас в ходе урока задавали себе вопрос, стоило ли с таким трудом добиваться увеличения производства азотных удобрений, если повышенное содержание нитратов в продуктах питания наносит непоправимый вред здоровью человека. В связи с этим обычно ругают химию. А виновата ли в этом химия? Ответ на этот вопрос вы найдёте, послушав басню И.А.Крылова «Свинья под Дубом».
Слайд 48Свинья под Дубом вековым
Наелась желудей досыта, до отвала,
Наевшись, выспалась под ним,
Потом,
глаза продравши, встала
И рылом подрывать у дуба корни стала.
«Ведь это дереву вредит, -
Ей с дуба ворон говорит, -
Коль корни обнажишь, оно засохнуть может», -
.
И рылом подрывать у дуба корни стала.
«Ведь это дереву вредит, -
Ей с дуба ворон говорит, -
Коль корни обнажишь, оно засохнуть может», -
.
Слайд 49Пусть сохнет, - говорит Свинья, -
Ничуть меня то не тревожит,
В
нём проку мало вижу я,
Хоть век не будь, ничуть не пожалею,
Лишь были б жёлуди: ведь я от них жирею»
Хоть век не будь, ничуть не пожалею,
Лишь были б жёлуди: ведь я от них жирею»
Слайд 50«Неблагодарная! – промолвил Дуб ей тут, -
Когда бы
вверх могла поднять ты рыло,
Тебе бы видно было,
Что эти жёлуди на мне растут».
Невежда также в ослепленье
Бранит науку и ученье,
И все учёные труды,
Не чувствуя, что он вкушает их плоды.
Тебе бы видно было,
Что эти жёлуди на мне растут».
Невежда также в ослепленье
Бранит науку и ученье,
И все учёные труды,
Не чувствуя, что он вкушает их плоды.
Слайд 51Использованные ресурсы
Получение и применение аммиака http://www.eor.edu.ru/search.page
Фото Габера Ф. http://www.google.ru/imglanding?q=габер&hl=ru&newwindow=1&sa=X&rlz=1C1CHOL_ruRU411RU413&tbs=isch:1&prmd=ivns&tbnid=4RiFWvWihsgWKM:&imgrefurl=http://supotnitskiy.ru/book/book5_kommentarii11
Традиционная схема получения
аммиака из природного газа http://www.newchemistry.ru/letter.php?n_id=4156&cat_id=5&page_id=1
4.химия в школе №2 1990г. Л.С.Левина Репортаж с урока
4.химия в школе №2 1990г. Л.С.Левина Репортаж с урока