- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Урок химии в 9 классе- красный фосфор
Содержание
- 1. Урок химии в 9 классе- красный фосфор
- 2. "визитка химического элемента"порядковый номер:15период:IIIгруппа:Vподгруппа:главная
- 3. Хенниг Бранд-немецкий алхимик. Считается, что в
- 4. Бранд тут же начал эксперименты по превращению
- 5. Слайд 5
- 6. Физиологическое действие белого фосфораРезультат применения чрезмерного
- 7. Слайд 7
- 8. Фосфор в природеФосфор в природеФосфор встречается только
- 9. Взаимодействие фосфора с кислородомВзаимодействие фосфора с кислородом
- 10. химическая активность красного фосфораРс металламиС неорганическимивеществамис неметалламиВ
- 11. взаимодействие фосфора с металламиNa + P =Na3P2000CCa
- 12. взаимодействие фосфора с неметаллами4P + 3O2 =
- 13. Взаимодействие фосфора с неорганическими соединениямиВзаимодействие фосфора с
- 14. Промышленный способ полученияПромышленный способ полученияВ промышленности фосфор
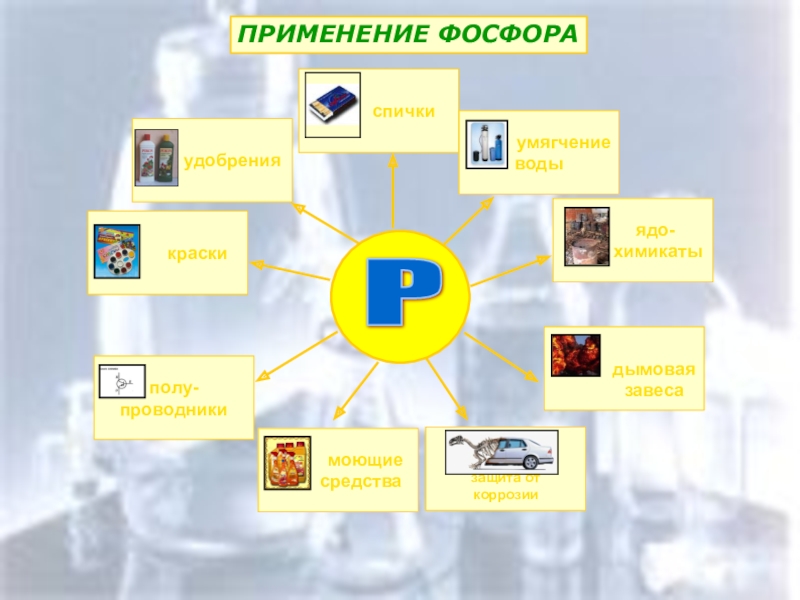
- 15. ПРИМЕНЕНИЕ ФОСФОРА
Слайд 3
Хенниг Бранд-немецкий алхимик. Считается, что в 1669 году он открыл
Потерпев неудачу в попытках получить золото с помощью открытого элемента, начал торговлю последним, потом продал и сам секрет.
Скончался около 1710 года.Хенниг Бранд уверовал, что «первичная материя» содержится в человеческой моче. С этой целью он собрал в солдатских казармах несколько бочек мочи. Затем Бранд медленно выпаривал собранную мочу. В результате этой процедуры он получил сиропообразную жидкость, которую дважды подверг дистилляции. В результате получилась некая субстанция, названная им «мёртвая голова». Далее Бранд прокаливал «мёртвую голову» с песком и углём без доступа воздуха. Нагревание получившегося продукта приводило к образованию белой пыли, медленно оседавшей на дно реторты и светившейся в темноте. Бранд в великой радости принял получившееся вещество за «первичную материю» и назвал фосфором, то есть светоносцем.
Слайд 4Бранд тут же начал эксперименты по превращению полученного вещества (или других
Независимо от Бранда и Кункеля фосфор был получен Робертом Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», которая датирована 14 октября 1680 года, а опубликована в 1693 году.Усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
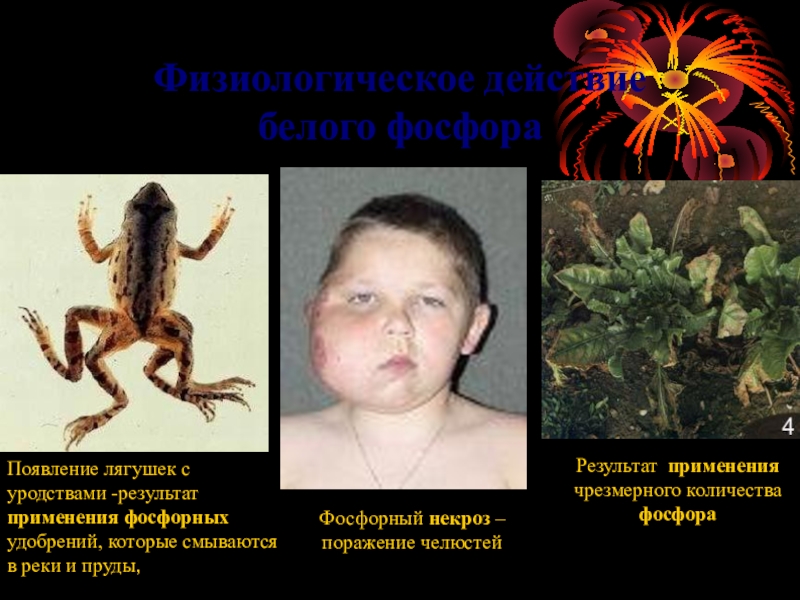
Слайд 6Физиологическое действие
белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с
Фосфорный некроз – поражение челюстей
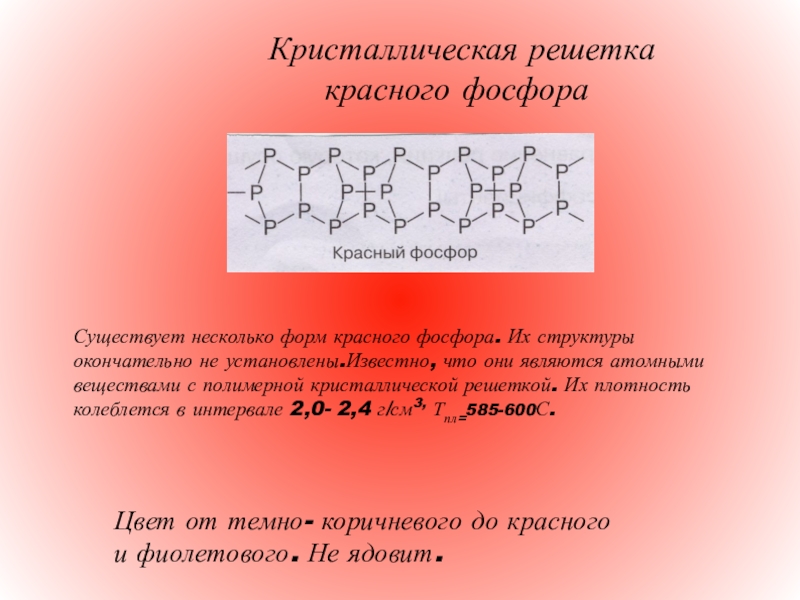
Слайд 7 Кристаллическая
Существует несколько форм красного фосфора. Их структуры окончательно не установлены.Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их плотность колеблется в интервале 2,0- 2,4 г/см3, Тпл=585-600С.
Цвет от темно- коричневого до красного и фиолетового. Не ядовит.
Слайд 8Фосфор в природе
Фосфор в природе
Фосфор встречается только в химически связанном виде
Слайд 9Взаимодействие фосфора с кислородом
Взаимодействие фосфора с кислородом
самовоспламенение на воздухе
4Р(красный) + 5О2 = Р4О10
выше 4000С
4Р (черный) + 5О2 = Р4О10
загорается с большим трудом
В обычных условиях химическая активность фосфора во многом зависит, в какой аллотропной форме он находится. Самым активным является белый фосфор, за счет малой прочности Р-Р связи в молекуле Р4
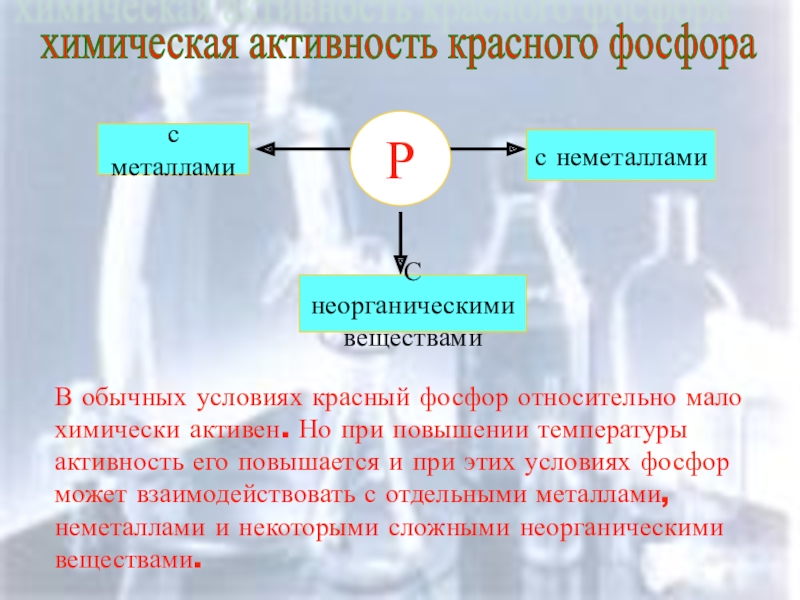
Слайд 10химическая активность красного фосфора
Р
с металлами
С неорганическими
веществами
с неметаллами
В обычных условиях красный фосфор
Слайд 11взаимодействие фосфора с металлами
Na + P =
Na3P
2000C
Ca + P =
Ca3P2
2
2
3
350-4500C
Фосфор относительно
Ca3P2 + H2O = Ca(OH)2 + PH3
фосфин
Слайд 12взаимодействие фосфора с неметаллами
4P + 3O2 = P4O6 (при недостатке
P4 + 5O2 = P4O10 (при избытке кислорода)
2P + 5F2 = 2PF5
2P + 3CI2 = 2PCI3 (30-400C)
Наиболее легко идут реакции с кислородом и галогенами.