- Главная
- Разное
- Образование
- Спорт
- Естествознание
- Природоведение
- Религиоведение
- Французский язык
- Черчение
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, фоны, картинки для презентаций
- Экология
- Экономика
Презентация, доклад на тему Универсальная методика для решения расчётных химических задач
Содержание
- 1. Универсальная методика для решения расчётных химических задач
- 2. Учитель химии высшей категории ГБОУ СОШ №1980
- 3. В настоящее используется несколько методик решения расчётных
- 4. Схема - таблицаМною разработана
- 5. Химическое равновесиеСостояние химического равновесия характеризуется константой равновесия
- 6. Исходные концентрации веществ, взаимодействие которых протекает по
- 7. Задачи для самостоятельного решения 1.Через некоторый промежуток
- 8. Степень и константа диссоциации Степенью диссоциации Для слабых электролитов применяют константу диссоциации Кд.
- 9. Водный раствор плавиковой кислоты содержит 2 г
- 10. Задачи для самостоятельного решения1. В 1 литре
- 11. Выравнивание масс веществ в растворе
- 12. Через раствор хлорида железа (II) объемом 100
- 13. Определение состава и концентрации растворов
- 14. Цинк массой 6,5 г растворили в 300
- 15. Задачи для самостоятельного решения1.
- 16. Данная методика позволяет сократить время на решение расчётных задач. Она применима для различных тем
- 17. «Feci quod potui, faciant meliora potentes»«Я сделал, что мог; кто может, пусть сделает лучше»Цицерон
- 18. КОНТАКТЫ:
Слайд 1Универсальная методика
для решения расчётных химических задач
Как много нам открытий чудных
Готовит
И опыт, сын ошибок трудных,
И гений, парадоксов друг…
А.С. Пушкин
Слайд 2Учитель химии высшей категории ГБОУ СОШ №1980 г Москвы.
Педагогический стаж
Почетный работник общего образования РФ.
Победитель конкурса лучших учителей РФ 2006,2011г.
Лауреат «Гранта Москвы» 2010г.
Эксперт ЕГЭ по химии.
Методист ООО «БИНОМ лаборатории знаний».
Автор книги «Готовимся к ЕГЭ по химии».
Автор 11 публикаций в журналах «Химия в школе», «Химия. Все для учителя», «Образование в современной школе», «Химия для школьников» и «Химия . 1 сентября»
Соавтор сборника «Программа по химии. Основная школа: 8-9 классы»
Методист создания учебника «Химия. Учебник для 8-9 класса», автор Д.М. Жилина
Барышова Ирина Валентиновна
Слайд 3В настоящее используется несколько методик решения расчётных химических задач. Однако все
Слайд 4
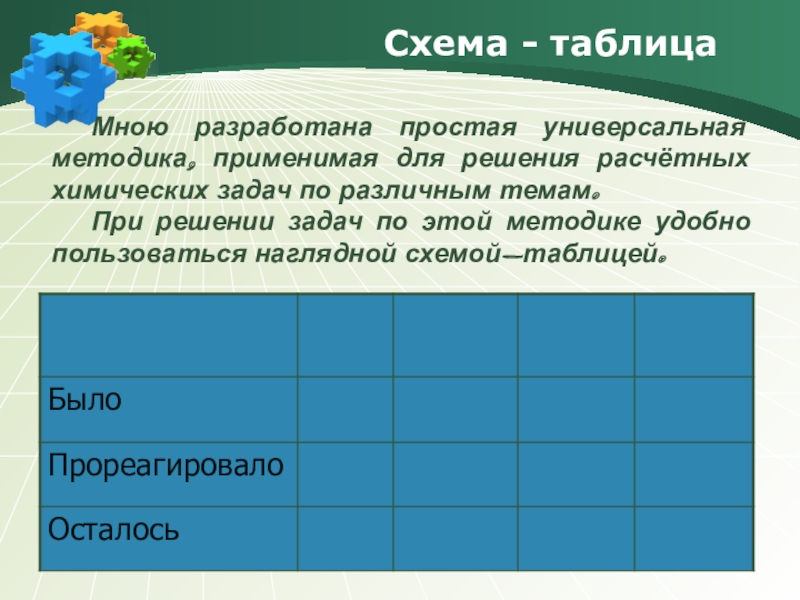
Схема - таблица
Мною разработана простая универсальная методика,
При решении задач по этой методике удобно пользоваться наглядной схемой-таблицей.
Слайд 5Химическое равновесие
Состояние химического равновесия характеризуется константой равновесия , равной отношению констант
Для реакции аА+вВ ↔ сС+dD
[A],[B],[C],[D] – равновесные концентрации веществ A,B,C,D.
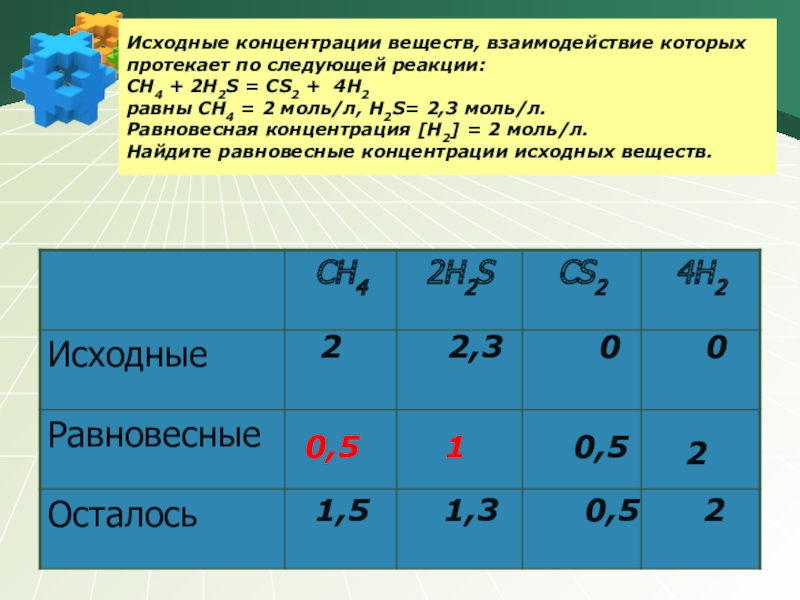
Слайд 6Исходные концентрации веществ, взаимодействие которых протекает по следующей реакции: CH4 +
2 2,3 0 0
2
0,5 1 0,5
1,5 1,3 0,5 2
Слайд 7Задачи для самостоятельного решения
1.Через некоторый промежуток времени после начала реакции 3А
Ответ: 3 моль/л.
2. Константа равновесия реакции FeO+ CO = Fe +CO2
равна 0,5. Найти равновесные концентрации CO и CO2,
если их начальные [CO]=0,05 моль/л, [CO2] = 0,01 моль/л.
Ответ: 0,04 моль/л; 0,02 моль/л.
3. Концентрации исходных веществ, участвующих в реакции
2А + В = C + 3D, составляют по 4 моль/л. После установления равновесия концентрации вещества
[D] = 1,5 моль/л. Найти равновесную концентрацию [А].
Ответ: 3 моль/л.
Слайд 8Степень и константа диссоциации
Степенью диссоциации
Для слабых электролитов применяют
константу диссоциации Кд.
Слайд 9Водный раствор плавиковой кислоты содержит 2 г кислоты в 1 литре
HF=H + Fˉ
=
7
7
=
+
0,1
0,08
0,1 – 0,08
0,08
0,08
0,08
0,08
Слайд 10Задачи для самостоятельного решения
1. В 1 литре азотистой кислоты содержится 6,5*1022
непродиссоциированных молекул и образовавшихся ионов.Определите степень диссоциации.
Ответ: 2,16%.
2. Константа диссоциации синильной кислоты равна 7,9*10-10
Найти степень диссоциации HCN в 0,001 М растворе.
Ответ: 8,9 10-4
3. Константа диссоциации масляной кислоты 1,5*10-5
Вычислите степень её диссоциации в 0,005 М растворе.
Ответ: 0,055
Слайд 12Через раствор хлорида железа (II) объемом 100 мл с массовой долей
2FeCl2 + Cl2 =2FeCl3
По условию m(FeCl2)= m(FeCl3)
(0,1-x) 127=162,5 x
12,7=162,5x + 127x
X=0,04387 моль
V(Cl2)=0,5X*Vm=0,5*0,04387*22,4 = 0,49 л
0,1
х
0,5х
0,1-х
х
Слайд 14
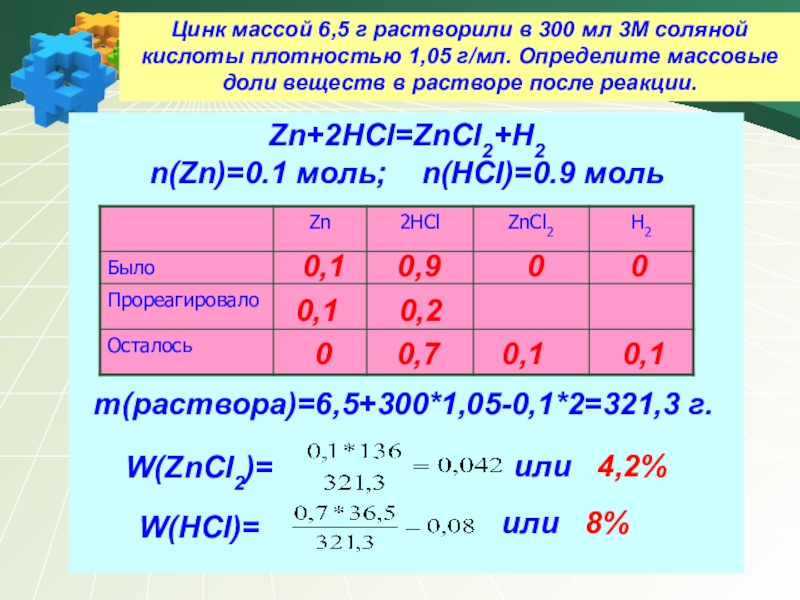
Цинк массой 6,5 г растворили в 300 мл 3М соляной кислоты
Zn+2HCl=ZnCl2+H2
n(Zn)=0.1 моль; n(HCl)=0.9 моль
m(раствора)=6,5+300*1,05-0,1*2=321,3 г.
W(ZnCl2)=
или 4,2%
W(HCl)=
или 8%
0
0,7
0,1 0,9 0 0
0,1 0,2
0,1 0,1
Слайд 15Задачи для самостоятельного решения
1. Фосфор, количественно выделенный из
Ответ: 7,6% K2HPO4, 6% KH2PO4
2. Карбонат калия массой 12,5 г сплавили с оксидом алюминия массой 5,1 г. Весь сплав растворили в 200 мл 15%-й азотной кислоты ( P 1,05 г/мл). Рассчитайте массовую долю азотной кислоты в полученном растворе.
Ответ: 0, 56%
3. К раствору, полученному при добавлении 8 г гидрида лития к 1 л воды, прилили 100 мл 8,5%-го раствора соляной кислоты (плотностью 1,04 г/мл). Определите массовые доли растворённых веществ в полученном растворе.
Ответ: 0,92% LiCl 1,6% LiOH
Слайд 16
Данная методика позволяет сократить время на решение расчётных задач.
Она применима
Слайд 17«Feci quod potui, faciant meliora potentes»
«Я сделал, что мог; кто может,
Цицерон